名校
1 . 实验室为制备和收集少量干燥、纯净的氯气,选用如图所示仪器及药品:
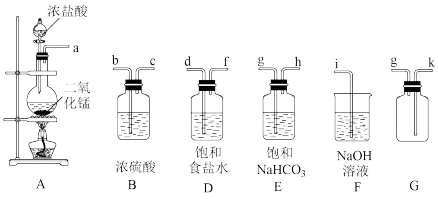
(1)上述实验中,用来盛放浓盐酸的仪器的名称是_______ ,
(2)制取氯气的离子反应方程式为_______ 。
(3)选择上述仪器并按顺序连接(填各接口处的字母):a→_______ →k→g→i。
(4)如图是一组探究氯气性质的装置。
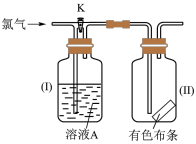
现关闭活塞K,若有色布条是干燥的,溶液A为浓硫酸,则有色布条_______ (填现象,下同)。
(5)现打开K,溶液A为氢氧化钠溶液,通入的氯气是湿润的,布条是干燥的,则有色布条_______ 。
(6)制得的Cl2通过盛有饱和食盐水的装置,目的是______ 。
(7)Cl2通入双氧水(H2O2)水溶液中会产生使带有火星的木条复燃,写出在水溶液中Cl2和H2O2反应的离子方程式_______ 。
(8)若需要制取0.1molCl2(标准状况),需要MnO2的质量为________ 克?(简要计算过程)
(9)若用含0.2molHCl的浓盐酸与足最的MnO2反应制取Cl2,制得Cl2体积_______ (填“>”“<”或“=”)1.12L(标准状况)。

(1)上述实验中,用来盛放浓盐酸的仪器的名称是
(2)制取氯气的离子反应方程式为
(3)选择上述仪器并按顺序连接(填各接口处的字母):a→
(4)如图是一组探究氯气性质的装置。

现关闭活塞K,若有色布条是干燥的,溶液A为浓硫酸,则有色布条
(5)现打开K,溶液A为氢氧化钠溶液,通入的氯气是湿润的,布条是干燥的,则有色布条
(6)制得的Cl2通过盛有饱和食盐水的装置,目的是
(7)Cl2通入双氧水(H2O2)水溶液中会产生使带有火星的木条复燃,写出在水溶液中Cl2和H2O2反应的离子方程式
(8)若需要制取0.1molCl2(标准状况),需要MnO2的质量为
(9)若用含0.2molHCl的浓盐酸与足最的MnO2反应制取Cl2,制得Cl2体积
您最近一年使用:0次
2 . 二氧化氯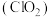 常温下为气体,是一种高效、广谱、安全的杀菌消毒剂。某兴趣小组通过图1装置(夹持装置略)对二氧化氯制备、吸收、释放和应用进行了研究。(已知:装置A中反应生成
常温下为气体,是一种高效、广谱、安全的杀菌消毒剂。某兴趣小组通过图1装置(夹持装置略)对二氧化氯制备、吸收、释放和应用进行了研究。(已知:装置A中反应生成 气体和
气体和 气体)
气体)
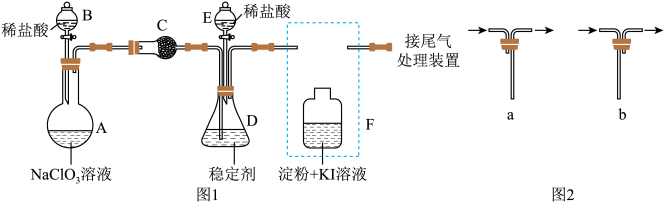
(1)仪器A的名称是___________ 。
(2)打开B的活塞,为使 在D中被稳定剂充分吸收,滴加稀盐酸的速度宜
在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___________ (填“快”或“慢”)。
(3)关闭B的活塞, 在D中被稳定剂完全吸收生成
在D中被稳定剂完全吸收生成 ,此时F中溶液的颜色不变,则装置C的作用是
,此时F中溶液的颜色不变,则装置C的作用是___________ 。
(4)已知在酸性条件下 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 (不考虑其他副反应),在
(不考虑其他副反应),在 释放实验中,打开E的活塞,D中发生反应,则装置F的作用是
释放实验中,打开E的活塞,D中发生反应,则装置F的作用是___________ ,安装F中导管时,应选用图2中的___________ (填字母序号)。
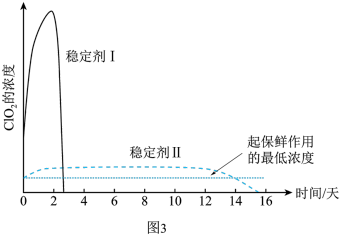
(5)已吸收 气体的稳定剂I和稳定剂II,加酸后释放
气体的稳定剂I和稳定剂II,加酸后释放 的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是
的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是___________ ,原因是___________ 。
(6)自来水厅用碘量法检测水中 的浓度,其实验操作如下:取水样,酸化,加入足量的碘化钾,用氢氧化钠溶液调至中性,加入淀粉溶液。再用
的浓度,其实验操作如下:取水样,酸化,加入足量的碘化钾,用氢氧化钠溶液调至中性,加入淀粉溶液。再用 标准溶液滴定碘单质(
标准溶液滴定碘单质( )。达到滴定终点时现象为
)。达到滴定终点时现象为___________ 。
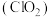 常温下为气体,是一种高效、广谱、安全的杀菌消毒剂。某兴趣小组通过图1装置(夹持装置略)对二氧化氯制备、吸收、释放和应用进行了研究。(已知:装置A中反应生成
常温下为气体,是一种高效、广谱、安全的杀菌消毒剂。某兴趣小组通过图1装置(夹持装置略)对二氧化氯制备、吸收、释放和应用进行了研究。(已知:装置A中反应生成 气体和
气体和 气体)
气体)
(1)仪器A的名称是
(2)打开B的活塞,为使
 在D中被稳定剂充分吸收,滴加稀盐酸的速度宜
在D中被稳定剂充分吸收,滴加稀盐酸的速度宜(3)关闭B的活塞,
 在D中被稳定剂完全吸收生成
在D中被稳定剂完全吸收生成 ,此时F中溶液的颜色不变,则装置C的作用是
,此时F中溶液的颜色不变,则装置C的作用是(4)已知在酸性条件下
 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 (不考虑其他副反应),在
(不考虑其他副反应),在 释放实验中,打开E的活塞,D中发生反应,则装置F的作用是
释放实验中,打开E的活塞,D中发生反应,则装置F的作用是(5)已吸收
 气体的稳定剂I和稳定剂II,加酸后释放
气体的稳定剂I和稳定剂II,加酸后释放 的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是
的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是
(6)自来水厅用碘量法检测水中
 的浓度,其实验操作如下:取水样,酸化,加入足量的碘化钾,用氢氧化钠溶液调至中性,加入淀粉溶液。再用
的浓度,其实验操作如下:取水样,酸化,加入足量的碘化钾,用氢氧化钠溶液调至中性,加入淀粉溶液。再用 标准溶液滴定碘单质(
标准溶液滴定碘单质( )。达到滴定终点时现象为
)。达到滴定终点时现象为
您最近一年使用:0次
名校
解题方法
3 . 某校化学兴趣小组为研究Cl2 的性质,设计如图所示装置进行实验,装置Ⅲ中夹持装置已略去,其中a 为干燥的品红试纸,b 为湿润的品红试纸。
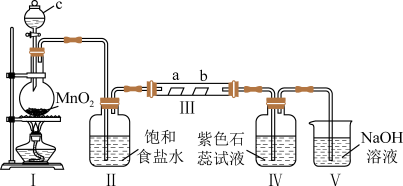
(1)实验室以二氧化锰和浓盐酸制备 Cl2 的化学方程式为___________ 。
(2)仪器c 的名称为___________ ,装置Ⅱ的作用是___________ 。
(3)若产生的Cl2 足量,实验过程中装置Ⅳ的实验现象为___________ 。
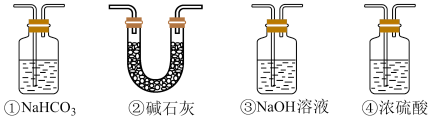
(4)实验结束后,该组同学在装置Ⅲ中观察到 b 的红色褪去,但是并未观察到“a 无明显变化”这一预期现象,为达到这一目的,你认为还需在装置Ⅱ与Ⅲ之间添加图中的_______ 装置(填序号)。

(1)实验室以二氧化锰和浓盐酸制备 Cl2 的化学方程式为
(2)仪器c 的名称为
(3)若产生的Cl2 足量,实验过程中装置Ⅳ的实验现象为
(4)实验结束后,该组同学在装置Ⅲ中观察到 b 的红色褪去,但是并未观察到“a 无明显变化”这一预期现象,为达到这一目的,你认为还需在装置Ⅱ与Ⅲ之间添加图中的

您最近一年使用:0次
4 . 化学小组同学为研究氯气制备和氯水的成分及性质进行了如下实验。
【实验1】制备氯气。下图是实验室制取纯净、干燥氯气装置图。
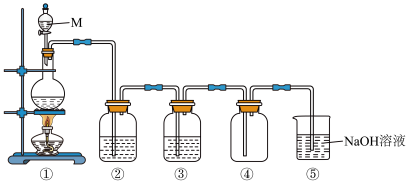
(1)M仪器的名称是___________ ,①中反应的反应的化学方程式是___________ 。
(2)③中存放的试剂是___________ 。
(3)⑤中反应的离子方程式是___________ 。
【实验2】研究氯水性质。实验操作及现象如下表。
资料:淀粉的特征反应——遇 变蓝色
变蓝色
(4)实验2-1可证明氧化性
___________  (填“>”或“<”);实验2-2中使溶液褪色的粒子是
(填“>”或“<”);实验2-2中使溶液褪色的粒子是___________ 。
(5)证明氯水中含有氯离子的方案是___________ 。
(6)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。
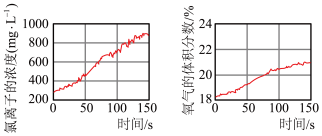
上两图中曲线变化的原因是___________ 。
【实验1】制备氯气。下图是实验室制取纯净、干燥氯气装置图。

(1)M仪器的名称是
(2)③中存放的试剂是
(3)⑤中反应的离子方程式是
【实验2】研究氯水性质。实验操作及现象如下表。
资料:淀粉的特征反应——遇
 变蓝色
变蓝色| 实验2-1 | 实验2-2 | |
| 实验操作(氯水均为新制) | 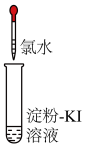 | 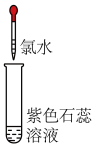 |
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 |

 (填“>”或“<”);实验2-2中使溶液褪色的粒子是
(填“>”或“<”);实验2-2中使溶液褪色的粒子是(5)证明氯水中含有氯离子的方案是
(6)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。

上两图中曲线变化的原因是
您最近一年使用:0次
解题方法
5 . 某同学利用如图装置制备并收集干燥纯净的 ,并探究
,并探究 与碱的反应。回答下列问题:
与碱的反应。回答下列问题:

(1)仪器a的名称为_______ ,装置A中发生反应的化学方程式为_______ 。
(2)装置B的作用是______________ 。
(3)装置D用来收集干燥的氯气,进气口为_______ (填“m”或“n”)。
(4)若将 通入冷的
通入冷的_______ (填试剂)中,即制得漂白粉。
(5)探究 的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
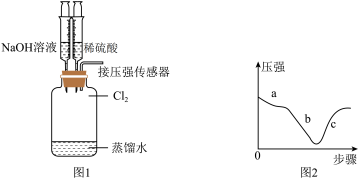
实验步骤如下:
ⅰ.向装置D中加入适量的蒸馏水,振荡;
ⅱ.用注射器向装置D中注入 溶液;
溶液;
ⅱ.用注射器向装置D中注入稀硫酸。
①步骤ⅰ压强减小的原因是______________ 。
②步骤ⅱ中 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为______________ 。
③步骤ⅲ,装置D中的现象为______________ 。
 ,并探究
,并探究 与碱的反应。回答下列问题:
与碱的反应。回答下列问题:
(1)仪器a的名称为
(2)装置B的作用是
(3)装置D用来收集干燥的氯气,进气口为
(4)若将
 通入冷的
通入冷的(5)探究
 的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
的性质。取出装置D,按图1装置用压强传感器测定集气瓶内的压强,压强随实验步骤变化的曲线如图2所示。
实验步骤如下:
ⅰ.向装置D中加入适量的蒸馏水,振荡;
ⅱ.用注射器向装置D中注入
 溶液;
溶液;ⅱ.用注射器向装置D中注入稀硫酸。
①步骤ⅰ压强减小的原因是
②步骤ⅱ中
 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为③步骤ⅲ,装置D中的现象为
您最近一年使用:0次
名校
解题方法
6 . 已知氯气与强碱溶液反应时,生成的产物受温度的影响。实验室中利用如图1装置(部分装置省略)制备KClO3和NaClO,并探究其氧化还原性质。
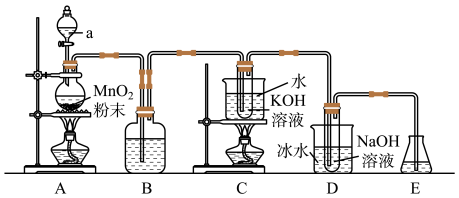
图1
回答下列问题:
(1)仪器a的名称是_______ 。
(2)装置A产生氯气的化学方程式为_______ 。
(3)装置B中的试剂为_______ ,该装置作用为_______ 。
(4)装置C采用的加热方式是_______ ,装置D中发生反应的离子方程式为_______ 。
(5)装置E的作用是_______ ,可选用试剂_______ 。(填标号)
a.NaCl溶液b.NaOH溶液c.稀硫酸
(6)探究KClO3和NaClO的氧化能力(图2)
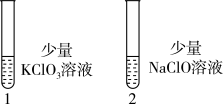
图2
操作:向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3_______ NaClO。(填“大于”或“小于”)
(7)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,请写出该反应的离子方程式_______ 。

图1
回答下列问题:
(1)仪器a的名称是
(2)装置A产生氯气的化学方程式为
(3)装置B中的试剂为
(4)装置C采用的加热方式是
(5)装置E的作用是
a.NaCl溶液b.NaOH溶液c.稀硫酸
(6)探究KClO3和NaClO的氧化能力(图2)

图2
操作:向1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3
(7)工业上常用氯碱工业来制备氯气,其原理为电解饱和食盐水,生成氯气的同时还可得到氢气和烧碱,请写出该反应的离子方程式
您最近一年使用:0次
2023-03-13更新
|
322次组卷
|
3卷引用:吉林省吉林市普通高中2022-2023学年高一上学期期末考试化学试题
吉林省吉林市普通高中2022-2023学年高一上学期期末考试化学试题(已下线)第08讲 氯气的实验室制法及氯离子的检验-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)四川省宜宾市叙州区第一中学校2023-2024学年高一上学期10月月考化学试题
名校
解题方法
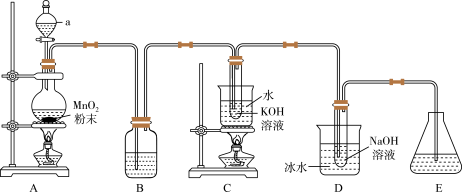
7 . 已知氯气与强碱溶液反应时,产物受温度的影响。实验室中利用如图装置(部分装置省略)制备 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
回答下列问题:
(1)仪器a的名称是___________ 。
(2)装置A制备氯气的离子方程式为___________ 。装置B中的试剂为___________ 。
(3)装置C中发生反应的化学方程式___________ 。
(4) 、KCl的溶解度曲线如下图所示,反应结束取出C中试管内制得的
、KCl的溶解度曲线如下图所示,反应结束取出C中试管内制得的 热饱和溶液,经
热饱和溶液,经___________ ,___________ ,洗涤,干燥,得到 晶体。
晶体。
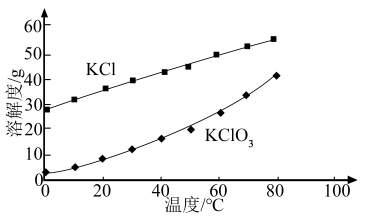
(5)推测装置D使用冰水的原因___________ 。
(6)在40℃条件下,将一定量的 通入一定量的NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
通入一定量的NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,已知
,已知 和
和 的物质的量之比为11:1,则此过程中氧化剂和还原剂的物质的量之比为
的物质的量之比为11:1,则此过程中氧化剂和还原剂的物质的量之比为___________ 。
(7)探究 和NaClO的氧化能力
和NaClO的氧化能力
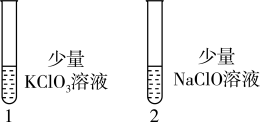
操作:向1号( )和2号(NaClO)试管中,滴加中性KI溶液。
)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力
___________ NaClO。(填“大于”或“小于”)。
 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
回答下列问题:
(1)仪器a的名称是
(2)装置A制备氯气的离子方程式为
(3)装置C中发生反应的化学方程式
(4)
 、KCl的溶解度曲线如下图所示,反应结束取出C中试管内制得的
、KCl的溶解度曲线如下图所示,反应结束取出C中试管内制得的 热饱和溶液,经
热饱和溶液,经 晶体。
晶体。
(5)推测装置D使用冰水的原因
(6)在40℃条件下,将一定量的
 通入一定量的NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
通入一定量的NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,已知
,已知 和
和 的物质的量之比为11:1,则此过程中氧化剂和还原剂的物质的量之比为
的物质的量之比为11:1,则此过程中氧化剂和还原剂的物质的量之比为(7)探究
 和NaClO的氧化能力
和NaClO的氧化能力
操作:向1号(
 )和2号(NaClO)试管中,滴加中性KI溶液。
)和2号(NaClO)试管中,滴加中性KI溶液。现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力

您最近一年使用:0次
解题方法
8 . 高铁酸钠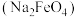 是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备
是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备 溶液,再用制得的
溶液,再用制得的 溶液在碱性条件下与
溶液在碱性条件下与 溶液反应制备
溶液反应制备 ,原理
,原理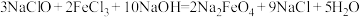 。
。
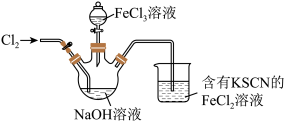
回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为_______ ,其杀菌作用是基于它具有_______ 性。
(2)用双线桥法标出反应 的电子转移方向及数目
的电子转移方向及数目_______ ,根据该制备原理可知氧化性
_______  (填“>”或“<”)。
(填“>”或“<”)。
(3)当烧杯中出现_______ 现象时,说明通入的氯气已经过量。
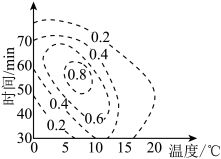
(4) 的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示
的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示 的理论产率),则制备
的理论产率),则制备 的最适宜的条件范围是
的最适宜的条件范围是_______ 。
(5)制备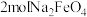 ,至少需要标准状况下的氯气
,至少需要标准状况下的氯气_______ L。
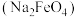 是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备
是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备 溶液,再用制得的
溶液,再用制得的 溶液在碱性条件下与
溶液在碱性条件下与 溶液反应制备
溶液反应制备 ,原理
,原理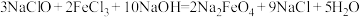 。
。
回答下列问题:
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)用双线桥法标出反应
 的电子转移方向及数目
的电子转移方向及数目
 (填“>”或“<”)。
(填“>”或“<”)。(3)当烧杯中出现
(4)
 的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示
的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示 的理论产率),则制备
的理论产率),则制备 的最适宜的条件范围是
的最适宜的条件范围是
(5)制备
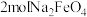 ,至少需要标准状况下的氯气
,至少需要标准状况下的氯气
您最近一年使用:0次
名校
9 . 氯及其化合物在工业生产和人类生活中应用广泛。
(1)实验室利用将氯气通入碱液制备NaClO和 ,装置如图所示:
,装置如图所示:
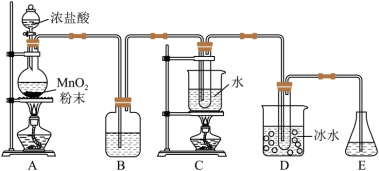
①盛放浓盐酸的仪器名称是______ ,A中发生反应的化学方程式为______ 。
②B的作用是______ 。
③用8.7 g 与足量浓盐酸充分反应,生成
与足量浓盐酸充分反应,生成 的质量为
的质量为______ 。
(2)C中试管内盛放的试剂为______ ,其发生反应反应的离子方程式为:______ 。
(3)实验室可以将氯气通入冷而稀的氢氧化钠溶液获得“84消毒液”,
①制备“84消毒液”的离子方程式______ 。
②空气中喷洒“84消毒液”可以达到对环境消毒的目的,其消毒原理为______ (请结合方程式和文字说明)。
③“84消毒液”与洁厕灵(主要成分为盐酸)混用,会产生黄绿色有毒气体。反应离子方程式为______ 。
④将“84消毒液”与 同时用于织物漂白,效果不佳,原因
同时用于织物漂白,效果不佳,原因______ (用离子方程式表示)。
(4)某同学设计实验探究84消毒液的漂白性。
I.在2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.在2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。
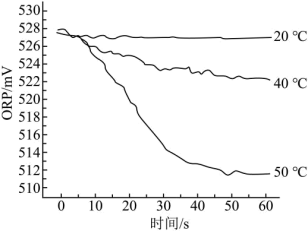
已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验I、II现象不同的原因是为______ 。
②实验III中,随时间的变化ORP值不同的原因可能是______ 。
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。已知某品牌84消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100 g,加水稀释为8%的溶液,则需加水的质量为______ g。
(1)实验室利用将氯气通入碱液制备NaClO和
 ,装置如图所示:
,装置如图所示:
①盛放浓盐酸的仪器名称是
②B的作用是
③用8.7 g
 与足量浓盐酸充分反应,生成
与足量浓盐酸充分反应,生成 的质量为
的质量为(2)C中试管内盛放的试剂为
(3)实验室可以将氯气通入冷而稀的氢氧化钠溶液获得“84消毒液”,
①制备“84消毒液”的离子方程式
②空气中喷洒“84消毒液”可以达到对环境消毒的目的,其消毒原理为
③“84消毒液”与洁厕灵(主要成分为盐酸)混用,会产生黄绿色有毒气体。反应离子方程式为
④将“84消毒液”与
 同时用于织物漂白,效果不佳,原因
同时用于织物漂白,效果不佳,原因(4)某同学设计实验探究84消毒液的漂白性。
I.在2 mL 84消毒液中加入2 mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.在2 mL 84消毒液中加入2 mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验I、II现象不同的原因是为
②实验III中,随时间的变化ORP值不同的原因可能是
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。已知某品牌84消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100 g,加水稀释为8%的溶液,则需加水的质量为
您最近一年使用:0次
10 . 氯及其化合物既是重要化工原料,又是高效、广谱消毒剂。
(1)实验室处理氯气尾气的化学方程式:_______ 。
(2)实验室利用如图装置制备NaClO和NaClO3,已知;6OH-+3Cl2 5Cl-+
5Cl-+ +3H2O
+3H2O
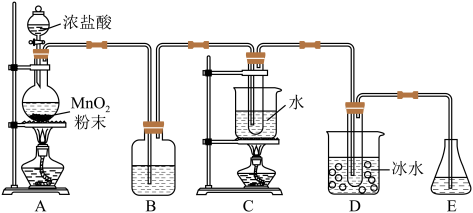
①盛放浓盐酸的仪器名称是_______ ,A中发生反应的离子方程式为_______ 。
②B的作用是_______ ;C中试管内盛放的试剂为_______ 。
③用8.7gMnO2与足量浓盐酸充分反应,生成Cl2的质量为_______ 。
(3)某同学设计实验探究84消毒液的漂白性。
Ⅰ.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。
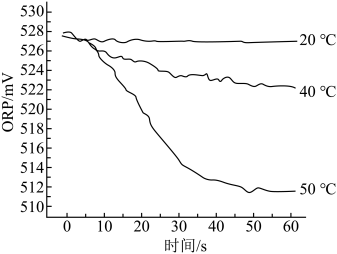
已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是为_______ 。
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是_______ 。
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。已知某品牌84消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100g,加水稀释为8%的溶液,则需加水的质量为_______ g。
(1)实验室处理氯气尾气的化学方程式:
(2)实验室利用如图装置制备NaClO和NaClO3,已知;6OH-+3Cl2
 5Cl-+
5Cl-+ +3H2O
+3H2O
①盛放浓盐酸的仪器名称是
②B的作用是
③用8.7gMnO2与足量浓盐酸充分反应,生成Cl2的质量为
(3)某同学设计实验探究84消毒液的漂白性。
Ⅰ.在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是为
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是
③针对不同物品的消毒,需将84消毒液稀释到不同的浓度。已知某品牌84消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100g,加水稀释为8%的溶液,则需加水的质量为
您最近一年使用:0次



