2022高三·全国·专题练习
1 . Cl2、SO2、NOx都是化工生产中的重要气体,均可用氨水或NaOH溶液处理,防止污染空气。请回答下列问题:
(1)化工厂可用浓氨水来检验Cl2是否泄漏(已知3Cl2+8NH3→6NH4Cl+N2),当有少量Cl2泄漏时,可以观察到的现象是_______ ,若反应中有0.08mol的氨气被氧化,则有_______ mol电子发生转移。
(2)①若用热烧碱溶液吸收Cl2气反应后的混合溶液中,含NaCl、NaClO和NaClO3物质的量比值为n:1:1,则n=_______ 。
②SO2是形成酸雨的主要原因,取某化工区空气样本用蒸馏水处理,检测所得溶液,所含离子及其浓度如下:
根据表中数据计算,检测的溶液pH=_______ 。
(3)NO2是燃油汽车尾气中的主要污染物之一、
①在催化剂和加热条件下,NO2与NH3可反应生成无害物质,请写出反应的化学方程式:_______ 。
②实验室可用烧碱溶液吸收NO2和NO,(已知2NO2+2NaOH→NaNO2+NaNO3+H2O,NO2+NO+2NaOH→2NaNO2+H2O),当消耗100mL0.5mol⋅L-1的烧碱溶液时,共吸收混合气体_______ L(标准状态)。
(1)化工厂可用浓氨水来检验Cl2是否泄漏(已知3Cl2+8NH3→6NH4Cl+N2),当有少量Cl2泄漏时,可以观察到的现象是
(2)①若用热烧碱溶液吸收Cl2气反应后的混合溶液中,含NaCl、NaClO和NaClO3物质的量比值为n:1:1,则n=
②SO2是形成酸雨的主要原因,取某化工区空气样本用蒸馏水处理,检测所得溶液,所含离子及其浓度如下:
| 离子 | Na+ | K+ | NH | H+ | SO | NO | Cl- |
| 浓度/(mol·L-1) | 6×10-6 | 4×10-6 | 2×10-5 | a | 4×10-5 | 2×10-5 | 3×10-5 |
(3)NO2是燃油汽车尾气中的主要污染物之一、
①在催化剂和加热条件下,NO2与NH3可反应生成无害物质,请写出反应的化学方程式:
②实验室可用烧碱溶液吸收NO2和NO,(已知2NO2+2NaOH→NaNO2+NaNO3+H2O,NO2+NO+2NaOH→2NaNO2+H2O),当消耗100mL0.5mol⋅L-1的烧碱溶液时,共吸收混合气体
您最近一年使用:0次
2 . 含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。实验室制取干燥
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。实验室制取干燥 时,净化与收集
时,净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为___________ 。

 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。实验室制取干燥
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。实验室制取干燥 时,净化与收集
时,净化与收集 所需装置的接口连接顺序为
所需装置的接口连接顺序为
您最近一年使用:0次
名校
解题方法
3 . NaCl是一种基础化工原料,通过电解饱和食盐水可以制得NaOH、H2、Cl2。完成下列填空:
(1)写出电解饱和食盐水的化学方程式_______ 。开始时_______ 极(阴、阳)碱性增强。
(2)新冠疫情期间需要大量消毒液,工业上生产消毒液是将氯气与烧碱溶液反应,完成该反应方程式_______ 。
(3)氯气压缩成为液氯属于_______ 变化(选填“物理”“化学”)。常用浓氨水来检查输氯管道是否泄漏,泄漏处会观察到大量的白烟(NH4Cl),其中一步反应是:2NH3+3Cl2→N2+6HCl,该反应也表明氯和氮的非金属性_______ > _______ 。写出产生白烟的化学方程式:_______ 。该白烟的成分溶于水,溶液呈_______ 性。(酸、碱或中性),用离子方程式解释原因_______ 。
(4)pH=2的醋酸和盐酸两溶液中,水的电离_______。
(5)取25 mLpH=2的醋酸溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)_______ c(CH3COO-)。
(1)写出电解饱和食盐水的化学方程式
(2)新冠疫情期间需要大量消毒液,工业上生产消毒液是将氯气与烧碱溶液反应,完成该反应方程式
(3)氯气压缩成为液氯属于
(4)pH=2的醋酸和盐酸两溶液中,水的电离_______。
| A.都被促进 | B.都被抑制 |
| C.甲中被促进,乙中被抑制 | D.甲中被抑制,乙中被促进 |
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
4 . 回答下列问题:
(1)向Na2CO3溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是___ 。
(2)Na2CO3浓溶液中通入氯气时,可产生气体CO2和化合物NaClO3。反应的化学方程式为___ 。
(1)向Na2CO3溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是
(2)Na2CO3浓溶液中通入氯气时,可产生气体CO2和化合物NaClO3。反应的化学方程式为
您最近一年使用:0次
解题方法
5 . 氮、氧、硫、氯是四种重要的非金属元素,研究它们的性质及用途对生产,生活、科研具有重要意义。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,工业上可利用反应NHI3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备。
①一氯胺(NH2Cl)在中性或酸性环境中会发生水解反应,生成一种具有强烈杀菌作用的物质,该物质的电子式为___________ 。
②氨气也是工业上制备硝酸的主要原料,制备硝酸的过程中涉及NO2与水的反应。该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)SO2、NO2两种气体都能对大气造成污染,需要对其进行吸收处理。用氨水吸收SO2能得到含 (NH4)2SO3和NH4HSO3的吸收液,写出生成(NH4)2SO3的离子方程式:___________ 。若向吸收液中通入过量NO2,NH4HSO3能与NO2发生反应生成N2和(NH4)2SO4,写出该反应的离子方程式:___________ 。
(3)Cl2与NaOH溶液反应可制取“84”消毒液。用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3,),此时ClO-的浓度为c0 mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①写出溶液中NaClO分解生成NaClO3的化学方程式:___________ 。
②t时刻溶液中c(Cl-)=___________ mol/L(用含c0、c1的代数式表示)。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,工业上可利用反应NHI3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备。
①一氯胺(NH2Cl)在中性或酸性环境中会发生水解反应,生成一种具有强烈杀菌作用的物质,该物质的电子式为
②氨气也是工业上制备硝酸的主要原料,制备硝酸的过程中涉及NO2与水的反应。该反应中氧化剂与还原剂的物质的量之比为
(2)SO2、NO2两种气体都能对大气造成污染,需要对其进行吸收处理。用氨水吸收SO2能得到含 (NH4)2SO3和NH4HSO3的吸收液,写出生成(NH4)2SO3的离子方程式:
(3)Cl2与NaOH溶液反应可制取“84”消毒液。用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3,),此时ClO-的浓度为c0 mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①写出溶液中NaClO分解生成NaClO3的化学方程式:
②t时刻溶液中c(Cl-)=
您最近一年使用:0次
2021高三·全国·专题练习
6 . 实验室制备氯酸钾、次氯酸钠和氯水的装置如图所示。
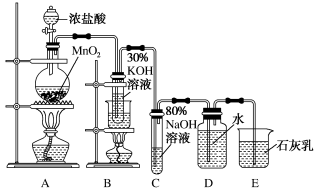
制备KClO3需在70~80℃进行,写出制备KClO3的离子方程式:___ 。

制备KClO3需在70~80℃进行,写出制备KClO3的离子方程式:
您最近一年使用:0次
名校
7 . NaCN超标的电镀废水可用两段氧化法处理:
a.NaCN与NaClO反应,生成NaOCN和NaCl
b.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为___________ (选填“酸性”、“碱性”或“中性”);原因是___________ 。
(2)写出第二次氧化时发生反应的离子方程式。___________
(3)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成___________ 、___________ 和H2O。
a.NaCN与NaClO反应,生成NaOCN和NaCl
b.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为
(2)写出第二次氧化时发生反应的离子方程式。
(3)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成
您最近一年使用:0次
2021-11-09更新
|
49次组卷
|
2卷引用:江苏省徐州市王杰中学2021-2022学年高三10月学情调研化学试题
名校
8 . Ⅰ.写出下列反应的离子方程式。
(1)向含HCl和NH4Al(SO4)2的混合溶液中逐滴加入NaOH溶液,生成沉淀的量与加入NaOH溶液的量关系如图所示,依据反应的“先后顺序”写出下列各段反应的离子方程式:
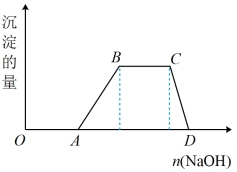
①“OA”段:___________ ;
②“AB”段:___________ ;
③“BC”段:___________ ;
④“CD”段:___________ 。
Ⅱ.“新冠”疫情期间,人们广泛使用“84”消液(有效成分)回答下列问题:
(2)如图是某“84”消毒液的标签, 的物质的量浓度为
的物质的量浓度为___________  (保留1位小数)。使用时通常稀释100倍(体积比),稀释时需要使用的玻璃仪器为胶头滴管、玻璃棒、
(保留1位小数)。使用时通常稀释100倍(体积比),稀释时需要使用的玻璃仪器为胶头滴管、玻璃棒、___________ 。
(3)资料显示“84”消毒液不能与洁厕灵(含 )混合使用,对此某小组开展如图所示的研究。
)混合使用,对此某小组开展如图所示的研究。

①两表面皿之间充满黄绿色气体。则“84”消毒液与洁厕灵反应的化学方程式为___________ ; 的作用是
的作用是___________ 。
②“84”消毒液消毒衣服时要先用温水稀释后再浸泡一段时间,但温度不能高于50℃。则温度不宜过高的原因是___________ 。
(1)向含HCl和NH4Al(SO4)2的混合溶液中逐滴加入NaOH溶液,生成沉淀的量与加入NaOH溶液的量关系如图所示,依据反应的“先后顺序”写出下列各段反应的离子方程式:

①“OA”段:
②“AB”段:
③“BC”段:
④“CD”段:
Ⅱ.“新冠”疫情期间,人们广泛使用“84”消液(有效成分)回答下列问题:
| 84消毒液 (有效成分)  (规格)  (质量分数)25% (密度) 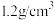 |
 的物质的量浓度为
的物质的量浓度为 (保留1位小数)。使用时通常稀释100倍(体积比),稀释时需要使用的玻璃仪器为胶头滴管、玻璃棒、
(保留1位小数)。使用时通常稀释100倍(体积比),稀释时需要使用的玻璃仪器为胶头滴管、玻璃棒、(3)资料显示“84”消毒液不能与洁厕灵(含
 )混合使用,对此某小组开展如图所示的研究。
)混合使用,对此某小组开展如图所示的研究。
①两表面皿之间充满黄绿色气体。则“84”消毒液与洁厕灵反应的化学方程式为
 的作用是
的作用是②“84”消毒液消毒衣服时要先用温水稀释后再浸泡一段时间,但温度不能高于50℃。则温度不宜过高的原因是
您最近一年使用:0次
解题方法
9 . 将一定量 通入1kg质量分数为
通入1kg质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 、
、 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下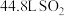 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:
(1)原 溶液中
溶液中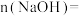
_______  。
。
(2)所通 在标准状况下的体积为
在标准状况下的体积为_______ L。
 通入1kg质量分数为
通入1kg质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 、
、 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下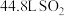 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:(1)原
 溶液中
溶液中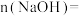
 。
。(2)所通
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
2021高三·全国·专题练习
10 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为_______________________________ 。
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为____________ mol;产生“气泡”的化学方程式为__________________ 。
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是_____________________ (用离子方程式表示)。工业上是将氯气通入30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1 000 kg该溶液需消耗氯气的质量为________ kg(保留整数)。
(1)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次



