名校
1 . 氯是海水中含量最丰富的元素,氯的单质及其化合物在生成、生活领域应用广泛。
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为_____________ (用离子方程式表示)。
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以二硫化亚铁(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素最终氧化成 ,写出制备二氧化氯的离子方程式
,写出制备二氧化氯的离子方程式_______ 。
(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。生产漂白粉反应的化学方程式为_______ 。实际生产中,将石灰乳(含有3%~6%水分的熟石灰)从塔顶喷洒而下,氯气从塔的最底层通入。这样加料的目的是_______ 。
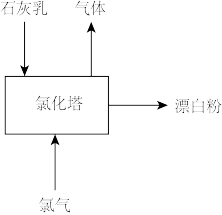
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以二硫化亚铁(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素最终氧化成
 ,写出制备二氧化氯的离子方程式
,写出制备二氧化氯的离子方程式(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。生产漂白粉反应的化学方程式为

您最近一年使用:0次
解题方法
2 . 化学工业为疫情防控提供了强有力的物质支撑。次氯酸钠和二氧化氯(分子式为ClO2,其中Cl元素的化合价为+4价)在水处理等方面有广泛应用,是一种高效安全的灭菌消毒剂。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为_______ ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是_______ 。
(2)ClO2的制备方法,有下列两种:
方法Ⅰ:2NaClO3 + 4HCl =2ClO2↑ + Cl2↑+ 2NaCl + 2H2O
方法Ⅱ:2NaClO3 + H2O2 +H2SO4 = 2ClO2↑ + O2↑+ Na2SO4 +2H2O
方法Ⅰ反应中,氧化产物为_______ (填化学式);方法Ⅱ反应中,产生1mol ClO2气体,电子转移_______ mol。
(3)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1 取待测ClO2溶液20.00mL于锥形瓶中;
步骤2 用稀硫酸调节溶液至酸性,加入足量的KI晶体充分反应,使ClO2转化为Cl-;发生的反应为:4ClO2 + 20 KI +8H2SO4=4KCl +10I2 + 8 X + 8H2O
步骤3 逐滴加入0.1500mol·L-1的Na2S2O3溶液,发生的反应为:I2 + 2Na2S2O3= Na2S4O6 +2NaI,当将步骤2中反应生成的I2恰好完全反应时,消耗Na2S2O3溶液的体积为24.00mL。
①写出步骤2反应方程式中的X的化学式为_______ ;
②计算:ClO2溶液的物质的量浓度为_______ mol·L-1(写出计算过程)。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为
(2)ClO2的制备方法,有下列两种:
方法Ⅰ:2NaClO3 + 4HCl =2ClO2↑ + Cl2↑+ 2NaCl + 2H2O
方法Ⅱ:2NaClO3 + H2O2 +H2SO4 = 2ClO2↑ + O2↑+ Na2SO4 +2H2O
方法Ⅰ反应中,氧化产物为
(3)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1 取待测ClO2溶液20.00mL于锥形瓶中;
步骤2 用稀硫酸调节溶液至酸性,加入足量的KI晶体充分反应,使ClO2转化为Cl-;发生的反应为:4ClO2 + 20 KI +8H2SO4=4KCl +10I2 + 8 X + 8H2O
步骤3 逐滴加入0.1500mol·L-1的Na2S2O3溶液,发生的反应为:I2 + 2Na2S2O3= Na2S4O6 +2NaI,当将步骤2中反应生成的I2恰好完全反应时,消耗Na2S2O3溶液的体积为24.00mL。
①写出步骤2反应方程式中的X的化学式为
②计算:ClO2溶液的物质的量浓度为
您最近一年使用:0次
解题方法
3 . 生产、生活中处处有化学,利用所学化学知识回答下列问题。
(1)在潜水艇和消防员的呼吸面具中, 与二氧化碳反应的化学方程式为
与二氧化碳反应的化学方程式为_______ ;从氧化剂和还原剂的角度分析,在这个反应中 的作用是
的作用是_______
(2)铝盐,铁盐可以作净水剂,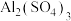 的电离方程式是
的电离方程式是_______ ;将饱和 溶液滴入沸水制得的
溶液滴入沸水制得的 胶体中,分散剂是
胶体中,分散剂是_______ 。该分散系区别于其他分散系的本质特征是_______ 。
(3)金属钠着火时不能用水灭火,原因是_______ 。
(4)阅读下列科普短文并填空。
84消毒液①和医用酒精②是人们生活中常用的消毒剂,84消毒液的名称源于北京某医院在1984年研制成功的一种高效含氯消毒液。它可用 ③与
③与 溶液④反应制得,其主要成分为
溶液④反应制得,其主要成分为 ⑤、
⑤、 ⑥,是无色或淡黄色液体,人们主要利用84消毒液中
⑥,是无色或淡黄色液体,人们主要利用84消毒液中 的氧化性进行消毒。医用酒精中,乙醇的体积分数通常为75%。过高浓度的乙醇⑦溶液会使病毒表面的蛋白质⑧迅速凝结,形成一层保护膜,减弱消毒效果。过低浓度的乙醇溶液不能使蛋白质变性,同样不能获得很好的消毒效果。
的氧化性进行消毒。医用酒精中,乙醇的体积分数通常为75%。过高浓度的乙醇⑦溶液会使病毒表面的蛋白质⑧迅速凝结,形成一层保护膜,减弱消毒效果。过低浓度的乙醇溶液不能使蛋白质变性,同样不能获得很好的消毒效果。
在上述短文标有序号的物质中,属于混合物的是_______ (填序号,下同);属于电解质的是_______ 。用上述方法制备84消毒液时,发生反应的离子方程式为_______
(1)在潜水艇和消防员的呼吸面具中,
 与二氧化碳反应的化学方程式为
与二氧化碳反应的化学方程式为 的作用是
的作用是(2)铝盐,铁盐可以作净水剂,
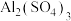 的电离方程式是
的电离方程式是 溶液滴入沸水制得的
溶液滴入沸水制得的 胶体中,分散剂是
胶体中,分散剂是(3)金属钠着火时不能用水灭火,原因是
(4)阅读下列科普短文并填空。
84消毒液①和医用酒精②是人们生活中常用的消毒剂,84消毒液的名称源于北京某医院在1984年研制成功的一种高效含氯消毒液。它可用
 ③与
③与 溶液④反应制得,其主要成分为
溶液④反应制得,其主要成分为 ⑤、
⑤、 ⑥,是无色或淡黄色液体,人们主要利用84消毒液中
⑥,是无色或淡黄色液体,人们主要利用84消毒液中 的氧化性进行消毒。医用酒精中,乙醇的体积分数通常为75%。过高浓度的乙醇⑦溶液会使病毒表面的蛋白质⑧迅速凝结,形成一层保护膜,减弱消毒效果。过低浓度的乙醇溶液不能使蛋白质变性,同样不能获得很好的消毒效果。
的氧化性进行消毒。医用酒精中,乙醇的体积分数通常为75%。过高浓度的乙醇⑦溶液会使病毒表面的蛋白质⑧迅速凝结,形成一层保护膜,减弱消毒效果。过低浓度的乙醇溶液不能使蛋白质变性,同样不能获得很好的消毒效果。在上述短文标有序号的物质中,属于混合物的是
您最近一年使用:0次
解题方法
4 . 化学与人类生活密切相关。请按要求,回答下列问题:
(1)氯气是重要的化工原科,实验室常用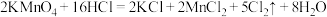 反应制备氯气,该反应的氧化剂是
反应制备氯气,该反应的氧化剂是_______ ;当生成的气体在标准状况下的体积为5.6L时转移的电子数为_______ 个,此时被氧化的物质的物质的量为_______ mol。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为_______ 。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为_______ 。
(1)氯气是重要的化工原科,实验室常用
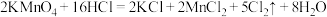 反应制备氯气,该反应的氧化剂是
反应制备氯气,该反应的氧化剂是(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为
您最近一年使用:0次
5 . 一种生产高铁酸钾的流程如图所示,写出下列反应的离子方程式
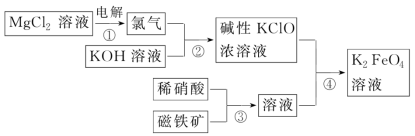
(1)反应①:_______
(2)反应②:_______
(3)反应③:_______
(4)反应④:_______

(1)反应①:
(2)反应②:
(3)反应③:
(4)反应④:
您最近一年使用:0次
名校
6 . 根据题目信息,完成有关方程式的书写。
(1)制备氢氧化铁胶体的离子方程式为_______ 。
(2) 与石灰乳反应的化学方程式:
与石灰乳反应的化学方程式:_______ 。
(3)用单线桥分析 与水反应中电子转移的方向和数目:
与水反应中电子转移的方向和数目:_______ 。
(4)将 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。写出该反应的离子方程式:
无色)。写出该反应的离子方程式:_______ 。
(1)制备氢氧化铁胶体的离子方程式为
(2)
 与石灰乳反应的化学方程式:
与石灰乳反应的化学方程式:(3)用单线桥分析
 与水反应中电子转移的方向和数目:
与水反应中电子转移的方向和数目:(4)将
 固体(黄色,微溶)加入
固体(黄色,微溶)加入 和
和 的混合溶液里,加热,溶液显紫色(
的混合溶液里,加热,溶液显紫色( 无色)。写出该反应的离子方程式:
无色)。写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
7 . 2004年4月15日,重庆某化工厂氯气泄露并发生爆炸,爆炸现场弥漫着黄色烟雾,这起事故共造成7人丧生,并致使近15万群众紧急疏散。问题:
(1)爆炸现场弥漫的黄色烟雾,除氯气外,形成雾的主要原因是Cl2与水反应,反应的化学方程式为____ ;形成烟的成分包含Cl2与Fe反应的产物____ ,Cl2是一种有毒气体,为消除毒气,消防部门用消防用水与碱液在外围50米处形成两道水幕进行稀释,写出Cl2与强碱溶液反应的离子方程式____ 。
(2)Cl2及其无机产品常用做消毒剂,如“84消毒液”(NaClO)、“漂白粉”等,它们的消毒原理都是在潮湿的空气中与CO2和水蒸气反应生成了次氯酸,请写出“84消毒液”(NaClO)在空气中发生作用的化学方程式:____ 。
(3)用氯气对饮用水消毒已经有百年的历史,这种消毒的方法中氯气会与水中的有机物发生氯代生成对人体有害的的氯代物,于是世界环保联盟建议推广广谱高效消毒剂二氧化氯(ClO2),制取二氧化氯的其中一种方法是:Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O,若生成1 mol ClO2则转移电子数为____ (NA表示阿伏加德罗常数)。
(1)爆炸现场弥漫的黄色烟雾,除氯气外,形成雾的主要原因是Cl2与水反应,反应的化学方程式为
(2)Cl2及其无机产品常用做消毒剂,如“84消毒液”(NaClO)、“漂白粉”等,它们的消毒原理都是在潮湿的空气中与CO2和水蒸气反应生成了次氯酸,请写出“84消毒液”(NaClO)在空气中发生作用的化学方程式:
(3)用氯气对饮用水消毒已经有百年的历史,这种消毒的方法中氯气会与水中的有机物发生氯代生成对人体有害的的氯代物,于是世界环保联盟建议推广广谱高效消毒剂二氧化氯(ClO2),制取二氧化氯的其中一种方法是:Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O,若生成1 mol ClO2则转移电子数为
您最近一年使用:0次
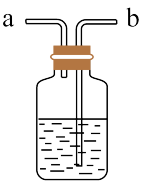
8 . 氯是一种生产生活中常见的元素,下图是几种含氯产品。

(1) 是有毒气体,为了防止多余
是有毒气体,为了防止多余 污染空气、需要如图装置进行尾气处理,用离子方程式表示该原理
污染空气、需要如图装置进行尾气处理,用离子方程式表示该原理_______ 气体应该由_______ (填a或b)管通入。若要吸收标准状况下 ,至少需要
,至少需要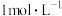 上述溶液
上述溶液_______ mL。
(2)工业上制取漂白粉的化学方程式是_______ 。
(3)同学们探究“84”消毒液在不同pH不使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用 溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
已知溶液中 、
、 和
和 的物质的量分数(a)随溶液pH变化的关系如图所示:
的物质的量分数(a)随溶液pH变化的关系如图所示:
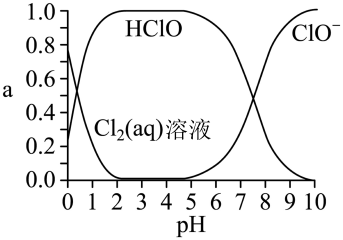
①由实验现象可获得结论:溶液的pH在4~10范围内,pH越大,红纸褪色_______ (填“越快”或“越慢”)。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是_______ 。
③预测pH=1、10min后,红纸的颜色(与a、b、c颜色相比)_______ 。

(1)
 是有毒气体,为了防止多余
是有毒气体,为了防止多余 污染空气、需要如图装置进行尾气处理,用离子方程式表示该原理
污染空气、需要如图装置进行尾气处理,用离子方程式表示该原理 ,至少需要
,至少需要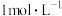 上述溶液
上述溶液
(2)工业上制取漂白粉的化学方程式是
(3)同学们探究“84”消毒液在不同pH不使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用
 溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
| 烧杯 | 溶液的pH | 现象 |
| a | 10 | 10min后,红纸基本不褪色;4h后红纸褪色 |
| b | 7 | 10min后,红纸颜色变浅;4h后红纸褪色 |
| c | 4 | 10min后,红纸颜色变得更浅;4h后红纸褪色 |
 、
、 和
和 的物质的量分数(a)随溶液pH变化的关系如图所示:
的物质的量分数(a)随溶液pH变化的关系如图所示:
①由实验现象可获得结论:溶液的pH在4~10范围内,pH越大,红纸褪色
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是
③预测pH=1、10min后,红纸的颜色(与a、b、c颜色相比)
您最近一年使用:0次
2022-11-05更新
|
188次组卷
|
2卷引用:福建省厦门双十中学2022-2023学年高一上学期期中考试化学试题
9 . 按要求完成下列化学用语
(1)碳酸氢钠的电离方程式_______ 。
(2)氢氧化铜的电离方程式_______ 。
(3)Na与水反应离子方程式_______ 。
(4)Na2O2与二氧化碳反应的化学方程式_______ 。
(5)工业制备漂白粉的化学方程式_______ 。
(6)过量碳酸氢钠溶液与澄清石灰水反应的离子方程式_______ 。
(7)Na2CO3溶液与少量盐酸反应离子方程式_______ 。
(1)碳酸氢钠的电离方程式
(2)氢氧化铜的电离方程式
(3)Na与水反应离子方程式
(4)Na2O2与二氧化碳反应的化学方程式
(5)工业制备漂白粉的化学方程式
(6)过量碳酸氢钠溶液与澄清石灰水反应的离子方程式
(7)Na2CO3溶液与少量盐酸反应离子方程式
您最近一年使用:0次
解题方法
10 . 回答下列问题
(1)H2在单质B中燃烧产生苍白色的火焰,产物溶于水得到常见的强酸,其反应的化学方程式为_______ 。
(2)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶甲和盛有潮湿有色布条的广口瓶乙,可观察到的现象是_______ ,这是因为氯气通入水中发生化学反应,生成了具有漂白性的物质:_______ (填化学式),化学方程式为_______ 。
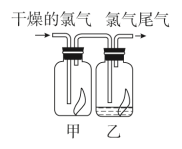
(3)实验室制备氯气时要在通风橱内完成,并且为了防止氯气污染空气,要有尾气处理装置,一般用_______ 溶液吸收多余的氯气,原理是_______ (用化学方程式表示)。
(4)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_______ (填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体主要是_______ (用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(1)H2在单质B中燃烧产生苍白色的火焰,产物溶于水得到常见的强酸,其反应的化学方程式为
(2)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶甲和盛有潮湿有色布条的广口瓶乙,可观察到的现象是

(3)实验室制备氯气时要在通风橱内完成,并且为了防止氯气污染空气,要有尾气处理装置,一般用
(4)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是
A.O2 B.Cl2 C.CO2 D.HClO
您最近一年使用:0次



