1 . 回答下列问题
(1)化学与生产生活联系密切,请书写对应的化学方程式:
①漂白粉中的 能与空气中的
能与空气中的 和水蒸气发生反应:
和水蒸气发生反应:_________________________ 。
②固体管道疏通剂(主要成分有氢氧化钠和铝粉)的疏通原理:__________________________ 。
③常温下,将氯气通入氢氧化钠溶液中,可以得到一种漂白液:__________________________ 。
(2)海水开发利用的部分过程如图所示:
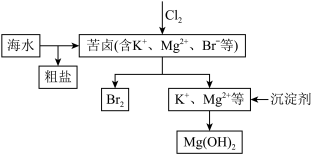
④向苦卤中通入氯气,发生反应的离子方程式是_____________________________________
⑤工业生产中常选用石灰乳作为沉淀剂,相关反应的离子方程式是______________________
⑥富集溴一般先用空气和水蒸气吹出单质溴,再用 将其还原吸收,相关反应的化学方程式是
将其还原吸收,相关反应的化学方程式是_______ 。
(1)化学与生产生活联系密切,请书写对应的化学方程式:
①漂白粉中的
 能与空气中的
能与空气中的 和水蒸气发生反应:
和水蒸气发生反应:②固体管道疏通剂(主要成分有氢氧化钠和铝粉)的疏通原理:
③常温下,将氯气通入氢氧化钠溶液中,可以得到一种漂白液:
(2)海水开发利用的部分过程如图所示:

④向苦卤中通入氯气,发生反应的离子方程式是
⑤工业生产中常选用石灰乳作为沉淀剂,相关反应的离子方程式是
⑥富集溴一般先用空气和水蒸气吹出单质溴,再用
 将其还原吸收,相关反应的化学方程式是
将其还原吸收,相关反应的化学方程式是
您最近一年使用:0次
2 . 利用分类法可以更系统、全面的认识物质的性质以及化学反应。
Ⅰ、有下列物质:①盐酸② ③
③ ④KOH溶液⑤
④KOH溶液⑤
(1)属于碱性氧化物的是___________ (填序号)。
(2)③属于___________ (填“共价”或“离子”)化合物。
(3)属于电解质的是___________ (填序号)。
(4)①和④反应的离子方程式是___________ 。
Ⅱ、有以下四个反应:①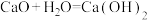 ②
②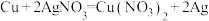
③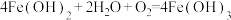 ④
④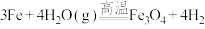
(5)不属于氧化还原反应的是___________ (填序号)。
(6)既是化合反应又是氧化还原反应的是___________ (填序号)。
Ⅲ、单质到盐的转化关系可表示为:A(单质)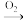 B(氧化物)
B(氧化物)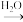 C
C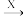 D(盐)。
D(盐)。
(7)若A是碳单质,则C的水溶液呈___________ (填“酸”、“碱”或“中”)性。
(8)若C→D的转化可用于工业制漂白粉,则物质X是___________ 。
(9)若B是一种淡黄色固体,X是 ,则B的用途是
,则B的用途是___________ (举一例),D的化学式可能是___________ 。
Ⅰ、有下列物质:①盐酸②
 ③
③ ④KOH溶液⑤
④KOH溶液⑤
(1)属于碱性氧化物的是
(2)③属于
(3)属于电解质的是
(4)①和④反应的离子方程式是
Ⅱ、有以下四个反应:①
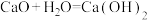 ②
②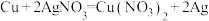
③
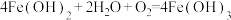 ④
④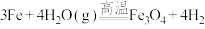
(5)不属于氧化还原反应的是
(6)既是化合反应又是氧化还原反应的是
Ⅲ、单质到盐的转化关系可表示为:A(单质)
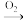 B(氧化物)
B(氧化物)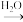 C
C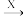 D(盐)。
D(盐)。(7)若A是碳单质,则C的水溶液呈
(8)若C→D的转化可用于工业制漂白粉,则物质X是
(9)若B是一种淡黄色固体,X是
 ,则B的用途是
,则B的用途是
您最近一年使用:0次
解题方法
3 . 某化学兴趣小组进行了如下实验。请回答:
(1)用一氧化碳还原氧化铁,反应的化学方程式为_______ 。反应完毕后,他们将得到的铁屑装入下图所示装置进行实验,A中的玻璃丝可以阻止固体离开A管,B中碱石灰的作用是_______ 。一段时间后,他们将A中的固体溶于水,并向所得溶液中滴入几滴KSCN溶液。
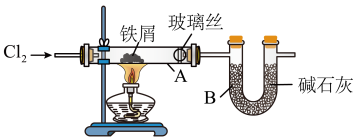
①若观察到溶液出现红色,证明溶液中含有_______ (填离子符号)。
②若未观察到溶液出现红色,可能的原因是_______ 。
(2)用足量的稀盐酸溶解一定量的Fe2O3,得到棕黄色溶液。甲同学向溶液中加入铜粉欲获得铁,他_______ (填“能”或“不能”)成功,原因是_______
(3)已知铝粉与氧化铁能发生反应2Al+Fe2O3 2Fe+Al2O3小组成员将反应的产物用足量的NaOH溶液浸泡,除去其中的Al2O3,分离得到Fe,反应的化学方程式为
2Fe+Al2O3小组成员将反应的产物用足量的NaOH溶液浸泡,除去其中的Al2O3,分离得到Fe,反应的化学方程式为_______ 。某同学认为用足量稀盐酸浸泡也能达到相同的结果,他的观点_______ (填“正确”或“不正确”)。
(1)用一氧化碳还原氧化铁,反应的化学方程式为

①若观察到溶液出现红色,证明溶液中含有
②若未观察到溶液出现红色,可能的原因是
(2)用足量的稀盐酸溶解一定量的Fe2O3,得到棕黄色溶液。甲同学向溶液中加入铜粉欲获得铁,他
(3)已知铝粉与氧化铁能发生反应2Al+Fe2O3
 2Fe+Al2O3小组成员将反应的产物用足量的NaOH溶液浸泡,除去其中的Al2O3,分离得到Fe,反应的化学方程式为
2Fe+Al2O3小组成员将反应的产物用足量的NaOH溶液浸泡,除去其中的Al2O3,分离得到Fe,反应的化学方程式为
您最近一年使用:0次
4 . 资料:“84”消毒液中含氯微粒主要有ClO-、Cl-、HClO,相同浓度时,HClO的氧化性强于ClO-。通常情况下,应将“84”消毒液原液稀释后使用,一般不用于衣服等纺织品的洗涤消毒。
(1)常温,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为_______ 。
(2)已知某“84”消毒液瓶体部分标签如图所示,请回答下列问题。
①该“84”消毒液的物质的量浓度为_______ mol/L。
②“84”消毒液使用时需要稀释,某小组用上述“84”消毒液配制500 mL 0.2mol/L的稀溶液,需要用量筒量取该“84”消毒液体积为_______ mL。
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是_______ 。
A.容量瓶使用时未干燥 B.没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线 D.定容后液面低于刻度线,再加蒸馏水至刻度线
(3)为研究“84”消毒液的性质与使用条件,进行下列实验:
向三支试管中分别加入2 mL“84”消毒液和5滴紫色石蕊。继续进行如下实验:
①实验1中NaClO溶液与空气中二氧化碳反应的离子方程式为_______ 。(已知酸性: )
)
②实验3中生成气体的离子方程式为_______ 。
③综合以上实验为提高单位时间内“84”消毒液的漂白效果,你的建议是_______ 。
(1)常温,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为
(2)已知某“84”消毒液瓶体部分标签如图所示,请回答下列问题。
| “84”消毒液 有效成分:NaClO 规格:1000 mL 质量分数:25% 密度:1.192g/cm3 |
②“84”消毒液使用时需要稀释,某小组用上述“84”消毒液配制500 mL 0.2mol/L的稀溶液,需要用量筒量取该“84”消毒液体积为
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是
A.容量瓶使用时未干燥 B.没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线 D.定容后液面低于刻度线,再加蒸馏水至刻度线
(3)为研究“84”消毒液的性质与使用条件,进行下列实验:
向三支试管中分别加入2 mL“84”消毒液和5滴紫色石蕊。继续进行如下实验:
| 实验 | 操作 | 现象 |
| 实验1 | 加入2 mL蒸馏水 | 短时间内未褪色,一段时间后蓝色褪去 |
| 实验2 | 加入2 mL 0.0002 mol/L的H2SO4溶液 | 蓝色迅速褪去,无气体产生 |
| 实验3 | 加入2 mL 2 mol/L的H2SO4溶液 | 蓝色迅速褪去,并产生大量刺激性的气体 |
 )
)②实验3中生成气体的离子方程式为
③综合以上实验为提高单位时间内“84”消毒液的漂白效果,你的建议是
您最近一年使用:0次
解题方法
5 . 写出下列反应的化学方程式,是离子反应的写离子方程式。
(1) 和
和 溶液的反应
溶液的反应_______ ;
(2) 和石灰乳的反应
和石灰乳的反应_______ ;
(3)把 通
通 溶液中
溶液中_______ ;
(4)将 和
和 混合通入
混合通入 中
中_______ ;
(5)将 通入氢硫酸溶液中
通入氢硫酸溶液中_______ ;
(6)将浓盐酸和 混合加热
混合加热_______ ;
(7)电解饱和食盐水_______ ;
(8)将浓盐酸与漂白液混合_______ ;
(9)向 固体滴加浓盐酸
固体滴加浓盐酸_______ ;
(10)向漂白粉溶液中通入少量 气体
气体_______ 。
(1)
 和
和 溶液的反应
溶液的反应(2)
 和石灰乳的反应
和石灰乳的反应(3)把
 通
通 溶液中
溶液中(4)将
 和
和 混合通入
混合通入 中
中(5)将
 通入氢硫酸溶液中
通入氢硫酸溶液中(6)将浓盐酸和
 混合加热
混合加热(7)电解饱和食盐水
(8)将浓盐酸与漂白液混合
(9)向
 固体滴加浓盐酸
固体滴加浓盐酸(10)向漂白粉溶液中通入少量
 气体
气体
您最近一年使用:0次
6 . 1984年我国研制出有效杀灭肝炎病毒的消毒液,命名为“84消毒液”。完成下列问题。
(1)实验室“84 消毒液”可通过将氯气通入冷而稀的氢氧化钠溶液获得,写出该反应的离子方程式_______ 。

(2)“84消毒液”与洁厕灵(主要成分为盐酸)混用,会产生黄绿色有毒气体。反应离子方程式为_______ ,氧化产物与还原产物的物质的量之比为_______ 。
(3)将“84 消毒液”与 同时用于织物漂白,效果不佳,原因
同时用于织物漂白,效果不佳,原因 _______ (用离子方程式表示)。
(4)高铁酸钠 是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。
是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。
①某兴趣小组欲用 固体配制
固体配制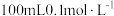 的高铁酸钠溶液,需要高铁酸钠固体的质量为
的高铁酸钠溶液,需要高铁酸钠固体的质量为_______ g 。配制所用的容量瓶上标有
。配制所用的容量瓶上标有_______ 、_______ 、刻度线。
②下列操作导致浓度偏低的是_______ 。
A.容量瓶用蒸馏水洗净之后,直接用于溶液的配制
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
D.定容时,俯视刻度线
(1)实验室“84 消毒液”可通过将氯气通入冷而稀的氢氧化钠溶液获得,写出该反应的离子方程式

(2)“84消毒液”与洁厕灵(主要成分为盐酸)混用,会产生黄绿色有毒气体。反应离子方程式为
(3)将“84 消毒液”与
 同时用于织物漂白,效果不佳,原因
同时用于织物漂白,效果不佳,原因 (4)高铁酸钠
 是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。
是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。①某兴趣小组欲用
 固体配制
固体配制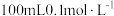 的高铁酸钠溶液,需要高铁酸钠固体的质量为
的高铁酸钠溶液,需要高铁酸钠固体的质量为 。配制所用的容量瓶上标有
。配制所用的容量瓶上标有②下列操作导致浓度偏低的是
A.容量瓶用蒸馏水洗净之后,直接用于溶液的配制
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切
D.定容时,俯视刻度线
您最近一年使用:0次
7 . 工业上,我们用电解饱和食盐水制取氯气,请写出其中的化学方程式:_______ ,阳极产物是_______ 。实验室制备氯气时,为防止氯气污染空气,通常将氯气通入氢氧化钠溶液中,写出化学方程式:_______ ;对应的离子方程式_______ 。
您最近一年使用:0次
解题方法
8 . 新冠疫情的发生,消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,而氯气是制取消毒液的重要原料之一。
请回答下列问题:
(1)请写出舍勒发现氯气的化学反应方程式___________________________________ ,若收集到标准状况下3.36LCl2,则被氧化的HCl的物质的量为_____________ mol。
(2)84消毒液(主要成分是NaClO)是常用的消毒剂,工业上将氯气通入烧碱溶液中制取84消毒液,写出此反应的离子方程式_______________________________________ ,若要制取1.5L 2 mol/L的84消毒液,则需要标准状况下___________ L 氯气。
(3)新冠疫情下,人们对杀菌消毒特别重视,曾有报道某居民将84消毒液与洁厕灵(主要成分是浓盐酸)混合使用而中毒,请解释原因__________________________________ (用化学方程式表示), 该反应中氧化剂是______________ 。
请回答下列问题:
(1)请写出舍勒发现氯气的化学反应方程式
(2)84消毒液(主要成分是NaClO)是常用的消毒剂,工业上将氯气通入烧碱溶液中制取84消毒液,写出此反应的离子方程式
(3)新冠疫情下,人们对杀菌消毒特别重视,曾有报道某居民将84消毒液与洁厕灵(主要成分是浓盐酸)混合使用而中毒,请解释原因
您最近一年使用:0次
名校
解题方法
9 . 某学习小组的同学用MnO2和浓盐酸反应来制备纯净的氯气并验证其有无漂白性,设计装置如图:

(1)A装置中反应的化学方程式:____________________________ ;D装置中现象:___________________ ;该套装置存在的缺陷:_________________________________ 。
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是_______________________ (用离子方程式表示)。
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了_______________ 。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为__________________ 。
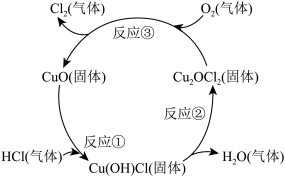
(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是___________ ,CuO的作用是_____________ ,写出总反应的化学方程式,并用单线桥法标出该反应的电子转移情况______________________________ 。

(1)A装置中反应的化学方程式:
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是

您最近一年使用:0次
2022-12-14更新
|
396次组卷
|
3卷引用:上海市松江二中2021-2022学年高一上学期期末考试化学试题
名校
10 . “7•20”特大洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效措施之一。“84”消毒液、漂白粉和ClO2等都是有效的消杀试剂。
(1)用化学方程式表示氯气与烧碱溶液制备“84”消毒液的原理____ ,标况下56L氯气完全被吸收,需要____ L1mol/L的NaOH溶液。
(2)使用漂白粉漂白,只需取适量漂白粉溶于水即可,漂白原理用化学方程式表示为_____ 。
(3)漂白粉的保存要注意密封,为了判断一份儿久置的漂白粉是①没有失效②部分失效③完全失效。某化学兴趣小组设计实验进行验证。
已知:Ca(ClO)2溶液呈碱性;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;Ca(ClO)2+2HCl(稀)=CaCl2+2HClO
a.甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。由此,判断结论为①,你是否同意他的结论____ (填“同意”或“不同意”),若不同意,你认为的结论是____ (若同意,此空不用填)
A.② B.③ C.①或② D.①②③均有可能
b.乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊;他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。据此你得出的结论是_____ (从①②③中选填)。
(4)目前普遍使用ClO2代替Cl2及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。其摩尔质量为_____ 。ClO2还可以将剧毒的NaCN转化为无毒物质除去,产物是氯化钠和两种常见气体。试写出该反应的化学方程式_____ 。
(1)用化学方程式表示氯气与烧碱溶液制备“84”消毒液的原理
(2)使用漂白粉漂白,只需取适量漂白粉溶于水即可,漂白原理用化学方程式表示为
(3)漂白粉的保存要注意密封,为了判断一份儿久置的漂白粉是①没有失效②部分失效③完全失效。某化学兴趣小组设计实验进行验证。
已知:Ca(ClO)2溶液呈碱性;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;Ca(ClO)2+2HCl(稀)=CaCl2+2HClO
a.甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。由此,判断结论为①,你是否同意他的结论
A.② B.③ C.①或② D.①②③均有可能
b.乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊;他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。据此你得出的结论是
(4)目前普遍使用ClO2代替Cl2及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。其摩尔质量为
您最近一年使用:0次



