1 . 完成下列填空:
(1)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。工业上常用Cl2处理含Fe2+的FeCl3溶液,请写出该反应的离子方程式:_______ 。
(2)2020年突如其来的“新冠肺炎”使人们认识到含氯消毒剂的重要性。
①“84”消毒液(有效成分为次氯酸钠)在此次抗疫中发挥了重要作用,其工业制备的化学方程式_______ 。
②已知KMnO4与浓盐酸反应也可以用来制取氯气:2KMnO4+16HCl=2KCl+ 2MnCl2+ 5Cl2↑+ 8H2O。氧化剂是_______ (填化学式);若有15.8g KMnO4参与反应,反应中转移的电子为_______ mol。请用单线桥法表示电子转移的方向和数目:_______ 。
(3)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。
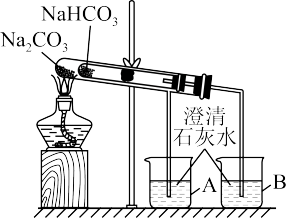
①整个实验过程中,能观察到烧杯B中的现象是_______ 。
②该实验可证明NaHCO3的热稳定性_______ (填“强于”“弱于”或“等于”)Na2CO3;_______ (填“能”或“不能”)将NaHCO3、Na2CO3的位置互换。
(1)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。工业上常用Cl2处理含Fe2+的FeCl3溶液,请写出该反应的离子方程式:
(2)2020年突如其来的“新冠肺炎”使人们认识到含氯消毒剂的重要性。
①“84”消毒液(有效成分为次氯酸钠)在此次抗疫中发挥了重要作用,其工业制备的化学方程式
②已知KMnO4与浓盐酸反应也可以用来制取氯气:2KMnO4+16HCl=2KCl+ 2MnCl2+ 5Cl2↑+ 8H2O。氧化剂是
(3)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。

①整个实验过程中,能观察到烧杯B中的现象是
②该实验可证明NaHCO3的热稳定性
您最近一年使用:0次
2 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,下图为氯元素的“价类二维图”的部分信息。请回答下列问题:
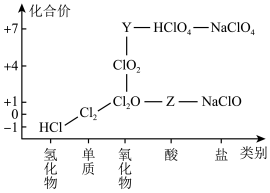
(1)根据图中信息写出Y、Z的化学式_______ 、_______ 。
(2)84消毒液能有效杀灭新冠病毒。某品牌84消毒液瓶体的部分标签如图所示。
回答下列问题:
①某使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生 ,请用离子方程式表示其原因
,请用离子方程式表示其原因_______ 。
②如图所示,该品牌84消毒液的物质的量浓度为_______ ,84消毒液使用时需要稀释,某化学实验小组用上述84消毒液配制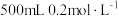 的稀溶液,需要用量筒量取该84消毒液
的稀溶液,需要用量筒量取该84消毒液_______  。
。
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是_______ 。
A.量取浓84消毒液的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
B.容量瓶使用时未干燥
C.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
D.定容时俯视刻度线
(3)①二氧化氯是一种高效消毒剂。实验室可用亚氯酸钠( )溶液与氯气反应制
)溶液与氯气反应制 ,同时生成氯化钠,此反应的化学方程式为
,同时生成氯化钠,此反应的化学方程式为_______ 。
② 可将废水中的
可将废水中的 转化为
转化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为_______ 。

(1)根据图中信息写出Y、Z的化学式
(2)84消毒液能有效杀灭新冠病毒。某品牌84消毒液瓶体的部分标签如图所示。
| 84消毒液 有效成分  规格 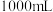 质量分数 25% 密度 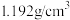 |
①某使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生
 ,请用离子方程式表示其原因
,请用离子方程式表示其原因②如图所示,该品牌84消毒液的物质的量浓度为
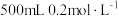 的稀溶液,需要用量筒量取该84消毒液
的稀溶液,需要用量筒量取该84消毒液 。
。③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是
A.量取浓84消毒液的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
B.容量瓶使用时未干燥
C.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
D.定容时俯视刻度线
(3)①二氧化氯是一种高效消毒剂。实验室可用亚氯酸钠(
 )溶液与氯气反应制
)溶液与氯气反应制 ,同时生成氯化钠,此反应的化学方程式为
,同时生成氯化钠,此反应的化学方程式为②
 可将废水中的
可将废水中的 转化为
转化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
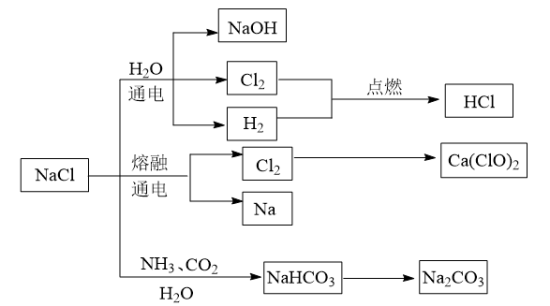
3 . NaCl是一种化工原料,可以制备多种物质,如图所示:
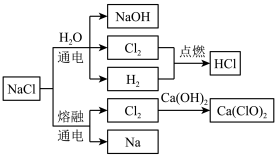
请根据以上转化关系填写下列空白。
(1)实验室用浓盐酸和MnO2制取氯气,其反应的化学方程式为___________ 。该反应中盐酸表现的性质有___________ 。
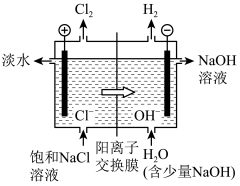
(2)饱NaCl溶液通电后发生反应的离子方程式为___________ 。电解饱和NaCl溶液的装置如图所示,在装置中间添加阳离子交换膜(只允许阳离子通过,不允许气体和阴离子通过),其作用是___________ 。
(3)将氯气溶于水配成饱和溶液,用胶头滴管将饱和氯水慢慢滴入含有酚酞的氢氧化钠稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种:①氢氧化钠完全反应,反应后溶液碱性减弱,酚酞变无色;②过量饱和氯水中的次氯酸利用漂白性使溶液红色褪去。设计实验证明红色褪去的原因是①或②,简述实验方案和结论:___________ 。

请根据以上转化关系填写下列空白。
(1)实验室用浓盐酸和MnO2制取氯气,其反应的化学方程式为
(2)饱NaCl溶液通电后发生反应的离子方程式为

(3)将氯气溶于水配成饱和溶液,用胶头滴管将饱和氯水慢慢滴入含有酚酞的氢氧化钠稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种:①氢氧化钠完全反应,反应后溶液碱性减弱,酚酞变无色;②过量饱和氯水中的次氯酸利用漂白性使溶液红色褪去。设计实验证明红色褪去的原因是①或②,简述实验方案和结论:
您最近一年使用:0次
名校
4 . 离子反应是中学化学中重要的反应类型。回答下列问题:
(1)离子方程式是重要的化学用语。下列是有关离子方程式的一个错误观点:酸碱中和反应均可表示为 ,请用一个相应的“离子方程式”否定这个观点。
,请用一个相应的“离子方程式”否定这个观点。___________
(2)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“ ”来表示,请写出2个有关反应的化学方程式:
”来表示,请写出2个有关反应的化学方程式:
①___________ ;
②___________ 。
(3)实验室用铁、氧化铜、稀硫酸为原料制取铜,某同学设计了两个实验方案:
方案一: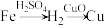
方案二:
写出上述两个方案每步转化的有关方程式。
方案一,化学方程式:___________ ;___________
方案二,离子方程式:___________ ;___________
(4)在常温下,将 通入
通入 溶液中,可以得到一种漂白液。上述反应的离子方程式为
溶液中,可以得到一种漂白液。上述反应的离子方程式为___________ ,该漂白液的有效成分是___________ (填名称)。
(5)检验某溶液中是否含有 的方法是:
的方法是:___________ ,有关离子方程式是___________ 。
(1)离子方程式是重要的化学用语。下列是有关离子方程式的一个错误观点:酸碱中和反应均可表示为
 ,请用一个相应的“离子方程式”否定这个观点。
,请用一个相应的“离子方程式”否定这个观点。(2)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“
 ”来表示,请写出2个有关反应的化学方程式:
”来表示,请写出2个有关反应的化学方程式:①
②
(3)实验室用铁、氧化铜、稀硫酸为原料制取铜,某同学设计了两个实验方案:
方案一:
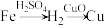
方案二:

写出上述两个方案每步转化的有关方程式。
方案一,化学方程式:
方案二,离子方程式:
(4)在常温下,将
 通入
通入 溶液中,可以得到一种漂白液。上述反应的离子方程式为
溶液中,可以得到一种漂白液。上述反应的离子方程式为(5)检验某溶液中是否含有
 的方法是:
的方法是:
您最近一年使用:0次
名校
解题方法
5 . NaCl是一种基础化工原料,通过电解饱和食盐水可以制得NaOH、H2、Cl2。完成下列填空:
(1)写出电解饱和食盐水的化学方程式_______ 。开始时_______ 极(阴、阳)碱性增强。
(2)新冠疫情期间需要大量消毒液,工业上生产消毒液是将氯气与烧碱溶液反应,完成该反应方程式_______ 。
(3)氯气压缩成为液氯属于_______ 变化(选填“物理”“化学”)。常用浓氨水来检查输氯管道是否泄漏,泄漏处会观察到大量的白烟(NH4Cl),其中一步反应是:2NH3+3Cl2→N2+6HCl,该反应也表明氯和氮的非金属性_______ > _______ 。写出产生白烟的化学方程式:_______ 。该白烟的成分溶于水,溶液呈_______ 性。(酸、碱或中性),用离子方程式解释原因_______ 。
(4)pH=2的醋酸和盐酸两溶液中,水的电离_______。
(5)取25 mLpH=2的醋酸溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)_______ c(CH3COO-)。
(1)写出电解饱和食盐水的化学方程式
(2)新冠疫情期间需要大量消毒液,工业上生产消毒液是将氯气与烧碱溶液反应,完成该反应方程式
(3)氯气压缩成为液氯属于
(4)pH=2的醋酸和盐酸两溶液中,水的电离_______。
| A.都被促进 | B.都被抑制 |
| C.甲中被促进,乙中被抑制 | D.甲中被抑制,乙中被促进 |
您最近一年使用:0次
名校
6 .  是一种重要的化工原料,工业上利用它可以制备一系列物质,请按要求回答下列问题。
是一种重要的化工原料,工业上利用它可以制备一系列物质,请按要求回答下列问题。
(1)很多金属或它们的化合物在灼烧的时候都会使火焰呈现出特征颜色,化学上把这种定性分析操作称为焰色实验,下列有关叙述中正确的是_______。
(2)氯化钠溶液通电后,发生反应的离子方程式为_______ ,氢气在氯气中燃烧的现象是_______ 。
(3)工业制漂白粉的化学反应方程式为_______ ,漂白粉的有效成分为_______ 。
(4)侯氏制碱法的原理是在饱和的食盐水中先通 达饱和后,再通入过量的
达饱和后,再通入过量的 气体产生沉淀,总的方程式为
气体产生沉淀,总的方程式为_______ 。
(5)在实验室制备氯气时,可以用 和浓
和浓 来代替浓盐酸与
来代替浓盐酸与 混合加热来制备氯气,请写出该化学反应的方程式
混合加热来制备氯气,请写出该化学反应的方程式_______ 。
(6)某研究性学习小组的同学在一次探究活动中,对一份纯碱样品(含有少量 )的纯度进行测定,现将
)的纯度进行测定,现将 样品加热至质量不再发生变化,其质量变为
样品加热至质量不再发生变化,其质量变为 ,则该
,则该 样品的纯度(质量分数)为
样品的纯度(质量分数)为_______ 。
 是一种重要的化工原料,工业上利用它可以制备一系列物质,请按要求回答下列问题。
是一种重要的化工原料,工业上利用它可以制备一系列物质,请按要求回答下列问题。
(1)很多金属或它们的化合物在灼烧的时候都会使火焰呈现出特征颜色,化学上把这种定性分析操作称为焰色实验,下列有关叙述中正确的是_______。
| A.焰色实验时可以用洁净的铜丝来代替铂丝进行实验 |
| B.用某样品做焰色实验时,直接观察到火焰呈黄色,可以确定该样品中不含钾元素 |
| C.节日燃放的五彩缤纷的烟花,就是利用了锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽的色彩 |
| D.焰色实验是元素的一种物理性质,属于物理变化 |
(3)工业制漂白粉的化学反应方程式为
(4)侯氏制碱法的原理是在饱和的食盐水中先通
 达饱和后,再通入过量的
达饱和后,再通入过量的 气体产生沉淀,总的方程式为
气体产生沉淀,总的方程式为(5)在实验室制备氯气时,可以用
 和浓
和浓 来代替浓盐酸与
来代替浓盐酸与 混合加热来制备氯气,请写出该化学反应的方程式
混合加热来制备氯气,请写出该化学反应的方程式(6)某研究性学习小组的同学在一次探究活动中,对一份纯碱样品(含有少量
 )的纯度进行测定,现将
)的纯度进行测定,现将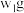 样品加热至质量不再发生变化,其质量变为
样品加热至质量不再发生变化,其质量变为 ,则该
,则该 样品的纯度(质量分数)为
样品的纯度(质量分数)为
您最近一年使用:0次
解题方法
7 . 氯气(液氯)、漂白粉、“84”消毒液等都是含氯消毒剂。已知:在酸性条件下,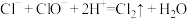 。
。
(1)工业上用电解饱和食盐水的方法制取氯气,实验室中可以用二氧化锰或高锰酸钾与浓盐酸反应制取氯气。
①写出二氧化锰与浓盐酸反应制取氯气的离子方程式:___________ ,该反应中氧化剂为,每生成7.1g气体反应中转移的电子的物质的量为___________ mol。
② 与浓盐酸的反应为
与浓盐酸的反应为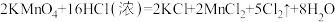 ,用
,用 和
和 分别与浓盐酸制备等量的氯气,消耗的
分别与浓盐酸制备等量的氯气,消耗的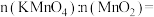
___________ 。
(2)由于氯气不便于保存,生活中常用的含氯消毒剂是漂白粉或“84”消毒液。
①常温下,将氯气通入NaOH溶液中,可以制得“84”消毒液,写出发生反应的离子方程式:___________ ,该消毒液的有效成分是___________ (填化学式)。生活中“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,原因是___________ 。
②将氯气通入石灰乳(主要成分是氢氧化钙)中可以制得漂白粉,漂白粉的主要成分为___________ (填化学式)。漂白粉长时间暴露在空气中会变质,请结合化学方程式解释其原因:___________ 。
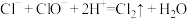 。
。(1)工业上用电解饱和食盐水的方法制取氯气,实验室中可以用二氧化锰或高锰酸钾与浓盐酸反应制取氯气。
①写出二氧化锰与浓盐酸反应制取氯气的离子方程式:
②
 与浓盐酸的反应为
与浓盐酸的反应为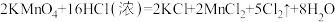 ,用
,用 和
和 分别与浓盐酸制备等量的氯气,消耗的
分别与浓盐酸制备等量的氯气,消耗的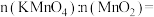
(2)由于氯气不便于保存,生活中常用的含氯消毒剂是漂白粉或“84”消毒液。
①常温下,将氯气通入NaOH溶液中,可以制得“84”消毒液,写出发生反应的离子方程式:
②将氯气通入石灰乳(主要成分是氢氧化钙)中可以制得漂白粉,漂白粉的主要成分为
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
8 . 回答下列问题:
(1)向Na2CO3溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是___ 。
(2)Na2CO3浓溶液中通入氯气时,可产生气体CO2和化合物NaClO3。反应的化学方程式为___ 。
(1)向Na2CO3溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是
(2)Na2CO3浓溶液中通入氯气时,可产生气体CO2和化合物NaClO3。反应的化学方程式为
您最近一年使用:0次
解题方法
9 . 氮、氧、硫、氯是四种重要的非金属元素,研究它们的性质及用途对生产,生活、科研具有重要意义。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,工业上可利用反应NHI3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备。
①一氯胺(NH2Cl)在中性或酸性环境中会发生水解反应,生成一种具有强烈杀菌作用的物质,该物质的电子式为___________ 。
②氨气也是工业上制备硝酸的主要原料,制备硝酸的过程中涉及NO2与水的反应。该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)SO2、NO2两种气体都能对大气造成污染,需要对其进行吸收处理。用氨水吸收SO2能得到含 (NH4)2SO3和NH4HSO3的吸收液,写出生成(NH4)2SO3的离子方程式:___________ 。若向吸收液中通入过量NO2,NH4HSO3能与NO2发生反应生成N2和(NH4)2SO4,写出该反应的离子方程式:___________ 。
(3)Cl2与NaOH溶液反应可制取“84”消毒液。用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3,),此时ClO-的浓度为c0 mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①写出溶液中NaClO分解生成NaClO3的化学方程式:___________ 。
②t时刻溶液中c(Cl-)=___________ mol/L(用含c0、c1的代数式表示)。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,工业上可利用反应NHI3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备。
①一氯胺(NH2Cl)在中性或酸性环境中会发生水解反应,生成一种具有强烈杀菌作用的物质,该物质的电子式为
②氨气也是工业上制备硝酸的主要原料,制备硝酸的过程中涉及NO2与水的反应。该反应中氧化剂与还原剂的物质的量之比为
(2)SO2、NO2两种气体都能对大气造成污染,需要对其进行吸收处理。用氨水吸收SO2能得到含 (NH4)2SO3和NH4HSO3的吸收液,写出生成(NH4)2SO3的离子方程式:
(3)Cl2与NaOH溶液反应可制取“84”消毒液。用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3,),此时ClO-的浓度为c0 mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①写出溶液中NaClO分解生成NaClO3的化学方程式:
②t时刻溶液中c(Cl-)=
您最近一年使用:0次
名校
解题方法
10 . 按要求书写方程式
(1)NaHSO4在熔融状态的电离方程式___________
(2)碳酸钙溶解在醋酸中的离子反应方程式___________
(3)将“ ”改写为对应的化学方程式
”改写为对应的化学方程式___________
(4)除去Na2CO3粉末中混有少量NaHCO3的化学方程式___________
(5)氯气与烧碱溶液反应的化学方程式为___________
(6)“84”消毒液与除垢剂(有效成分是盐酸)混合使用会产生黄绿色、有刺激性气味的气体,该反应的离子方程式是___________
(7)衣服上不小心沾到了蓝色墨水,可以先涂上酸性高锰酸钾溶液,即可除去蓝墨水中的鞣酸亚铁,再用乙二酸的稀溶液擦洗,可以迅速除去过量的 ,配平该反应的离子方程式:
,配平该反应的离子方程式:___________
_______MnO +_______H2C2O4+_______H+=_______CO2↑+_______Mn2++______H2O
+_______H2C2O4+_______H+=_______CO2↑+_______Mn2++______H2O
(1)NaHSO4在熔融状态的电离方程式
(2)碳酸钙溶解在醋酸中的离子反应方程式
(3)将“
 ”改写为对应的化学方程式
”改写为对应的化学方程式(4)除去Na2CO3粉末中混有少量NaHCO3的化学方程式
(5)氯气与烧碱溶液反应的化学方程式为
(6)“84”消毒液与除垢剂(有效成分是盐酸)混合使用会产生黄绿色、有刺激性气味的气体,该反应的离子方程式是
(7)衣服上不小心沾到了蓝色墨水,可以先涂上酸性高锰酸钾溶液,即可除去蓝墨水中的鞣酸亚铁,再用乙二酸的稀溶液擦洗,可以迅速除去过量的
 ,配平该反应的离子方程式:
,配平该反应的离子方程式:_______MnO
 +_______H2C2O4+_______H+=_______CO2↑+_______Mn2++______H2O
+_______H2C2O4+_______H+=_______CO2↑+_______Mn2++______H2O
您最近一年使用:0次



