解题方法
1 . 某化学小组制备 并验证
并验证 的部分性质,装置如图所示(部分夹持装置省略):
的部分性质,装置如图所示(部分夹持装置省略):

(1)仪器a的名称是___________ 。
(2)装置A制取 的反应中,利用了浓硫酸的
的反应中,利用了浓硫酸的___________ 性,___________ (填“能”或“不能”)用浓硝酸代替。
(3)在滴加浓硫酸之前,需先通入一段时间的 ,此操作的目的是
,此操作的目的是___________ 。
(4)装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为___________ 。
(5)装置D验证了 的漂白性,为了进一步探究
的漂白性,为了进一步探究 与品红作用的可逆性,请写出有关实验操作及现象:
与品红作用的可逆性,请写出有关实验操作及现象:___________ 。
(6)为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:

当注入标准状况下10mL混合气体时,酸性 ,溶液恰好褪色,假设混合气体中
,溶液恰好褪色,假设混合气体中 能被
能被 溶液充分吸收。已知:
溶液充分吸收。已知: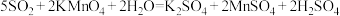 。该混合气体中二氧化硫的体积分数为
。该混合气体中二氧化硫的体积分数为___________ 。
 并验证
并验证 的部分性质,装置如图所示(部分夹持装置省略):
的部分性质,装置如图所示(部分夹持装置省略):
(1)仪器a的名称是
(2)装置A制取
 的反应中,利用了浓硫酸的
的反应中,利用了浓硫酸的(3)在滴加浓硫酸之前,需先通入一段时间的
 ,此操作的目的是
,此操作的目的是(4)装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为
(5)装置D验证了
 的漂白性,为了进一步探究
的漂白性,为了进一步探究 与品红作用的可逆性,请写出有关实验操作及现象:
与品红作用的可逆性,请写出有关实验操作及现象:(6)为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:

当注入标准状况下10mL混合气体时,酸性
 ,溶液恰好褪色,假设混合气体中
,溶液恰好褪色,假设混合气体中 能被
能被 溶液充分吸收。已知:
溶液充分吸收。已知: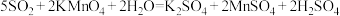 。该混合气体中二氧化硫的体积分数为
。该混合气体中二氧化硫的体积分数为
您最近一年使用:0次
2022-07-04更新
|
280次组卷
|
2卷引用:河南省平顶山市2021-2022学年高一下学期期末调研化学试题
名校
2 . 某化学兴趣小组欲制备SO2并探究其某些性质。
(1)探究二氧化硫的漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。

甲同学设计对照实验,但用足量碱石灰代替了氢氧化钠溶液,其原因是___ 。根据实验现象得出的实验结论是___ 。
(2)乙同学用如图所示装置验证二氧化硫的化学性质

①为验证二氧化硫的还原性,反应一段时间后,将试管d中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀。
上述方案合理的是___ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。试管d中发生反应的离子方程式为___ 。
②为了验证试管c中SO2与Fe3+发生了氧化还原反应,在如图装置中通入过量的SO2后,取试管c中的溶液分成三份,并设计了如下实验:
方案Ⅰ:向第一份溶液中加入酸性KMnO4溶液,紫色褪去;
方案Ⅱ:向第二份溶液中加入KSCN溶液不变红,再加入新制的氯水,溶液变红;
方案Ⅲ:向第三份溶液中加入用盐酸酸化的BaCl2溶液,产生白色沉淀。
指出上述不合理的方案并说明原因:___ 。试管e中发生反应的离子方程式为___ 。
(1)探究二氧化硫的漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。

甲同学设计对照实验,但用足量碱石灰代替了氢氧化钠溶液,其原因是
(2)乙同学用如图所示装置验证二氧化硫的化学性质

①为验证二氧化硫的还原性,反应一段时间后,将试管d中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀。
上述方案合理的是
②为了验证试管c中SO2与Fe3+发生了氧化还原反应,在如图装置中通入过量的SO2后,取试管c中的溶液分成三份,并设计了如下实验:
方案Ⅰ:向第一份溶液中加入酸性KMnO4溶液,紫色褪去;
方案Ⅱ:向第二份溶液中加入KSCN溶液不变红,再加入新制的氯水,溶液变红;
方案Ⅲ:向第三份溶液中加入用盐酸酸化的BaCl2溶液,产生白色沉淀。
指出上述不合理的方案并说明原因:
您最近一年使用:0次
名校
3 . 某研究性学习小组利用下列有关装置制备 ,并对
,并对 的性质进行探究(装置的气密性已检查)。已知:
的性质进行探究(装置的气密性已检查)。已知: 溶液显酸性。
溶液显酸性。

Ⅰ.探究 与可溶性钡的强酸盐是否反应(接口a接b)
与可溶性钡的强酸盐是否反应(接口a接b)
(1)滴加浓硫酸之前,打开弹簧夹,通入一段时间 ,再关闭弹簧夹,此操作的目的是
,再关闭弹簧夹,此操作的目的是_______ 。
(2)实验过程中装置B中没有明显变化,装置C中有白色沉淀生成,该沉淀不溶于稀盐酸。据B中现象得出的结论是_______ ,装置C中反应的离子方程式是_______ 。
(3)装置D中NaOH全部转化为 的标志为
的标志为_______ 。
Ⅱ.探究亚硫酸与次氯酸的酸性强弱(接口a接c)
(4)将少量装置A中生成的气体直接通入装置G中,不能根据G中现象判断亚硫酸与次氯酸的酸性强弱,理由是_______ (用化学反应方程式表示)。
(5)为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置E中药品是_______ ,其作用是_______ ,通过_______ 现象即可证明亚硫酸的酸性强于次氯酸。
 ,并对
,并对 的性质进行探究(装置的气密性已检查)。已知:
的性质进行探究(装置的气密性已检查)。已知: 溶液显酸性。
溶液显酸性。
Ⅰ.探究
 与可溶性钡的强酸盐是否反应(接口a接b)
与可溶性钡的强酸盐是否反应(接口a接b)(1)滴加浓硫酸之前,打开弹簧夹,通入一段时间
 ,再关闭弹簧夹,此操作的目的是
,再关闭弹簧夹,此操作的目的是(2)实验过程中装置B中没有明显变化,装置C中有白色沉淀生成,该沉淀不溶于稀盐酸。据B中现象得出的结论是
(3)装置D中NaOH全部转化为
 的标志为
的标志为Ⅱ.探究亚硫酸与次氯酸的酸性强弱(接口a接c)
(4)将少量装置A中生成的气体直接通入装置G中,不能根据G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
(5)为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置E中药品是
您最近一年使用:0次
2022-05-05更新
|
178次组卷
|
3卷引用:河南省豫北安阳、新乡、焦作、濮阳、鹤壁、济源名校2021-2022学年高一下学期4月期中考试化学试题
4 . 下列关于实验装置的表述错误的是


| A.实验室制取NH3装置中有两处错误 |
| B.实验室模拟制备SO3并收集 |
| C.将饱和食盐水换成氢氧化钠稀溶液可以迅速形成喷泉现象 |
| D.实验室制取乙炔气体时不可以用启普发生器 |
您最近一年使用:0次
5 . 实验小组设计如图所示装置,验证SO2性质,对实验现象分析不正确的是


| A.甲中制备SO2利用了硫酸的强氧化性 |
| B.乙中红色花瓣褪色,说明SO2具有漂白性 |
| C.丙中溶液红色变浅,说明SO2能与碱溶液反应 |
| D.若验证SO2具有还原性,可在甲乙装置间增加盛有饱和NaHSO3溶液的洗气瓶 |
您最近一年使用:0次
2021-05-10更新
|
426次组卷
|
3卷引用:河南濮阳市华龙区高级中学2021-2022学年高三上学期开学考试化学试题
6 . MnSO4晶体是一种易溶于水的微红色晶体,某校同学设计实验制备并检验MnSO4的性质。回答下列问题:
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:

①A装置中固体药品X通常是______ 填化学式)。
②B装置中通SO2的导管末端接多孔球泡的目的是______ ;C装置用于吸收少量的SO2,发生反应的离子方程式为______ 。
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为______ 。
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。

①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是______ 、______ (填字母)。
a.Ba(NO3)2溶液 b.BaCl2溶液 c.品红溶液 d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为______ 。
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要______ 。
(1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下:

①A装置中固体药品X通常是
②B装置中通SO2的导管末端接多孔球泡的目的是
(2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为
(3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。

①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是
a.Ba(NO3)2溶液 b.BaCl2溶液 c.品红溶液 d.浓硫酸
②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为
(4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要
您最近一年使用:0次
2019-10-28更新
|
201次组卷
|
3卷引用:河南省天一大联考2019学年高三年级上学期期末考试化学试题
7 . 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如图的实验装置:

(1)实验室用装置A,用浓硫酸和铜反应制备SO2,请写出化学反应方程式____________
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B_____ 、D______ ,停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B_____ 、D______ 。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)____________ 。

(1)实验室用装置A,用浓硫酸和铜反应制备SO2,请写出化学反应方程式
(2)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)
您最近一年使用:0次
2020-02-15更新
|
179次组卷
|
2卷引用:河南省洛阳市2019-2020学年高一上学期期末考试化学试题
名校
解题方法
8 . 下列实验目的、实验操作及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 验证肉桂醛中含碳碳双键 | 向肉桂醛( )中加入酸性KMnO4溶液 )中加入酸性KMnO4溶液 | 肉桂醛中含有碳碳双键 |
| B | 比较H2SO3与HClO的酸性强弱 | 往Ca(ClO)2溶液中通入SO2气体,有沉淀产生 | 酸性:H2SO3>HClO |
| C | 验证菠菜中含有铁元素 | 将新鲜菠菜剪碎、研磨、溶解、过滤,向滤液中加入几滴KSCN溶液,溶液不变红 | 说明菠菜中不含铁元素 |
| D | 判断强酸和弱酸 | NaHCO3溶液显碱性,NaHSO3溶液显酸性 | 可以确定H2CO3是弱酸,无法判断H2SO3是否为弱酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 根据实验目的,下列实验操作及现象、实验结论都正确的是
| 选项 | 实验目的 | 实验操作及现象 | 实验结论 |
| A | 检验硫酸厂周边空气是否含有SO2 | 用注射器多次抽取空气,慢慢注入盛有酸性KMnO4稀溶液的同一试管中,溶液不变色 | 空气中不含SO2 |
| B | 证明CH3COOH是弱电解质 | 用pH计分别测量醋酸溶液和盐酸的pH,醋酸溶液的pH大 | CH3COOH是弱电解质 |
| C | 探究淀粉的水解程度 | 向淀粉水解液中加入NaOH溶液调节溶液至碱性,并分成两份,向第一份中加入银氨溶液并水浴加热出现银镜;向第二份中滴加少量碘水,溶液变蓝色 | 淀粉部分水解 |
| D | 探究卤素单质Cl2、Br2和I2的氧化性强弱 | 向NaBr溶液中通入过量氯气,溶液变橙色,再滴加淀粉KI溶液,溶液变蓝色 | 氧化性:Cl2>Br2>I2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 某课题组设计实验探究SO2的性质。
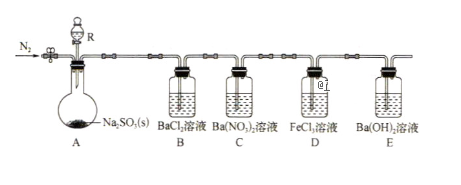
实验现象:B中无沉淀生成,C中有白色沉淀,D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是__________ .
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:__________ .
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2"的目的是____ .
(4)探究装置C中通入SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4+2SO42-+2NO+4H+
猜想2:通入少量的SO2,则发生反应的离子方程式为__________ 。
② 请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是(填字母)( )
A.KSCN溶液B.NaOH溶液C.K3[Fe(CN)6]溶液D.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适量M于试管中,滴少量盐酸(M剩余),所得溶液的pH__________ 7(填“>”“<”或“=”)。

实验现象:B中无沉淀生成,C中有白色沉淀,D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2"的目的是
(4)探究装置C中通入SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4+2SO42-+2NO+4H+
猜想2:通入少量的SO2,则发生反应的离子方程式为
② 请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
| 实验步骤 | 实验现象及结论 |
| 取少量C中反应后溶液于试管中, |
A.KSCN溶液B.NaOH溶液C.K3[Fe(CN)6]溶液D.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适量M于试管中,滴少量盐酸(M剩余),所得溶液的pH
您最近一年使用:0次
2017-07-25更新
|
270次组卷
|
2卷引用:2017届河南省天一大联考高三阶段性测试(六)(A卷) 理综化学试题



