解题方法
1 . 铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为:_______ ,此液体具有的性质是_______
a.光束通过该液体时形成光亮的“通路”
b.向该液体中加入AgNO3溶液,无沉淀产生
c.该液体能发生电泳现象,阴极附近颜色变深
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeC13溶液作为“腐蚀液”,请写出该反应的化学方程式_______ 。
(3)某氧化铝样品中含有氧化铁、氧化亚铁、碳杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题:
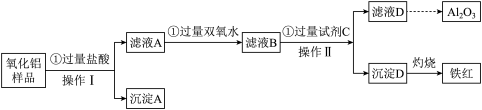
①操作I的名称是_______ ,该操作用到的玻璃棒的作用 _______ 。
②沉淀A的成分是_______ (填化学式);验证滤液A中存在Fe3+的具体操作和现象为: _______ 。
③用离子方程式说明步骤②中双氧水的作用:_______ 。
④滤液D焰色反应呈黄色,试剂C是_______ (填化学式);
(4)铝镁合金是飞机制造、建筑等行业的重要材料。为测定某铝镁合金(不含其他元素)中铝的质量分数,现将5.1g的铝镁合金与足量稀硫酸溶液反应,测得生成氢气的体积为5.6L(已换算成标准标准状况)。(请写出计算详细过程)
①合金中铝的质量分数________ ?(保留两位有效数字)
②反应后,测得溶液总体积为100mL,问溶液中Mg2+的物质的量浓度是多少_________ ?
(1)将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为:
a.光束通过该液体时形成光亮的“通路”
b.向该液体中加入AgNO3溶液,无沉淀产生
c.该液体能发生电泳现象,阴极附近颜色变深
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeC13溶液作为“腐蚀液”,请写出该反应的化学方程式
(3)某氧化铝样品中含有氧化铁、氧化亚铁、碳杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题:

①操作I的名称是
②沉淀A的成分是
③用离子方程式说明步骤②中双氧水的作用:
④滤液D焰色反应呈黄色,试剂C是
(4)铝镁合金是飞机制造、建筑等行业的重要材料。为测定某铝镁合金(不含其他元素)中铝的质量分数,现将5.1g的铝镁合金与足量稀硫酸溶液反应,测得生成氢气的体积为5.6L(已换算成标准标准状况)。(请写出计算详细过程)
①合金中铝的质量分数
②反应后,测得溶液总体积为100mL,问溶液中Mg2+的物质的量浓度是多少
您最近一年使用:0次
解题方法
2 . 工业上由黄铜矿(主要成分为 )冶炼铜和制备硫酸的生产流程如图所示:
)冶炼铜和制备硫酸的生产流程如图所示:
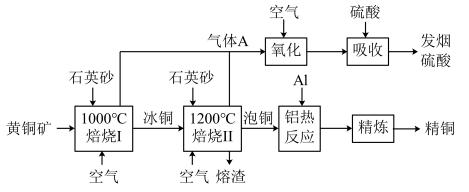
已知:冰铜主要成分是 、
、 ,泡铜主要成分是
,泡铜主要成分是 、
、 。
。
回答下列问题:
(1)提高黄铜矿焙烧利用率的措施有_______ (答两条)。
(2)“焙烧Ⅱ”被称为“火法炼铜”, 转化为
转化为 ,
, 继续与
继续与 反应生成
反应生成 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)“铝热反应”的化学方程式为 ,用双线桥法表示出该反应的电子转移情况:
,用双线桥法表示出该反应的电子转移情况:_______ 。
(4)写出“氧化”步骤发生反应的化学方程式:_______ 。
(5)某发烟硫酸中含 和
和 分子的个数比为
分子的个数比为 ,
,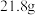 该发烟硫酸中加入
该发烟硫酸中加入_______ g水可转化成98%的浓硫酸。
 )冶炼铜和制备硫酸的生产流程如图所示:
)冶炼铜和制备硫酸的生产流程如图所示:
已知:冰铜主要成分是
 、
、 ,泡铜主要成分是
,泡铜主要成分是 、
、 。
。回答下列问题:
(1)提高黄铜矿焙烧利用率的措施有
(2)“焙烧Ⅱ”被称为“火法炼铜”,
 转化为
转化为 ,
, 继续与
继续与 反应生成
反应生成 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:(3)“铝热反应”的化学方程式为
 ,用双线桥法表示出该反应的电子转移情况:
,用双线桥法表示出该反应的电子转移情况:(4)写出“氧化”步骤发生反应的化学方程式:
(5)某发烟硫酸中含
 和
和 分子的个数比为
分子的个数比为 ,
,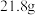 该发烟硫酸中加入
该发烟硫酸中加入
您最近一年使用:0次
名校
3 . 钇(Y)是稀土元素中含量丰富的元素之一,钇及其化合物在航天、电子、超导等方面有着广泛的应用。湖北应山-大悟地区含有较为丰富硅铍钇矿[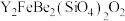 ],工业上通过如下生产流程可获得氧化钇。
],工业上通过如下生产流程可获得氧化钇。
已知: 元素与
元素与 元素性质相似;草酸可与多种过渡金属离子形成可溶性配位化合物;
元素性质相似;草酸可与多种过渡金属离子形成可溶性配位化合物;
(1)在自然界中,钇只有一种稳定同位素 ,Y位于元素周期表的第
,Y位于元素周期表的第_______ 周期第ⅢB族。硅铍钇矿[ ]中Y的化合价为+3价,
]中Y的化合价为+3价, 的化合价为
的化合价为_______ 。
(2)焙烧的目的是将矿石中的Y元素转化为 ,并将
,并将 元素转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
元素转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是_______ 。硅铍钇矿与熔融氢氧化钠焙烧后含铁元素的产物是_______ (写化学式)。
(3)“萃取分液”实验需要的玻璃仪器有_______ 。
(4)滤液Ⅱ中的_______ (填物质名称)可参与循环使用。
(5)反应过程中,测得Y的沉淀率随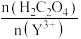 的变化情况如图所示。当草酸用量过多时,钇的沉淀率下降的原因是
的变化情况如图所示。当草酸用量过多时,钇的沉淀率下降的原因是_______ 。

(6)“焙烧”过程生成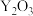 的化学方程式为
的化学方程式为_______ 。
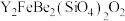 ],工业上通过如下生产流程可获得氧化钇。
],工业上通过如下生产流程可获得氧化钇。
已知:
 元素与
元素与 元素性质相似;草酸可与多种过渡金属离子形成可溶性配位化合物;
元素性质相似;草酸可与多种过渡金属离子形成可溶性配位化合物;(1)在自然界中,钇只有一种稳定同位素
 ,Y位于元素周期表的第
,Y位于元素周期表的第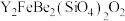 ]中Y的化合价为+3价,
]中Y的化合价为+3价, 的化合价为
的化合价为(2)焙烧的目的是将矿石中的Y元素转化为
 ,并将
,并将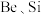 元素转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是
元素转化为可溶性钠盐,焙烧时气体与矿料逆流而行,目的是(3)“萃取分液”实验需要的玻璃仪器有
(4)滤液Ⅱ中的
(5)反应过程中,测得Y的沉淀率随
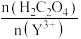 的变化情况如图所示。当草酸用量过多时,钇的沉淀率下降的原因是
的变化情况如图所示。当草酸用量过多时,钇的沉淀率下降的原因是
(6)“焙烧”过程生成
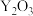 的化学方程式为
的化学方程式为
您最近一年使用:0次
2022-11-10更新
|
462次组卷
|
5卷引用:湖北省宜城一中、枣阳一中等六校联考2022-2023学年高三上学期期中考试化学试题
湖北省宜城一中、枣阳一中等六校联考2022-2023学年高三上学期期中考试化学试题(已下线)化学(重庆A卷)-学易金卷:2023年高考第一次模拟考试卷湖南株洲南方中学2022-2023学年高三第四次月考化学试题湖南师范大学附属中学2023-2024学年高二上学期入学考试化学试题 (已下线)工业流程题
4 . 锰及其化合物在催化剂及金属材料方面有重要的应用。
(1)金属锰常用铝热法由软锰矿还原制得。因铝与软锰矿反应过于激烈,故先将软锰矿加强热使之转变为Mn3O4,然后与铝粉混合高温燃烧,具体反应如下
i.3MnO2 Mn3O4+O2↑,
Mn3O4+O2↑,
ii.____。
写出第ii步反应的化学方程式____ 。
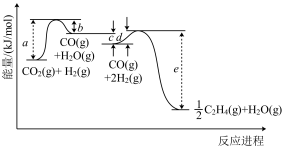
②锰基催化剂可用于催化CO2加氢合成乙烯,其中部分反应历程如图1。则反应2CO2(g)+6H2(g)=C2H4(g)+4H2O(g)的焓变为____ (列式用字母表示),该反应自发进行的条件是____ (填“高温”“低温”或“任意温度”)。
(2)EDTA即乙二胺四乙酸,简写为(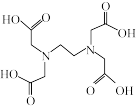 ,H4Y),因能与众多金属离子络合而在化学分析与测定中有广泛应用。
,H4Y),因能与众多金属离子络合而在化学分析与测定中有广泛应用。
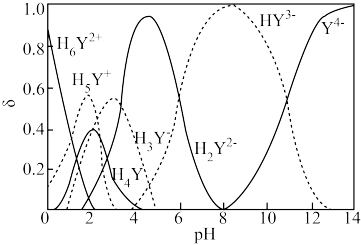
①EDTA在水溶液中总共有六级离解平衡,相当于六元酸。室温时其各种存在形式的分布系数δ随pH值的变化关系如图所示,下列说法不正确的是____ 。
A.EDTA在水溶液中有七种存在形式
B.室温时,H4Y的电离常数≈10-2.0
C.向溶液中加入少量NaOH固体,平衡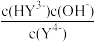 的值增大
的值增大
D.等浓度的H6Y2+和H5Y+按体积比约1:9可配成pH≈0的缓冲溶液
②20℃时,测得EDTA溶液中lg 与pH值的关系如图所示:(其中c(Y4-)表示Y4-的平衡浓度,c(Y′)表示EDTA除Y4-外其它存在形式的浓度之和)
与pH值的关系如图所示:(其中c(Y4-)表示Y4-的平衡浓度,c(Y′)表示EDTA除Y4-外其它存在形式的浓度之和)

已知EDTA与Mn2+的络合反应为:Mn2++Y4- MnY2-,K=1.0×1014。工业上利用该反应回收水溶液中的Mn2+。数据表明,溶液中H+的存在会降低EDTA与金属离子的络合能力,试从平衡移动的角度解释原因
MnY2-,K=1.0×1014。工业上利用该反应回收水溶液中的Mn2+。数据表明,溶液中H+的存在会降低EDTA与金属离子的络合能力,试从平衡移动的角度解释原因____ 。化学上常用条件稳定常数KMY来描述金属离子M2+与EDTA络合产物的稳定性,(已知KMY= ,其中c(Y)表示EDTA所有存在形式的总浓度),现实验室通过将一定浓度的EDTA溶液与0.02mol/L的MnSO4溶液等体积混合来模拟回收Mn2+,充分反应后测得溶液pH=4.2,c(Y′)=0.01mol/L,计算此时的条件稳定常数KMY=
,其中c(Y)表示EDTA所有存在形式的总浓度),现实验室通过将一定浓度的EDTA溶液与0.02mol/L的MnSO4溶液等体积混合来模拟回收Mn2+,充分反应后测得溶液pH=4.2,c(Y′)=0.01mol/L,计算此时的条件稳定常数KMY=____ ,溶液中剩余的Mn2+ “浓度为____ 。
(1)金属锰常用铝热法由软锰矿还原制得。因铝与软锰矿反应过于激烈,故先将软锰矿加强热使之转变为Mn3O4,然后与铝粉混合高温燃烧,具体反应如下
i.3MnO2
 Mn3O4+O2↑,
Mn3O4+O2↑,ii.____。
写出第ii步反应的化学方程式
②锰基催化剂可用于催化CO2加氢合成乙烯,其中部分反应历程如图1。则反应2CO2(g)+6H2(g)=C2H4(g)+4H2O(g)的焓变为

(2)EDTA即乙二胺四乙酸,简写为(
 ,H4Y),因能与众多金属离子络合而在化学分析与测定中有广泛应用。
,H4Y),因能与众多金属离子络合而在化学分析与测定中有广泛应用。①EDTA在水溶液中总共有六级离解平衡,相当于六元酸。室温时其各种存在形式的分布系数δ随pH值的变化关系如图所示,下列说法不正确的是

A.EDTA在水溶液中有七种存在形式
B.室温时,H4Y的电离常数≈10-2.0
C.向溶液中加入少量NaOH固体,平衡
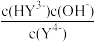 的值增大
的值增大D.等浓度的H6Y2+和H5Y+按体积比约1:9可配成pH≈0的缓冲溶液
②20℃时,测得EDTA溶液中lg
 与pH值的关系如图所示:(其中c(Y4-)表示Y4-的平衡浓度,c(Y′)表示EDTA除Y4-外其它存在形式的浓度之和)
与pH值的关系如图所示:(其中c(Y4-)表示Y4-的平衡浓度,c(Y′)表示EDTA除Y4-外其它存在形式的浓度之和)
已知EDTA与Mn2+的络合反应为:Mn2++Y4-
 MnY2-,K=1.0×1014。工业上利用该反应回收水溶液中的Mn2+。数据表明,溶液中H+的存在会降低EDTA与金属离子的络合能力,试从平衡移动的角度解释原因
MnY2-,K=1.0×1014。工业上利用该反应回收水溶液中的Mn2+。数据表明,溶液中H+的存在会降低EDTA与金属离子的络合能力,试从平衡移动的角度解释原因 ,其中c(Y)表示EDTA所有存在形式的总浓度),现实验室通过将一定浓度的EDTA溶液与0.02mol/L的MnSO4溶液等体积混合来模拟回收Mn2+,充分反应后测得溶液pH=4.2,c(Y′)=0.01mol/L,计算此时的条件稳定常数KMY=
,其中c(Y)表示EDTA所有存在形式的总浓度),现实验室通过将一定浓度的EDTA溶液与0.02mol/L的MnSO4溶液等体积混合来模拟回收Mn2+,充分反应后测得溶液pH=4.2,c(Y′)=0.01mol/L,计算此时的条件稳定常数KMY=
您最近一年使用:0次
解题方法
5 . 工业上常用铝土矿冶炼金属铝,流程中包含下列过程:
铝土矿 AlCl3溶液
AlCl3溶液 Al(OH)3
Al(OH)3 Al2O3
Al2O3 Al
Al
(1)按要求填空
①请写出Ⅰ的反应方程式_______ 。
②氨气溶于水,所得溶液呈_______ 性。
(2)工业上合成氨的反应为:N2(g)+3H2(g) 2NH3(g)。一定条件下,将1molN2和3molH2置于1L 的密闭容器中,10min后测得N2为0.4mol。则:
2NH3(g)。一定条件下,将1molN2和3molH2置于1L 的密闭容器中,10min后测得N2为0.4mol。则:
①用N2表示该反应的速率为_______ mol/(L•min);
②其他条件不变时,再通入1molN2,该反应的速率将_______ 。
③一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是_______ 。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.该条件下,N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.恒容时体系密度保持不变
铝土矿
 AlCl3溶液
AlCl3溶液 Al(OH)3
Al(OH)3 Al2O3
Al2O3 Al
Al(1)按要求填空
①请写出Ⅰ的反应方程式
②氨气溶于水,所得溶液呈
(2)工业上合成氨的反应为:N2(g)+3H2(g)
 2NH3(g)。一定条件下,将1molN2和3molH2置于1L 的密闭容器中,10min后测得N2为0.4mol。则:
2NH3(g)。一定条件下,将1molN2和3molH2置于1L 的密闭容器中,10min后测得N2为0.4mol。则:①用N2表示该反应的速率为
②其他条件不变时,再通入1molN2,该反应的速率将
③一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.该条件下,N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.恒容时体系密度保持不变
您最近一年使用:0次
解题方法
6 . 用废旧复离子电池正极材料分离回收金属元素,正极材料主要为活性材料LiNixCoyMn1-x-yO2与铝箔组成,工艺流程知下:

已知: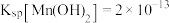 ,
,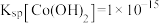 ,
,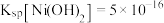
回答下列问题:
(1)碱浸结束后,滤液中的阴离子除了 ,主要还有
,主要还有___________ (填化学式)。正极活性材料LiNixCoyMn1-x-yO2中Ni、Co、Mn化合价相同,则它们的化合价为___________ 。
(2)固相反应一般反应速率较慢,加快还原焙烧反应速率的方法可以是___________ (至少写两种)。
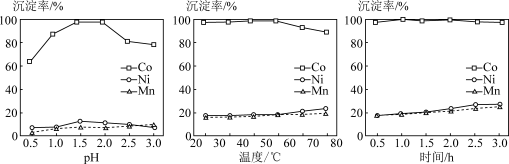
(3)①外界条件pH、温度和搅拌时间对三种金属离子沉淀率的影响如下图,则沉钴最合适的条件为___________ (填标号)。
a.pH=2.0温度55℃时间1.0h b.pH=1.5温度75℃时间1.0h
c.pH=2.0温度55℃时间3.0h d.pH=1.5温度75℃时间3.0h
②洗涤碱式碳酸镍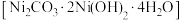 最好选择
最好选择___________ (填标号)。
a.碳酸钠溶液b.氢氧化钠溶液c.氨水d.蒸馏水
③写出沉锰过程中生成 的离子反应方程式:
的离子反应方程式:___________ 。
(4)共沉淀法是将两个或两个以上组分同时沉淀的一种方法。酸浸后也可直接调pH使 、
、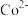 、
、 沉淀完全回收,则pH应大于
沉淀完全回收,则pH应大于___________ (已知:lg2=0.3,溶液中离子浓度小于 认为沉淀完全)。
认为沉淀完全)。

已知:
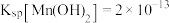 ,
,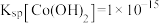 ,
,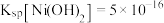
回答下列问题:
(1)碱浸结束后,滤液中的阴离子除了
 ,主要还有
,主要还有(2)固相反应一般反应速率较慢,加快还原焙烧反应速率的方法可以是
(3)①外界条件pH、温度和搅拌时间对三种金属离子沉淀率的影响如下图,则沉钴最合适的条件为
a.pH=2.0温度55℃时间1.0h b.pH=1.5温度75℃时间1.0h
c.pH=2.0温度55℃时间3.0h d.pH=1.5温度75℃时间3.0h

②洗涤碱式碳酸镍
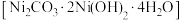 最好选择
最好选择a.碳酸钠溶液b.氢氧化钠溶液c.氨水d.蒸馏水
③写出沉锰过程中生成
 的离子反应方程式:
的离子反应方程式:(4)共沉淀法是将两个或两个以上组分同时沉淀的一种方法。酸浸后也可直接调pH使
 、
、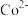 、
、 沉淀完全回收,则pH应大于
沉淀完全回收,则pH应大于 认为沉淀完全)。
认为沉淀完全)。
您最近一年使用:0次
7 . 兰尼镍(Raney-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,常用作烯烃、炔烃等氢化反应催化剂,其高催化活性源自于镍本身的催化性质和其多孔结构对氢气的强吸附性。由镍矿渣(主要含Ni(OH)2、NiS,还含铁、铜、钙、镁化合物及其他不溶性杂质)制备兰尼镍的过程可表示如下:

已知:①Ksp(NiS)=1.07×10-21,Ksp(CuS)=1.27×10-26
②室温下,金属离子的沉淀pH范围如表:
(1)“酸溶”前将镍矿渣粉碎的目的是_______ 。
(2)“酸溶”过程中,NiS发生反应的离子方程式为_______ 。
(3)“除杂”过程分步进行,除铁时所调pH范围为_______ ,除铜时加入NiS发生的反应:NiS(s)+Cu2+(aq)=CuS(s)+Ni2+(aq),该反应的平衡常数K=_______ (保留三位有效数字)。
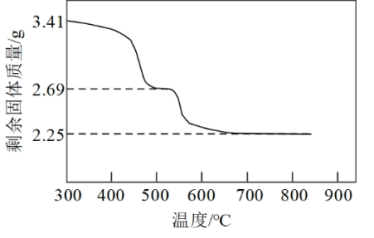
(4)“沉镍”所得沉淀有多种组成,可表示为xNiCO3•yNi(OH)2•zH2O。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(500℃~700℃条件下收集到的气体产物只有一种,700℃以上残留固体为NiO)。通过计算确定该样品的化学式为_______ 。
(5)“浸出”是制备兰尼镍的关键步骤,NaOH溶液在“浸出”过程中的作用是_______ 。
(6)使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是_____ 。

已知:①Ksp(NiS)=1.07×10-21,Ksp(CuS)=1.27×10-26
②室温下,金属离子的沉淀pH范围如表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 7.5 | 9.0 |
| Fe3+ | 2.2 | 3.2 |
| Ni2+ | 7.2 | 8.7 |
| Cu2+ | 5.6 | 6.7 |
| Mg2+ | 9.4 | 12.4 |
(2)“酸溶”过程中,NiS发生反应的离子方程式为
(3)“除杂”过程分步进行,除铁时所调pH范围为
(4)“沉镍”所得沉淀有多种组成,可表示为xNiCO3•yNi(OH)2•zH2O。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(500℃~700℃条件下收集到的气体产物只有一种,700℃以上残留固体为NiO)。通过计算确定该样品的化学式为

(5)“浸出”是制备兰尼镍的关键步骤,NaOH溶液在“浸出”过程中的作用是
(6)使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是
您最近一年使用:0次
名校
解题方法
8 . 将 由
由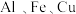 组成的合金等分为两份,将其中一份合金溶于足量的
组成的合金等分为两份,将其中一份合金溶于足量的 溶液中,产生气体
溶液中,产生气体 (标准状况);另一份合金溶于过量的稀硝酸中,得到
(标准状况);另一份合金溶于过量的稀硝酸中,得到 (标准状况下)
(标准状况下) 气体,向反应后的溶液中加入过量的
气体,向反应后的溶液中加入过量的 溶液,过滤得到滤液X和
溶液,过滤得到滤液X和 的沉淀Y(若
的沉淀Y(若 的还原产物仅为
的还原产物仅为 ),则下列说法正确的是
),则下列说法正确的是
 由
由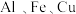 组成的合金等分为两份,将其中一份合金溶于足量的
组成的合金等分为两份,将其中一份合金溶于足量的 溶液中,产生气体
溶液中,产生气体 (标准状况);另一份合金溶于过量的稀硝酸中,得到
(标准状况);另一份合金溶于过量的稀硝酸中,得到 (标准状况下)
(标准状况下) 气体,向反应后的溶液中加入过量的
气体,向反应后的溶液中加入过量的 溶液,过滤得到滤液X和
溶液,过滤得到滤液X和 的沉淀Y(若
的沉淀Y(若 的还原产物仅为
的还原产物仅为 ),则下列说法正确的是
),则下列说法正确的是A. 的合金中含铝 的合金中含铝 | B.滤液X中的溶质只有硝酸钠 |
| C.V为6.72 | D.沉淀Y中含氢氧化铜 |
您最近一年使用:0次
2022-05-14更新
|
721次组卷
|
3卷引用:山东省临沂市2021-2022学年高一下学期期中考试化学试题
解题方法
9 . 氢化肉桂酸是香料的定香剂,用作医药中间体,也可用于有机合成。其制备原理为: 。
。
催化剂的制备:用镍铝合金(NiAl2)经氢氧化钠溶液处理及洗涤后制得多孔且表面积很大的海绵状的镍。
实验过程:
①在100 mL的圆底烧瓶中溶解3.0 g肉桂酸于45 mL温热的95%乙醇中。冷却至室温后加入2 mL已制好的催化剂的悬浊液,并用少量乙醇冲洗瓶壁,如图1所示。
②氢化开始前,打开活塞2,将装置抽真空。关闭与真空系统相连的活塞2,打开与氢气袋相连的活塞1,使氢气与贮氢筒连通,同时降低平衡瓶的位置,用排水集气法使贮氢筒内充满氢气,关闭活塞1。记下贮氢筒内氢气的体积,即可开始氢化反应。
③开动电磁搅拌、记下氢化反应开始的时间,每隔一定时间后,记录贮氢筒内氢气的体积变化,如图2所示。充分反应后干燥称重,产量约2.5 g,减压蒸馏进一步纯化(杂质主要是肉桂酸)如图3所示,收集 的馏分,称量计算产率。
的馏分,称量计算产率。

已知:
(1)写出镍铝合金(NiAl2)制备海绵镍的化学方程式_______ 。
(2)实验进行之前,应该首先_______ 。
(3)氢化反应完成所需的时间及标志_______ 、_______ ,氢化过程中的氢气的实际用量比理论用量高出很多的原因_______ 。
(4)反应时、平衡瓶的水平面应略高于贮氢筒内的水平面,目的是_______ ,每次读数除了冷却室温还需注意_______ 。
(5)减压蒸馏时最好使用_______ 加热。
A.油浴 B.水浴 C.沙浴
(6)提纯氢化肉桂酸时,用减压蒸馏而不用常压蒸馏的原因是_______ 。
 。
。催化剂的制备:用镍铝合金(NiAl2)经氢氧化钠溶液处理及洗涤后制得多孔且表面积很大的海绵状的镍。
实验过程:
①在100 mL的圆底烧瓶中溶解3.0 g肉桂酸于45 mL温热的95%乙醇中。冷却至室温后加入2 mL已制好的催化剂的悬浊液,并用少量乙醇冲洗瓶壁,如图1所示。
②氢化开始前,打开活塞2,将装置抽真空。关闭与真空系统相连的活塞2,打开与氢气袋相连的活塞1,使氢气与贮氢筒连通,同时降低平衡瓶的位置,用排水集气法使贮氢筒内充满氢气,关闭活塞1。记下贮氢筒内氢气的体积,即可开始氢化反应。
③开动电磁搅拌、记下氢化反应开始的时间,每隔一定时间后,记录贮氢筒内氢气的体积变化,如图2所示。充分反应后干燥称重,产量约2.5 g,减压蒸馏进一步纯化(杂质主要是肉桂酸)如图3所示,收集
 的馏分,称量计算产率。
的馏分,称量计算产率。
已知:
| 名称 | 相对分子量 | 熔点/℃ | 沸点/℃ |
| 肉桂酸 | 148 | 135 | 300 |
| 氢化肉桂酸 | 150 | 48.5 | 280 |
(2)实验进行之前,应该首先
(3)氢化反应完成所需的时间及标志
(4)反应时、平衡瓶的水平面应略高于贮氢筒内的水平面,目的是
(5)减压蒸馏时最好使用
A.油浴 B.水浴 C.沙浴
(6)提纯氢化肉桂酸时,用减压蒸馏而不用常压蒸馏的原因是
您最近一年使用:0次
解题方法
10 . 理想气体状态方程 ,是描述理想气体的物质的量与其体积、分压、温度间关系的状态方程。其中气体常数R可通过如下实验测定。
,是描述理想气体的物质的量与其体积、分压、温度间关系的状态方程。其中气体常数R可通过如下实验测定。

(1)组装仪器:简易量气装置的量气管可用_______ (填一种常用仪器名称)代替;组装完成后,须进行_______ (填操作名称)。
(2)装药品:向反应管内加入足量的稀硫酸,_______ (填“能”或“不能”)用稀硝酸代替稀硫酸,理由是_______ ;铝片打磨后称量,再用铜丝缠绕并放在反应管口,用铜丝缠绕铝片的目的是_______ 。
反应:读取量气管的起始读数后,移动反应管,使铝片滑入稀硫酸中。
(3)测量体积:待反应管内溶液无明显气泡产生后,对量气管进行第2次读数。读数时,应注意_______ 、_______ (回答2点)。
(4)数据计算:实验数据如下表所示。
甲同学用以上数据代入公式进行计算,得到气体常数
_______  (用计算式表示)。
(用计算式表示)。
(5)误差分析:通过计算发现,气体常数R的测量值稍大于理论值,若排除实验过程的操作误差,导致测量值偏大可能的原因是_______ 。
 ,是描述理想气体的物质的量与其体积、分压、温度间关系的状态方程。其中气体常数R可通过如下实验测定。
,是描述理想气体的物质的量与其体积、分压、温度间关系的状态方程。其中气体常数R可通过如下实验测定。
(1)组装仪器:简易量气装置的量气管可用
(2)装药品:向反应管内加入足量的稀硫酸,
反应:读取量气管的起始读数后,移动反应管,使铝片滑入稀硫酸中。
(3)测量体积:待反应管内溶液无明显气泡产生后,对量气管进行第2次读数。读数时,应注意
(4)数据计算:实验数据如下表所示。
| 铝片质量 | 反应前量气管读数 | 反应后反应后量气管读数 | 室内温度 | 室内压强 |
| 0.0270g | 0.50mL | 38.90mL | 295.4K |  |

 (用计算式表示)。
(用计算式表示)。(5)误差分析:通过计算发现,气体常数R的测量值稍大于理论值,若排除实验过程的操作误差,导致测量值偏大可能的原因是
您最近一年使用:0次
2022-03-05更新
|
602次组卷
|
3卷引用:福建省福州市2022届高中毕业班(3月)第二次质量检测化学试题



