名校
解题方法
1 . 回答下列问题:
(1)某同学写出以下三个化学方程式(未配平):
①
②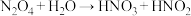
③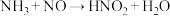
其中你认为一定不可能实现的是_______ (填序号)。
(2)下列三个氧化还原反应中
①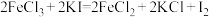
②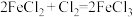
③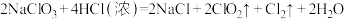
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除Cl2单质外,还可以用上述反应中的_______ 做氧化剂。
(3)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2,其中NO难溶于水,NO2易溶于水且能与水反应产生NO;HNO2是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+(还原性I->Fe2+)。AgNO2是一种难溶于水,易溶于酸的化合物。试回答下列问题:
①下列方法中,不能用来区分NaNO2和NaCl的是_______ (填序号)
A.加入稀硫酸,观察是否有气泡产生
B.在酸性条件下加入KI-淀粉溶液,观察溶液颜色
C.加入AgNO3溶液,观察是否有沉淀产生
②某同学把氯气通入到NaNO2溶液中,生成NaNO3和一种无氧酸,请写出反应的化学方程式:_______ 。
(4) Cl2、HClO、Ca(ClO)2、Na2O2等是中学教材中常见强氧化剂,已知+4价的硫既具氧化性又具还原性,以还原性为主。在次氯酸钙溶液中通入过量的SO2,有白色沉淀生成,其离子方程式为_______ 。
(1)某同学写出以下三个化学方程式(未配平):
①

②
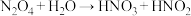
③
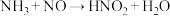
其中你认为一定不可能实现的是
(2)下列三个氧化还原反应中
①
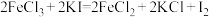
②
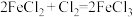
③
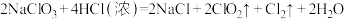
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除Cl2单质外,还可以用上述反应中的
(3)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2,其中NO难溶于水,NO2易溶于水且能与水反应产生NO;HNO2是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+(还原性I->Fe2+)。AgNO2是一种难溶于水,易溶于酸的化合物。试回答下列问题:
①下列方法中,不能用来区分NaNO2和NaCl的是
A.加入稀硫酸,观察是否有气泡产生
B.在酸性条件下加入KI-淀粉溶液,观察溶液颜色
C.加入AgNO3溶液,观察是否有沉淀产生
②某同学把氯气通入到NaNO2溶液中,生成NaNO3和一种无氧酸,请写出反应的化学方程式:
(4) Cl2、HClO、Ca(ClO)2、Na2O2等是中学教材中常见强氧化剂,已知+4价的硫既具氧化性又具还原性,以还原性为主。在次氯酸钙溶液中通入过量的SO2,有白色沉淀生成,其离子方程式为
您最近一年使用:0次
2 . 为了探究 、
、 同时通入
同时通入 中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。 、
、 气体,现采用
气体,现采用 固体与
固体与 的硫酸为原料制取
的硫酸为原料制取 ,采用
,采用 和浓盐酸(
和浓盐酸( )为原料制取
)为原料制取 。在此实验中,F仪器的作用是
。在此实验中,F仪器的作用是___________ ;发生装置B应选择以下三种装置中的___________ (填①或②或③)。___________ ,写出气体发生装置B中主要反应的离子方程式___________ 。
(3)将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。上述现象体现了浓硫酸的___________ (填序号)①酸性②吸水性③脱水性④强氧化性,请写出“体积膨胀,并放出有刺激性气味的气体”对应的化学方程式:___________ 。
(4)为验证通入D装置中的气体是 过量还是
过量还是 过量,兴趣小组的同学准备了以下试剂:a.氯化铁溶液b.氯化亚铁溶液c.硫氰化钾溶液d.氯化钡溶液e.品红溶液f.酸性高锰酸钾溶液;
过量,兴趣小组的同学准备了以下试剂:a.氯化铁溶液b.氯化亚铁溶液c.硫氰化钾溶液d.氯化钡溶液e.品红溶液f.酸性高锰酸钾溶液;
若 过量,取适量D中溶液滴加至盛有
过量,取适量D中溶液滴加至盛有___________ (选填一个序号)试剂的试管内,再加入___________ (选填一个序号)试剂,发生的现象是___________ 。
 、
、 同时通入
同时通入 中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。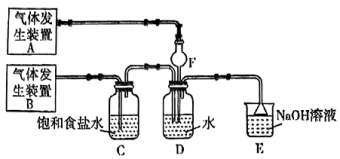
 、
、 气体,现采用
气体,现采用 固体与
固体与 的硫酸为原料制取
的硫酸为原料制取 ,采用
,采用 和浓盐酸(
和浓盐酸(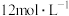 )为原料制取
)为原料制取 。在此实验中,F仪器的作用是
。在此实验中,F仪器的作用是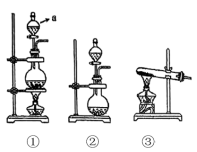
(3)将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。上述现象体现了浓硫酸的
(4)为验证通入D装置中的气体是
 过量还是
过量还是 过量,兴趣小组的同学准备了以下试剂:a.氯化铁溶液b.氯化亚铁溶液c.硫氰化钾溶液d.氯化钡溶液e.品红溶液f.酸性高锰酸钾溶液;
过量,兴趣小组的同学准备了以下试剂:a.氯化铁溶液b.氯化亚铁溶液c.硫氰化钾溶液d.氯化钡溶液e.品红溶液f.酸性高锰酸钾溶液;若
 过量,取适量D中溶液滴加至盛有
过量,取适量D中溶液滴加至盛有
您最近一年使用:0次
解题方法
3 . 某酸性废液中含有 四种金属离子。有同学设计下列方案对废液进行处理(所加试剂均稍过量),减少对环境的污染,流程如图所示:
四种金属离子。有同学设计下列方案对废液进行处理(所加试剂均稍过量),减少对环境的污染,流程如图所示:

回答下列问题:
(1)该酸性废液中可能大量含有的阴离子是 (填标号)。
A. | B. | C. | D. |
(2)沉淀
 的化学式是
的化学式是 的化学式是
的化学式是(3)已知氧化性强弱:
 ,加入铁屑发生的离子反应有:
,加入铁屑发生的离子反应有:①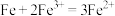 ;
;
②
③
(4)判断铁屑过量的实验现象是
(5)检验溶液
 中不含
中不含 的操作及现象是
的操作及现象是(6)向溶液
 中逐滴加入稀盐酸,理论上先后参与反应的离子依次是
中逐滴加入稀盐酸,理论上先后参与反应的离子依次是 。
。
您最近一年使用:0次
名校
解题方法
4 . 铁及其化合物在人类生产生活中发挥着重要作用。其中,K2FeO4为紫色固体,微溶于KOH浓溶液;在碱性溶液中较稳定;具有强氧化性,是一种多功能饮用水处理剂;在碱性条件下,可由NaClO氧化Fe(NO3)3制备。硫酸亚铁按(NH4)2Fe(SO4)2]常用于滴定测量。下列关于铁及其化合物的性质与用途具有对应关系的是
| A.Fe2O3属于碱性氧化物,可用作颜料 |
| B.常温下Fe遇浓硫酸钝化,可用铁制槽罐车运输浓硫酸 |
| C.FeCl3溶液显酸性,可用于蚀刻铜质印刷电路板 |
| D.K2FeO4溶液具有吸附性,可用于饮用水的消毒杀菌 |
您最近一年使用:0次
2022-01-23更新
|
259次组卷
|
3卷引用:四川省成都外国语学校2021-2022学年高一下学期入学考试化学试题
名校
解题方法
5 . 利用铁元素价类二维图可以多角度研究含铁物质的性质及转化关系;请完成下列问题。
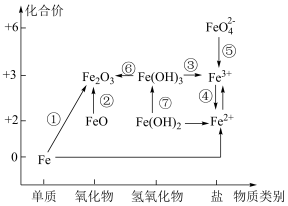
(1)下列说法正确的是______。
(2)检验溶液中是否存在 的试剂是
的试剂是______ 。写出对应的离子方程式_____________________________ 。
(3) 常用作杀菌消毒剂,生产
常用作杀菌消毒剂,生产 的反应原理是:
的反应原理是:
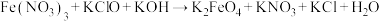 (未配平),则该反应中氧化剂与还原剂的物质的量之比为
(未配平),则该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)电子工业需用30%的 溶液腐蚀敷在绝缘板上的铜制造印刷电路板。写出
溶液腐蚀敷在绝缘板上的铜制造印刷电路板。写出 溶液腐蚀铜的化学反应方程式:
溶液腐蚀铜的化学反应方程式:_________________________________ 。
(5)某中学实验小组设计如下实验探究亚铁盐的性质。
①实验Ⅰ中由白色沉淀生成红褐色沉淀的化学方程式______ 。
②对实验Ⅱ所得白色沉淀展开研究:查阅资料:在溶液中不存在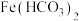
ⅰ取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ⅱ向ⅰ所得溶液中滴入 试剂,溶液几乎不变红;
试剂,溶液几乎不变红;
ⅲ向ⅱ溶液中再滴入少量氯水,溶液立即变为红色。
根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为______ 。
(6)测定补铁剂中铁元素的含量。
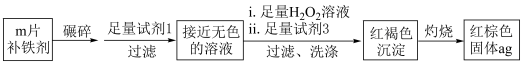
计算每片该补铁剂含铁元素的质量为______ g。

(1)下列说法正确的是______。
A. 是碱性氧化物 是碱性氧化物 |
B. 是一种黑色粉末,不稳定,在空气中受热,能被迅速氧化发生转化② 是一种黑色粉末,不稳定,在空气中受热,能被迅速氧化发生转化② |
C. 不稳定,在加热情况下可实现转化⑥ 不稳定,在加热情况下可实现转化⑥ |
D.硫酸亚铁片和维生素 (具有还原性)同时服用能增强治疗缺铁性贫血的效果 (具有还原性)同时服用能增强治疗缺铁性贫血的效果 |
(2)检验溶液中是否存在
 的试剂是
的试剂是(3)
 常用作杀菌消毒剂,生产
常用作杀菌消毒剂,生产 的反应原理是:
的反应原理是: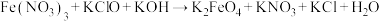 (未配平),则该反应中氧化剂与还原剂的物质的量之比为
(未配平),则该反应中氧化剂与还原剂的物质的量之比为(4)电子工业需用30%的
 溶液腐蚀敷在绝缘板上的铜制造印刷电路板。写出
溶液腐蚀敷在绝缘板上的铜制造印刷电路板。写出 溶液腐蚀铜的化学反应方程式:
溶液腐蚀铜的化学反应方程式:(5)某中学实验小组设计如下实验探究亚铁盐的性质。
实验方案 | 现象 | |
Ⅰ | 1.0mL 0.1mol/L 溶液中滴加1.0mL 0.5mol/L 溶液中滴加1.0mL 0.5mol/L 溶液 溶液 | 生成白色沉淀,后沉淀基本变为红褐色 |
Ⅱ | 1.0mL 0.1mol/L 溶液中滴加1.0mL 0.5mol/L 溶液中滴加1.0mL 0.5mol/L 溶液 溶液 | 生成白色沉淀,后沉淀颜色几乎不变 |
②对实验Ⅱ所得白色沉淀展开研究:查阅资料:在溶液中不存在
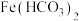
ⅰ取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ⅱ向ⅰ所得溶液中滴入
 试剂,溶液几乎不变红;
试剂,溶液几乎不变红;ⅲ向ⅱ溶液中再滴入少量氯水,溶液立即变为红色。
根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为
(6)测定补铁剂中铁元素的含量。

计算每片该补铁剂含铁元素的质量为
您最近一年使用:0次
2023-12-23更新
|
153次组卷
|
3卷引用:四川省南充高级中学2023-2024学年高一上学期12月月考化学试题
6 . 某小组在验证反应“2Fe3+ + Cu =2Fe2+ + Cu2+”的实验中观察到溶液颜色由棕黄色变为浅绿色,且产生灰白色沉淀。发现和探究过程如下。
实验1中所得溶液的颜色比预期的浅,针对其原因进行探究。
(1)甲认为:实验后,溶液中c (Cu2+)应为0.5 mol/L。“溶液颜色浅”是c (Cu2+)低于0.5 mol/L造成的。 配制含0.5 mol/L CuCl2和____________ mol/L FeCl2混合溶液,观察溶液的颜色。该溶液为蓝绿色,明显比实验所得溶液颜色深,说明_________________________ 。
(2)甲进一步研究认为,“溶液颜色浅”与产生了灰白色固体有关。
甲查阅资料如下,猜想灰白色固体可能含有CuCl。
资料:CuCl是白色固体,不溶于水、硫酸,可溶于氨水。
为探究灰白色固体成分,设计实验方案如下:
a.按方案1进行实验2:
b.加入稀硝酸的目的是___________ ,反应的离子方程式是____________________________________ 。
c.乙认为该方案不严谨,理由是:CuCl具有还原性,被硝酸氧化后的生成物能溶于稀硝酸。
d.按方案2进行实验3:
e.加入稀硫酸时,产生的实验现象是____________ ,说明灰白色固体中含有CuCl。
(3)综合上述实验,说明实验1所得溶液的颜色比预期浅的原因是_____________________________ 。
| 实验过程 | 实验现象 | |
| 实验1 |  | 充分振荡,棕黄色溶液逐渐变浅,最后呈浅绿色,有灰白色固体产生 |
(1)甲认为:实验后,溶液中c (Cu2+)应为0.5 mol/L。“溶液颜色浅”是c (Cu2+)低于0.5 mol/L造成的。 配制含0.5 mol/L CuCl2和
(2)甲进一步研究认为,“溶液颜色浅”与产生了灰白色固体有关。
甲查阅资料如下,猜想灰白色固体可能含有CuCl。
资料:CuCl是白色固体,不溶于水、硫酸,可溶于氨水。
为探究灰白色固体成分,设计实验方案如下:
| 方案1 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入过量稀硝酸,如果有白色固体剩余,则证明有CuCl |
| 方案2 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入浓氨水浸泡,过滤,向滤液中加入稀硫酸 |
b.加入稀硝酸的目的是
c.乙认为该方案不严谨,理由是:CuCl具有还原性,被硝酸氧化后的生成物能溶于稀硝酸。
d.按方案2进行实验3:
e.加入稀硫酸时,产生的实验现象是
(3)综合上述实验,说明实验1所得溶液的颜色比预期浅的原因是
您最近一年使用:0次
2019-01-24更新
|
396次组卷
|
2卷引用:【全国百强校】四川省成都外国语学校2018-2019学年高一下学期入学考试化学试题
7 . 某研究小组查阅资料发现Fe3+与I-的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在Fe3+,并据此设计实验1(如下图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
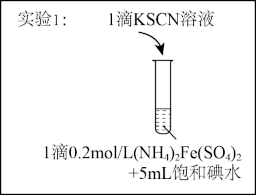
I.初步探究
实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
(1)研究小组同学根据所查阅资料写出的Fe3+与I-反应的离子方程式为____ 。
(2)实验2中,加入石蜡油的目的是____ 。
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是___ 。
II.查阅资料,继续探究
【资料】AgSCN为不溶于水的白色固体。
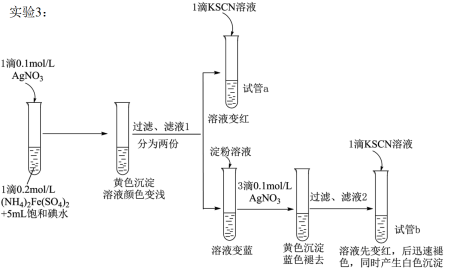
(4)试管a的实验现象说明滤液l中含有____ 。
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是___ 。
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:i.可能是AgNO3氧化了Fe2+;ii.可能是空气中的O2氧化了Fe2+。 他设计、实施了实验4,实验记录如下表。
①试剂a是 ___ 。
②依据实验4,甲同学做出判断:______________________
(7)根据实验1~4所得结论是____ 。

I.初步探究
实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
| 编号 | 饱 和 (NH4)2Fe(SO4)2溶液 | 饱和碘水 | 石蜡油 | 操作 | KSCN溶液 | 现象 |
| 2-1 | 1滴 | 5mL | 1mL | 不加热 | 1滴 | 无明显现象 |
| 2-2 | 1滴 | 5mL | 1mL | 加热一段时间后冷却 | 1滴 | 无明显现象 |
(2)实验2中,加入石蜡油的目的是
(3)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是
II.查阅资料,继续探究
【资料】AgSCN为不溶于水的白色固体。

(4)试管a的实验现象说明滤液l中含有
(5)试管b中,加入KSCN溶液后所产生实验现象的原因是
(6)甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:i.可能是AgNO3氧化了Fe2+;ii.可能是空气中的O2氧化了Fe2+。 他设计、实施了实验4,实验记录如下表。
| 编号 | 实验操作 | 实验现象 |
4 | 在试管中加入1滴0.2mol/L(NH4)2Fe(SO4)2溶液,5mL蒸馏水,1滴试剂a,一段时间后加入1滴KSCN溶液 | 溶液不变红 |
②依据实验4,甲同学做出判断:
(7)根据实验1~4所得结论是
您最近一年使用:0次
2020-05-09更新
|
911次组卷
|
5卷引用:四川省绵阳中学实验学校2021-2022学年高三上学期 ”一诊模拟“化学试题(二)
名校
8 . 与下列实验操作和现象所对应的原理解释均正确的是
| 实验操作 | 现象 | 原理解释 | |
| A | 向ZnS沉淀上滴加适量0.1mol/L 溶液,振荡试管 溶液,振荡试管 | 沉淀变为黑色 |  |
| B | 将乙醇与浓硫酸混合加热产生的气体通入酸性 溶液中 溶液中 | 溶液紫红色褪去 | 乙醇分子内脱水生成乙烯,乙烯具有还原性 |
| C | 向植物油中加入 溶液,加热 溶液,加热 | 溶液不再分层 | 碳酸钠溶液呈碱性: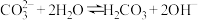 ,油脂在碱性条件下水解 ,油脂在碱性条件下水解 |
| D | 向红热的铁粉与水蒸气反应后的固体中加入稀硫酸酸化,再滴入几滴KSCN溶液 | 溶液未变红 | 铁粉与水蒸气未反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 已知:①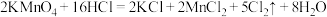 ;②
;② ;③
;③ 。则下列判断不正确的是
。则下列判断不正确的是
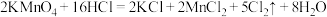 ;②
;② ;③
;③ 。则下列判断不正确的是
。则下列判断不正确的是A.氧化性: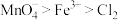 |
B.还原性: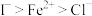 |
C. 只有氧化性, 只有氧化性, 既有氧化性又有还原性 既有氧化性又有还原性 |
D.由信息推测: 反应可以进行 反应可以进行 |
您最近一年使用:0次
2023-10-13更新
|
803次组卷
|
7卷引用:四川省眉山市仁寿县2023-2024学年高一上学期11月期中考试化学试题
10 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向 溶液中滴入硫酸酸化的 溶液中滴入硫酸酸化的 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 |  具有氧化性 具有氧化性 |
| B | 将 缓慢通入酸性 缓慢通入酸性 溶液中,溶液紫红色褪去 溶液中,溶液紫红色褪去 |  具有漂白性 具有漂白性 |
| C | 向盛有 溶液的试管中滴加几滴 溶液的试管中滴加几滴 溶液,振荡,再滴加几滴新制的氯水,观察溶液颜色变化 溶液,振荡,再滴加几滴新制的氯水,观察溶液颜色变化 |  具有还原性 具有还原性 |
| D | 向溶液X中加入 稀溶液,将湿润的红色石蕊试纸置于试管口,试纸未变蓝 稀溶液,将湿润的红色石蕊试纸置于试管口,试纸未变蓝 | 原溶液中不存在 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-06更新
|
249次组卷
|
2卷引用:四川省内江市威远中学校2023-2024学年高一下学期期中考试化学试题



