名校
解题方法
1 . 无水三氯化铁是有机合成的催化剂,为棕黄色固体,易潮解产生白雾,300℃左右时升华。实验室可用氯气与铁反应制备无水三氯化铁,下图是甲组学生设计的制备装置。
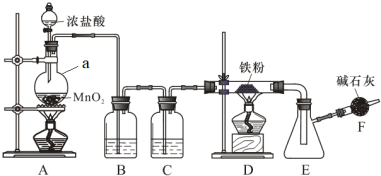
回答下列问题:
(1)仪器a的名称是___________ ;a中反应的离子方程式为___________ 。
(2)装置B的作用是___________ ,C中盛装试剂是___________ 。
(3)当出现什么现象时点燃装置D处酒精灯___________ 。装置D与E之间用粗导管连接,原因是___________ ;
(4)装置F的作用是___________ 。
(5)称取2.8 g该铁屑,最终制得无水三氯化铁6.5 g,则该反应的产率为___________ 。
(6)与甲组设计对比,乙组同学去掉了装置C.实验时无论怎样改变铁粉的用量,装置D中都有少量的黑色固体残留。乙组同学猜测该黑色固体可能是___________ 。
(7)已知氧化性: ,请设计简单实验证明该结论
,请设计简单实验证明该结论___________ 。

回答下列问题:
(1)仪器a的名称是
(2)装置B的作用是
(3)当出现什么现象时点燃装置D处酒精灯
(4)装置F的作用是
(5)称取2.8 g该铁屑,最终制得无水三氯化铁6.5 g,则该反应的产率为
(6)与甲组设计对比,乙组同学去掉了装置C.实验时无论怎样改变铁粉的用量,装置D中都有少量的黑色固体残留。乙组同学猜测该黑色固体可能是
(7)已知氧化性:
 ,请设计简单实验证明该结论
,请设计简单实验证明该结论
您最近一年使用:0次
2024-03-02更新
|
144次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高一下学期开学化学试题
2 . 利用下图可以从不同角度研究含铁元素物质的性质及其转化关系。图中甲~己均含铁元素,横坐标为物质类别,纵坐标为铁元素化合价,回答下列问题:

(1)K2FeO4常用作杀菌消毒剂,从铁元素化合价的角度分析,是因其具有___________ 性(填“氧化”或“还原”)。
(2)甲和碳可以形成合金,将10g此种合金放入氧气中高温灼烧,反应后的气体通入过量石灰水中得到沉淀1.4g。则此合金是___________(填标号)。
(3)若己为饱和氯化物溶液,将其滴入沸水中可得红褐色胶体,用光束照射胶体,可以看见一条光亮的“通路”,此现象称为___________ ,产生这种现象的原因是___________ 。
(4)某小组同学为了获取在制备丙的过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
【进行实验】实验步骤:
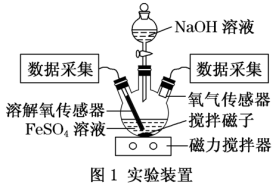
I.向三颈瓶中加入饱和FeSO4溶液,按图1所示连接装置;
II.打开磁力搅拌器,立即加入10%NaOH溶液;
III.采集三颈瓶内空气中O2含量和溶液中O2含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:
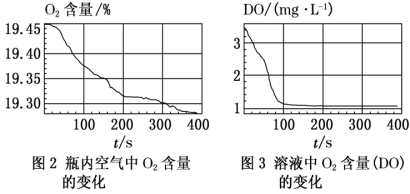
【解释与结论】
①搅拌的目的是___________ 。
②白色沉淀变为红褐色沉淀的化学方程式为___________ 。
③通过上述实验,可得到“在制备丙过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是___________ 。

(1)K2FeO4常用作杀菌消毒剂,从铁元素化合价的角度分析,是因其具有
(2)甲和碳可以形成合金,将10g此种合金放入氧气中高温灼烧,反应后的气体通入过量石灰水中得到沉淀1.4g。则此合金是___________(填标号)。
| A.生铁 | B.高碳钢 | C.中碳钢 | D.低碳钢 |
(4)某小组同学为了获取在制备丙的过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
【进行实验】实验步骤:

I.向三颈瓶中加入饱和FeSO4溶液,按图1所示连接装置;
II.打开磁力搅拌器,立即加入10%NaOH溶液;
III.采集三颈瓶内空气中O2含量和溶液中O2含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:

【解释与结论】
①搅拌的目的是
②白色沉淀变为红褐色沉淀的化学方程式为
③通过上述实验,可得到“在制备丙过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
您最近一年使用:0次
名校
3 . 下列实验方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 比较S与C的非金属性强弱 | 用pH试纸分别测定1 mol/LNa2CO3溶液和1 mol/LNa2SO3溶液的pH | 前者的试纸颜色比后者深,说明非金属性:S>C |
| B | 探究Ag+与Fe3+氧化性的强弱 | 向Fe(NO3)2和KSCN的混合溶液中滴入酸化的AgNO3溶液 | 溶液变红,说明氧化性Ag+>Fe3+ |
| C | 证明溴乙烷与NaOH的乙醇溶液发生消去反应 | 将溴乙烷与NaOH的乙醇溶液共热产生的气体通入酸性KMnO4溶液中 | 溶液褪色,说明发生了消去反应 |
| D | 探究KI与FeCl3 反应的限度 | 取5 mL0.1 mol/LKI溶液于试管中,加入1 mL0.1 mol/LFeCl3溶液,充分反应后滴入5滴15%KSCN溶液 | 溶液变红,则KI与FeCl3的反应 有一定限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 为完成相应实验目的,下列方案设计、现象和结论均正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 探究铁粉在 中燃烧所得固体粉末的成分 中燃烧所得固体粉末的成分 | 取少量固体粉末,加入 蒸馏水,振荡,迅速滴入几滴 蒸馏水,振荡,迅速滴入几滴 溶液 溶液 | 溶液不显红色,说明该固体粉末中不存在 |
| B | 探究 和 和 的酸性强弱 的酸性强弱 | 将 气体通入 气体通入 溶液中 溶液中 | 产生白色沉淀,说明酸性: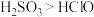 |
| C | 探究温度对化学平衡的影响 | 加热盛有 溶液的试管 溶液的试管 | 加热,溶液变为黄色,冷却后变为蓝色,说明 转化为 转化为 的反应为吸热反应 的反应为吸热反应 |
| D | 检验溴乙烷中含溴元素 | 加热溴乙烷与 的混合液,然后滴加 的混合液,然后滴加 溶液 溶液 | 有沉淀生成,说明溴乙烷中含溴元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 完成下列实验目的所进行的实验操作及现象均正确的是
| 选项 | 实验目的 | 实验操作及现象 |
| A | 鉴别Na2CO3和NaHCO3溶液 | 取少量溶液于试管中,分别滴加Ba(OH)2溶液,有白色沉淀产生的是Na2CO3溶液 |
| B | 探究维生素C的还原性 | 向FeCl3溶液中滴加维生素C溶液,溶液由黄色变为浅绿色 |
| C | 观察K+的焰色 | 将铂丝用稀硫酸洗涤后,在酒精灯上灼烧,然后蘸取待测液,在火焰上灼烧、观察。 |
| D | 验证金属性:Al>Fe | 取等物质的量的Al和Fe,分别与足量的稀盐酸反应,Al产生的H2比Fe多 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 菠菜富含膳食纤维、胡萝卜素、维生素c、维生素e、钙、磷、铁、等矿物质。14~18岁青少年每日合理摄入铁量为20~25mg,某化学小组针对菠菜中含铁量进行如下实验。
(一)实验目的:菠菜含铁量是否满足青少年日常所需
(二)实验方案:取适量新鲜菠菜平均分成三份,实验操作和现象记录如下:
(1)灼烧菠菜时,除了酒精灯还需要下列仪器中的_______ (填选项)。
A. B.
B. C.
C. D.
D. E.
E.
(2)写出实验三中 参与的最主要反应的离子方程式
参与的最主要反应的离子方程式_______ 。
(3)检验试剂KSCN溶液中的 采用
采用_______ 的方法。
(4)由三组实验做出如下推断,其中合理的是:_______(填选项)。
(三)实验数据:菠菜中含铁量的测定,实验步骤如下:
①取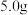 新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
②向灰分中加入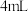 盐酸和
盐酸和 ,浸泡
,浸泡 ,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
③将合并液定容成 待测液,利用分光光度法测得铁的浓度为
待测液,利用分光光度法测得铁的浓度为 。
。
根据上述实验,回答下列问题:
(5)步骤②洗涤烧杯和沉淀的目的是_______ 。
(6)步骤③定容操作若仰视容量瓶刻度线,会造成菠菜样品含铁量测定结果_______ 。(填“偏高”、“偏低”或“无影响”)。
(7)根据实验数据计算菠菜含铁量为_______ 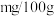 。
。
(四)实验结论:由于菠菜中含有大量草酸( )与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每
)与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每 中含铁量达到
中含铁量达到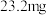 ,且容易被人体吸收。)
,且容易被人体吸收。)
(一)实验目的:菠菜含铁量是否满足青少年日常所需
(二)实验方案:取适量新鲜菠菜平均分成三份,实验操作和现象记录如下:
| 实验 | 操作步骤 | 检验试剂 | 现象 |
| 实验一 | 适量蒸馏水浸泡,过滤,取滤液,加检验试剂后加入适量 ,再次加入检验试剂 ,再次加入检验试剂 | KSCN溶液 | 均无明显现象 |
| 实验二 | 充分灼烧,加适量盐酸浸泡,取滤液,加检验试剂 | KSCN溶液 | 极浅的红色 |
| 实验三 | 充分灼烧,加适量盐酸、 浸泡,取滤液,加检验试剂 浸泡,取滤液,加检验试剂 | KSCN溶液 | 较深的红色 |
A.
 B.
B. C.
C. D.
D. E.
E.
(2)写出实验三中
 参与的最主要反应的离子方程式
参与的最主要反应的离子方程式(3)检验试剂KSCN溶液中的
 采用
采用(4)由三组实验做出如下推断,其中合理的是:_______(填选项)。
| A.菠菜样品中含铁量极低 | B.菠菜中的铁元素很难用蒸馏水直接溶出 |
| C.仅用盐酸无法溶出菠菜灰分中的铁元素 | D.灼烧的目的是将菠菜中的铁元素氧化 |
(三)实验数据:菠菜中含铁量的测定,实验步骤如下:
①取
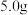 新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。②向灰分中加入
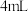 盐酸和
盐酸和 ,浸泡
,浸泡 ,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;③将合并液定容成
 待测液,利用分光光度法测得铁的浓度为
待测液,利用分光光度法测得铁的浓度为 。
。根据上述实验,回答下列问题:
(5)步骤②洗涤烧杯和沉淀的目的是
(6)步骤③定容操作若仰视容量瓶刻度线,会造成菠菜样品含铁量测定结果
(7)根据实验数据计算菠菜含铁量为
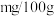 。
。(四)实验结论:由于菠菜中含有大量草酸(
 )与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每
)与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每 中含铁量达到
中含铁量达到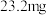 ,且容易被人体吸收。)
,且容易被人体吸收。)
您最近一年使用:0次
2023-03-02更新
|
610次组卷
|
4卷引用:吉林省洮南市第一中学2022-2023学年高一下学期阶段性测试化学试题
名校
7 . 下列各项中操作或现象能达到预期实验目的的是
| 实验目的 | 操作或现象 | |
| A | 分离Fe2O3、Al2O3 | 将混合物置于足量NaOH溶液中,然后依次进行过滤、洗涤、蒸发、灼烧四项操作 |
| B | 验证FeCl3与KI的反应是可逆反应 | 向1ml 0.1mol/L FeCl3溶液中滴加5mL0.1 mol/L KI溶液,充分反应后,取少许混合液滴加KSCN溶液 |
| C | 确定FeCl2是否完全变质 | 取少量的FeCl2样品于试管中,逐滴加入酸性高锰酸钾溶液 |
| D | 除去Fe粉中的I2 | 加热使I2升华 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-02更新
|
560次组卷
|
4卷引用:吉林省吉林市2021届高三上学期第一次调研考试化学试题
吉林省吉林市2021届高三上学期第一次调研考试化学试题吉林省白城市洮南一中2021届高三上学期第三次月考化学试题吉林省长春外国语学校2021届高三上学期期末考试化学试题(已下线)第15单元 实验设计与评价(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷
名校
解题方法
8 . 下列实验过程可以达到实验目的的是
| 编号 | 实验目的 | 实验过程 |
| A | 检验FeCl2溶液中的Fe2+ | 取少量样品溶液于试管,加入少量酸性KMnO4溶液 |
| B | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| C | 制取干燥纯净的氢气 | 向稀盐酸中加入锌粒,将生成的气体依次通过浓硫酸、NaOH溶液,然后收集 |
| D | 探究维生素C的还原性 | 向盛有2mL氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-17更新
|
459次组卷
|
2卷引用:吉林省长春外国语学校2021-2022学年高一上学期第二次月考化学试题
名校
解题方法
9 . 铁元素在地壳中含量居于第四位。铁是目前产量最大,使用最广泛的金属。铁及其化合物在日常生产生活中有着广泛应用。
Ⅰ.铁是人体必需的微量元素之一,当人体贫血时,可以服用含 的补血剂,补铁剂中的
的补血剂,补铁剂中的 在空气中很容易被氧化为
在空气中很容易被氧化为 ,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂搭配维C一起服用效果更好。
,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂搭配维C一起服用效果更好。
[实验操作]第一步:在A、B两支试管中加入对比试剂;
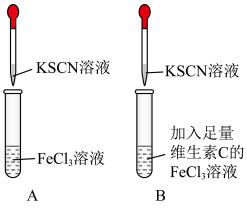
第二步:振荡;
第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变___________ 色,B试管中无明显现象。
[实验结论]
(2)维生素C具有___________ (填“氧化性”或“还原性”),能防止 被氧化为
被氧化为 ,所以补铁剂和维生素C一起服用具有科学依据。
,所以补铁剂和维生素C一起服用具有科学依据。
[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和 ,放入水中立即产生大量气泡(
,放入水中立即产生大量气泡( )使口感更好,说明维生素C具有
)使口感更好,说明维生素C具有___________ (填“酸性”或“碱性”)。
(4)由以上信息可知,为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意___________ (写一条即可)。
Ⅱ.在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,原因是:在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知: 中Fe的化合价为
中Fe的化合价为 价、
价、 价)。
价)。
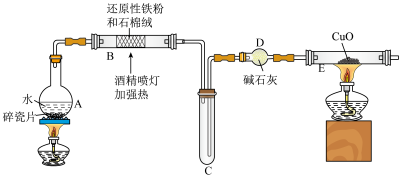
(5)装置B中发生反应的化学方程式为___________ 。
(6)装置C中导管“短进长出”的原因___________ 。
(7)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液若没有出现红色,原因是___________ (用离子方程式表示)。
Ⅰ.铁是人体必需的微量元素之一,当人体贫血时,可以服用含
 的补血剂,补铁剂中的
的补血剂,补铁剂中的 在空气中很容易被氧化为
在空气中很容易被氧化为 ,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂搭配维C一起服用效果更好。
,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂搭配维C一起服用效果更好。[实验操作]第一步:在A、B两支试管中加入对比试剂;

第二步:振荡;
第三步:滴加KSCN溶液。
[实验现象]
(1)A试管中溶液变
[实验结论]
(2)维生素C具有
 被氧化为
被氧化为 ,所以补铁剂和维生素C一起服用具有科学依据。
,所以补铁剂和维生素C一起服用具有科学依据。[生活应用]
(3)某品牌泡腾片的主要成分为维生素C和
 ,放入水中立即产生大量气泡(
,放入水中立即产生大量气泡( )使口感更好,说明维生素C具有
)使口感更好,说明维生素C具有(4)由以上信息可知,为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意
Ⅱ.在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,原因是:在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知:
 中Fe的化合价为
中Fe的化合价为 价、
价、 价)。
价)。
(5)装置B中发生反应的化学方程式为
(6)装置C中导管“短进长出”的原因
(7)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液若没有出现红色,原因是
您最近一年使用:0次
名校
解题方法
10 . 在80~100℃时能产生稳定水蒸气的物质都可以作为铁与水蒸气反应的供水剂,已知铁与水蒸气的反应在500℃左右进行。某化学兴趣小组同学采用西红柿(或洋葱)作为供水剂,设计了如图1所示的装置进行实验,并对铁与水蒸气反应的产物进行检验。
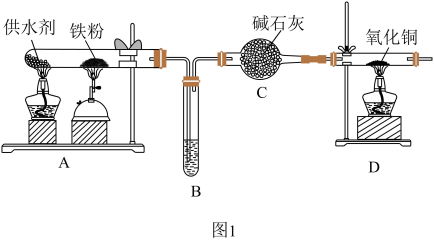
回答下列问题:
(1)A中铁与水蒸气反应的化学方程式是_______ 。在该反应过程中,每生成1摩尔四氧化三铁,转移电子的物质的量为_______
(2)C中碱石灰的作用是_______ 。
(3)上述实验结束后,取出A中反应后的少量固体(经检验固体中没有铁单质)继续进行如图2所示的实验:
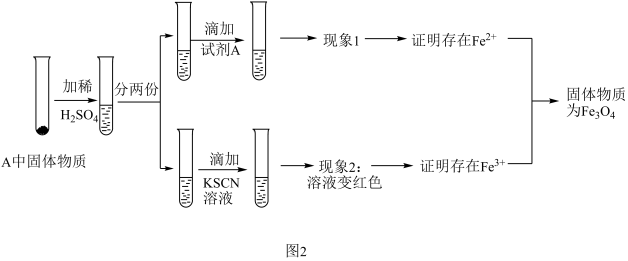
①写出四氧化三铁与稀硫酸发生反应的离子方程式_______ ;
②若试剂A是高锰酸钾溶液,对应的实验现象为_______ 。用离子方程式说明其原理_______

回答下列问题:
(1)A中铁与水蒸气反应的化学方程式是
(2)C中碱石灰的作用是
(3)上述实验结束后,取出A中反应后的少量固体(经检验固体中没有铁单质)继续进行如图2所示的实验:

①写出四氧化三铁与稀硫酸发生反应的离子方程式
②若试剂A是高锰酸钾溶液,对应的实验现象为
您最近一年使用:0次



