名校
解题方法
1 . 某班同学用如下实验探究Fe2+、Fe3+的性质:
(1)甲组同学取2mL0.1mol•L-1FeSO4溶液,加1滴KSCN溶液,无明显现象,再加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。甲组同学通过上述实验分析Fe2+具有______ (填“氧化”或“还原”)性。写出上面划线处操作所发生反应的离子方程式______ 。
(2)针对Fe3++3SCN- Fe(SCN)3,下列说法正确的是
Fe(SCN)3,下列说法正确的是______ 。(不定项)
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和13%H2O2溶液,溶液变红,煤油的作用是______ 。
(4)同时乙组同学查阅资料发现Fe2+与SCN-可发生反应,生成无色的电中性配合物。为证实该性质,乙组同学用FeCO3进行了如图所示的a和b两组实验:
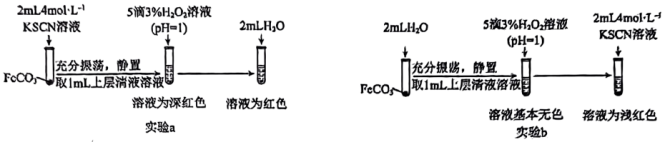
写出实验a中FeCO3与KSCN反应的离子方程式______ ,实验b的目的是______ 。
(5)反应S2O (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
(aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。

①写出反应历程中“速率决定步骤”的热化学方程式:______ 。
②反应过程中由于Fe2+浓度较低而不容易被检测到,请回答Fe2+浓度较低的原因:______ 。
(6)溶液中Fe2+与邻二集非X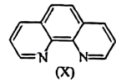 会生成橘黄色的配合物Y。
会生成橘黄色的配合物Y。
①邻二氮菲提供的配位原子是______ 。
②使用该方法时,需要控制pH在2~9之间,其原因为:______ 。
③取2.00mLc(Fe2+)=6.0×10-4mol/L的溶液,加入不同体积、浓度均为c(X)=6.0×10-4mol/L的邻二氮菲溶液,充分反应后加水定容至25mL,得到系列溶液,测其吸光度,结果如表:
已知吸光度A与有色物质的浓度 成正比。Fe2+和邻二氮菲X的吸光度近似为0。
成正比。Fe2+和邻二氮菲X的吸光度近似为0。
Fe2++nX=Y(橘黄色)
结合上面实验数据,通过计算回答Y中Fe2+的配位数(与中心原子或离子以配位键形式结合的配位原子数目):______ 。
(1)甲组同学取2mL0.1mol•L-1FeSO4溶液,加1滴KSCN溶液,无明显现象,再加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。甲组同学通过上述实验分析Fe2+具有
(2)针对Fe3++3SCN-
 Fe(SCN)3,下列说法正确的是
Fe(SCN)3,下列说法正确的是| A.增大KSCN溶液的浓度,平衡常数增大 |
| B.向上述平衡体系中加入适量KCl圆体,平衡不移动 |
| C.加水稀释,平衡向左移动,且溶液的红色变浅 |
D.加入少量铁粉,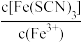 减小 减小 |
(4)同时乙组同学查阅资料发现Fe2+与SCN-可发生反应,生成无色的电中性配合物。为证实该性质,乙组同学用FeCO3进行了如图所示的a和b两组实验:

写出实验a中FeCO3与KSCN反应的离子方程式
(5)反应S2O
 (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
(aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
①写出反应历程中“速率决定步骤”的热化学方程式:
②反应过程中由于Fe2+浓度较低而不容易被检测到,请回答Fe2+浓度较低的原因:
(6)溶液中Fe2+与邻二集非X
 会生成橘黄色的配合物Y。
会生成橘黄色的配合物Y。①邻二氮菲提供的配位原子是
②使用该方法时,需要控制pH在2~9之间,其原因为:
③取2.00mLc(Fe2+)=6.0×10-4mol/L的溶液,加入不同体积、浓度均为c(X)=6.0×10-4mol/L的邻二氮菲溶液,充分反应后加水定容至25mL,得到系列溶液,测其吸光度,结果如表:
| V(X)/mL | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 | 8.00 |
| 吸光度/A | 0.24 | 0.36 | 0.48 | 0.60 | 0.72 | 0.72 |
 成正比。Fe2+和邻二氮菲X的吸光度近似为0。
成正比。Fe2+和邻二氮菲X的吸光度近似为0。Fe2++nX=Y(橘黄色)
结合上面实验数据,通过计算回答Y中Fe2+的配位数(与中心原子或离子以配位键形式结合的配位原子数目):
您最近一年使用:0次
名校
2 . 为确定 和
和 混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入
混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入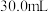 某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。下列说法不正确的是
某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。下列说法不正确的是

 和
和 混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入
混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入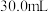 某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。下列说法不正确的是
某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。下列说法不正确的是
A.各组样品均发生反应: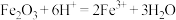 、 、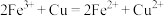 |
B.a、e两组样品分别充分反应后,溶液中一定存在 和 和 ,一定不存在 ,一定不存在 |
C.该混合物中,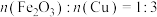 |
D.稀硫酸的浓度为 |
您最近一年使用:0次
2024-02-20更新
|
165次组卷
|
2卷引用:吉林省长春市东北师大附中2023-2024学年高一上学期期末考试化学试题
3 . 高铁酸钾(K2FeO4)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
回答下列问题:
(1)写出①中发生反应的离子方程式:___________ 。
(2)②中加入NaOH固体的目的是___________(填字母序号)。
(3)完成④中反应的离子方程式:___________ ,氧化剂与氧化产物的物质的量之比为___________ ;若反应每生成lmol 转移电子的数目为:
转移电子的数目为:___________ 。
(4)从溶液II中得到K2FeO4晶体的操作是___________ 、洗涤、千燥。
(5)⑥中洗涤时,洗涤剂最好选用___________(填字母序号)。

| 溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
| 稳定性 | 温度为0~5℃或强碱性溶液中能稳定存在;酸性或中性溶液中放出O2 |
(1)写出①中发生反应的离子方程式:
(2)②中加入NaOH固体的目的是___________(填字母序号)。
| A.为后续反应提供碱性环境 |
| B.加入NaOH固体做氧化剂有利于除去NaCl |
| C.NaOH固体溶解时会放出较多的热量,有利于后续生成K2FeO4 |
| D.与溶液I中过量的Cl2继续反应,生成更多的NaClO |
(3)完成④中反应的离子方程式:
 转移电子的数目为:
转移电子的数目为:(4)从溶液II中得到K2FeO4晶体的操作是
(5)⑥中洗涤时,洗涤剂最好选用___________(填字母序号)。
| A.KOH溶液 | B.乙醇 | C.H2O | D.FeCl2溶液 |
您最近一年使用:0次
4 . 三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O(M=491g/mol)是一种感光剂和高效的污水处理剂。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:
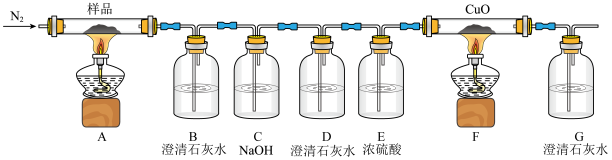
(1)C中NaOH溶液的作用为___________ ;D中澄清石灰水作用为___________ 。
(2)证明有CO产生的现象为___________ 。
(3)该装置还存在的缺陷是___________ 。
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:
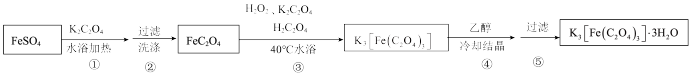
研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为___________ 。
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、 构成;
构成;
乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:___________ 。
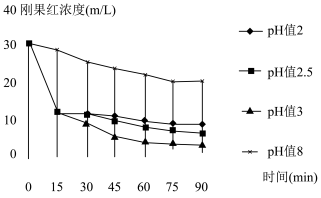
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=___________ 。
(7)关于制备流程,下列说法正确的是___________。
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O
①写出Fe2+与酸性KMnO4溶液反应的离子方程式:___________ 。
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为___________ 。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:

(1)C中NaOH溶液的作用为
(2)证明有CO产生的现象为
(3)该装置还存在的缺陷是
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:

研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、
 构成;
构成;乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=

(7)关于制备流程,下列说法正确的是___________。
| A.步骤①为复分解反应,步骤③为氧化还原反应 |
| B.步骤②判断沉淀是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 |
| C.步骤④,加入乙醇目的在于降低K3[Fe(C2O4)3]的溶解度,使其结晶析出 |
| D.步骤④⑤可以在日光下进行 |
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知
 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O①写出Fe2+与酸性KMnO4溶液反应的离子方程式:
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为
您最近一年使用:0次
5 . 能将分别含有Cu2+、Fe3+、Al3+、Mg2+、 、Na+、Fe2+的七种硫酸盐溶液一次鉴别开来的是
、Na+、Fe2+的七种硫酸盐溶液一次鉴别开来的是
 、Na+、Fe2+的七种硫酸盐溶液一次鉴别开来的是
、Na+、Fe2+的七种硫酸盐溶液一次鉴别开来的是| A.NaOH溶液 | B.KSCN溶液 |
| C.NaHCO3溶液 | D.NH3·H2O溶液 |
您最近一年使用:0次
名校
6 . 已知A、B、C、D为原子序数依次增大的短周期主族元素,A与D同主族,B与C同周期,且C与D的原子序数之和为20。E为地壳中含量最高的过渡元素。甲、乙分别为元素E、A的单质,丙、丁为A、E分别与B形成的二元化合物,它们之间的转化关系如图(反应条件已略去)。下列说法错误的是
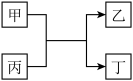

| A.A、B形成的一种化合物具有漂白性 |
| B.D的离子半径小于C的离子半径 |
| C.C的单质能与丙反应置换出B的单质 |
| D.将反应后的固体混合物溶于稀盐酸中,再滴加KSCN溶液,溶液一定呈红色 |
您最近一年使用:0次
2023-05-15更新
|
889次组卷
|
4卷引用: 重庆市第一中学校2022-2023学年高一下学期期中考试化学试题
7 . 下列类比正确的是
| A.根据Fe(OH)3+3HCl=FeCl3+3H2O反应,类比推出Fe(OH)3+3HI=FeI3+3H2O反应 |
| B.NH3与足量盐酸反应生成NH4Cl,则N2H4与足量盐酸反应生成N2H4Cl2 |
| C.CO2通入Ba(NO3)2溶液中无沉淀,则SO2通入Ba(NO3)2溶液中也无沉淀 |
| D.NaCl固体与浓H2SO4 加热可制HCl, 则NaI固体与浓H2SO4 加热制HI |
您最近一年使用:0次
2023-03-16更新
|
928次组卷
|
2卷引用:江苏省海安市实验中学2022-2023学年高一第一次月考化学试题
8 . 某固体粉末X可能含有 、
、 、
、 、Fe、
、Fe、 中的若干种,为确定固体粉末X的成份,取X进行实验,实验过程和现象如图。
中的若干种,为确定固体粉末X的成份,取X进行实验,实验过程和现象如图。
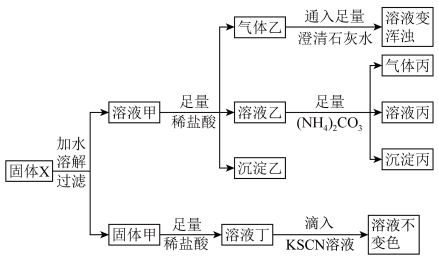
已知:① ;
;
② 。
。
(1)溶液甲中的溶质是_______ (填化学式),产生气体乙的离子方程式为_______ 。
(2)若向澄清石灰水中通入过量的气体乙,发生反应的化学方程式是_______ 。
(3)溶液乙中含有的阳离子除 还有
还有_______ (填离子符号)。
(4)分离溶液丙和沉淀丙需用到的玻璃仪器为_______ 。
(5)某同学根据实验现象猜测固体甲含铁元素的成分错误的是_______ (填标号),理由是_______ 。
①只有Fe ②只有 ③Fe,
③Fe,
 、
、 、
、 、Fe、
、Fe、 中的若干种,为确定固体粉末X的成份,取X进行实验,实验过程和现象如图。
中的若干种,为确定固体粉末X的成份,取X进行实验,实验过程和现象如图。
已知:①
 ;
;②
 。
。(1)溶液甲中的溶质是
(2)若向澄清石灰水中通入过量的气体乙,发生反应的化学方程式是
(3)溶液乙中含有的阳离子除
 还有
还有(4)分离溶液丙和沉淀丙需用到的玻璃仪器为
(5)某同学根据实验现象猜测固体甲含铁元素的成分错误的是
①只有Fe ②只有
 ③Fe,
③Fe,
您最近一年使用:0次
2023-02-15更新
|
293次组卷
|
3卷引用:河北省邢台市2022-2023学年高一上学期教学质量检测化学试题
名校
9 . 同一还原剂与多种氧化剂在一起时,先与氧化性强的粒子反应,待强的反应完后,再与氧化性弱的反应,称为反应先后规律。已知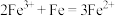 ,且氧化性:
,且氧化性: ,在溶有
,在溶有 和
和 的溶液中加入铁粉,下列说法中正确的是
的溶液中加入铁粉,下列说法中正确的是
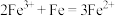 ,且氧化性:
,且氧化性: ,在溶有
,在溶有 和
和 的溶液中加入铁粉,下列说法中正确的是
的溶液中加入铁粉,下列说法中正确的是A.若铁粉无剩余,且溶液中有 ,则溶液中一定无 ,则溶液中一定无 |
B.若铁粉无剩余,且溶液中无 ,则溶液中一定有 ,则溶液中一定有 ,也可能有 ,也可能有 |
| C.若铁粉有剩余,则不溶物中一定有铜 |
D.若铁粉有剩余,则溶液中的金属阳离子有 和 和 |
您最近一年使用:0次
2022-01-16更新
|
1668次组卷
|
6卷引用:河南省南阳市2021-2022学年高一上学期期末考试化学试题
名校
解题方法
10 . 下列实验操作、实验现象、解释或结论都正确且有因果关系的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 向盛有2mL0.1mol∙L-1AgNO3溶液的试管中滴加3mL0.1mol∙L-1NaCl溶液,再向其中滴加一定量0.1mol∙L-1KI溶液 | 先有白色沉淀生成,后又产生黄色沉淀 | 常温下,溶度积:Ksp(AgCl)>Ksp(AgI) |
| B | 常温下,用pH计分别测定1mol∙L-1CH3COONH4溶液和0.1mol∙L-1 CH3COONH4溶液的pH | 测得pH都等于7 | 同温下,不同浓度的CH3COONH4溶液中水的电离程度相同 |
| C | 用铂(Pt)电极电解等浓度的足量Fe(NO3)3、Cu(NO3)2混合溶液 | 阴极有红色固体物质析出 | 金属活动性:Fe>Cu |
| D | 向5mL0.1mol∙L-1FeCl3溶液中滴加3mL0.1mol∙L-1KI溶液,充分反应后,取少量反应后溶液于试管中,再滴入几滴KSCN溶液 | 溶液变红 | KI与FeCl3的反应为可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-12-07更新
|
1072次组卷
|
4卷引用:河北省邢台市第一中学2021-2022学年高二上学期第三次月考化学试题
河北省邢台市第一中学2021-2022学年高二上学期第三次月考化学试题(已下线)第四单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)天津市南开区南开中学2021-2022学年高二上学期期末检测化学试题广东省江门市第一中学2022-2023学年高二上学期第二次月考化学试题



