名校
解题方法
1 .  是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过
是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过 与酸性
与酸性 溶液反应制备,某化学兴趣小组同学设计了如下装置制备
溶液反应制备,某化学兴趣小组同学设计了如下装置制备 并探究其性质。
并探究其性质。

已知:浓硫酸与 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 ,回答下列问题:
,回答下列问题:
(1)A中盛装 固体的仪器名称为
固体的仪器名称为_______ 。
(2)通过装置B中反应制备 ,此反应的离子方程式为
,此反应的离子方程式为_______ 。
(3)欲制备一瓶 ,选择上图中的装置,其接口的连接顺序为a-g-h
,选择上图中的装置,其接口的连接顺序为a-g-h_______ 。
(4)装置D盛放冰水的目的_______ ,装置E的作用是_______ 。
(5)证明 的氧化性比
的氧化性比 强的实验方案是
强的实验方案是_______ 。
(6)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为_______ 克(计算结果保留一位小数)。
 是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过
是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过 与酸性
与酸性 溶液反应制备,某化学兴趣小组同学设计了如下装置制备
溶液反应制备,某化学兴趣小组同学设计了如下装置制备 并探究其性质。
并探究其性质。
已知:浓硫酸与
 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 ,回答下列问题:
,回答下列问题:(1)A中盛装
 固体的仪器名称为
固体的仪器名称为(2)通过装置B中反应制备
 ,此反应的离子方程式为
,此反应的离子方程式为(3)欲制备一瓶
 ,选择上图中的装置,其接口的连接顺序为a-g-h
,选择上图中的装置,其接口的连接顺序为a-g-h(4)装置D盛放冰水的目的
(5)证明
 的氧化性比
的氧化性比 强的实验方案是
强的实验方案是(6)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
2022-12-09更新
|
279次组卷
|
2卷引用:福建省宁德市2022-2023学年高一上学期居家检测化学试题
2 . 硫酸亚铁在印染、医药、化肥等多个行业有广泛应用。某学习小组对硫酸亚铁晶体 的热分解产物进行探究。回答下列问题:
的热分解产物进行探究。回答下列问题:
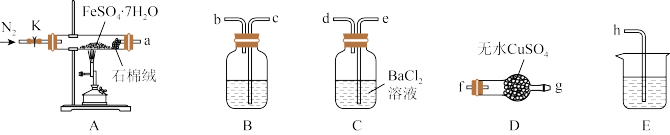
(1)装置A中石棉绒的作用为__________ 。
(2)按气流方向,上述装置合理的连接顺序为a→f、g→_____ →h(填装置口小写字母)。
(3)该小组同学按上述顺序连接各装置并进行实验,请为他们补全表格:
(4)硫酸亚铁晶体分解的化学方程式为_________ 。
(5)设计实验证明A中得到的红色粉末不含+2价铁元素:_______ (简述实验操作及现象)。
 的热分解产物进行探究。回答下列问题:
的热分解产物进行探究。回答下列问题:
(1)装置A中石棉绒的作用为
(2)按气流方向,上述装置合理的连接顺序为a→f、g→
(3)该小组同学按上述顺序连接各装置并进行实验,请为他们补全表格:
| 装置编号 | 填装试剂 | 实验现象 | 实验结论 |
| A | FeSO4·7H2O | 绿色固体逐渐变为红色粉末 | — |
| B | ① | ② | 分解产物中含有SO2 |
| C | BaCl2溶液 | 产生白色沉淀 | ③ |
| D | 无水CuSO4粉末 | 白色固体逐渐变为蓝色 | 分解产物中含有水蒸气 |
| E | ④ | — | — |
(5)设计实验证明A中得到的红色粉末不含+2价铁元素:
您最近一年使用:0次
2022-08-13更新
|
166次组卷
|
2卷引用:福建省福安市第一中学2023届高三上学期第一次检测化学试题
3 . 某研究小组探究铁矿石中铁元素化合价并利用碘盘法测定铁矿石中的铁含量。实验过程如下:
I.探究铁矿石中铁元素化合价
研究小组为探究铁元素化合价,设计实验如图。
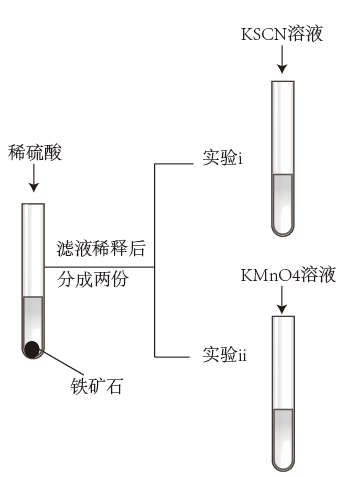
(1)乙同学通过实验得出结论:铁矿石中含+2、+3价铁。实验i的现象为___ 。实验ii反应的离子方程式为___ 。
(2)甲同学认为乙同学的结论不合理,不能判断铁矿石中有+3价铁,理由是___ 。
II.测定铁矿石中的铁含量
步骤1:称取0.3000g试样于容器中,加入无水Na2CO3和过量Na2O2,700℃加热熔融10min,铁元素转化成FeO 。
。
步骤2:将步骤1所得物质放置烧杯中,加入热水、盐酸,并加热煮沸数分钟。补加盐酸,稀释至100mL。
步骤3:将稀释液转至碘量瓶中,加入过量KI溶液,搅拌后放置1-2min,滴入淀粉溶液,用amol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液VmL。
已知:2S2O +I2=S4O
+I2=S4O +2I-,2Cu2++4I-=2CuI↓+I2。
+2I-,2Cu2++4I-=2CuI↓+I2。
(3)以上步骤需要用到下列仪器中的___ (填标号)。
A. B.
B.  C.
C.  D.
D. 
(4)步骤2加热煮沸数分钟的目的是___ 。
(5)步骤3中放置时间不同对铁含量测定结果的影响如表:
铁含量测定结果随放置时间加长而变大的可能原因是___ 。
(6)计算铁矿石试样中铁的含量___ (列计算式)。
(7)测定时,若铁矿石中的铜元素未除去,则铁含量测定结果___ (填“偏高”“偏低”或“无影响")。
I.探究铁矿石中铁元素化合价
研究小组为探究铁元素化合价,设计实验如图。

(1)乙同学通过实验得出结论:铁矿石中含+2、+3价铁。实验i的现象为
(2)甲同学认为乙同学的结论不合理,不能判断铁矿石中有+3价铁,理由是
II.测定铁矿石中的铁含量
步骤1:称取0.3000g试样于容器中,加入无水Na2CO3和过量Na2O2,700℃加热熔融10min,铁元素转化成FeO
 。
。步骤2:将步骤1所得物质放置烧杯中,加入热水、盐酸,并加热煮沸数分钟。补加盐酸,稀释至100mL。
步骤3:将稀释液转至碘量瓶中,加入过量KI溶液,搅拌后放置1-2min,滴入淀粉溶液,用amol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液VmL。
已知:2S2O
 +I2=S4O
+I2=S4O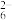 +2I-,2Cu2++4I-=2CuI↓+I2。
+2I-,2Cu2++4I-=2CuI↓+I2。(3)以上步骤需要用到下列仪器中的
A.
 B.
B.  C.
C.  D.
D. 
(4)步骤2加热煮沸数分钟的目的是
(5)步骤3中放置时间不同对铁含量测定结果的影响如表:
| 放置时间/min | 0 | 1 | 3 | 5 | 10 |
| 测定结果/% | 25.88 | 26.83 | 26.83 | 26.97 | 27.10 |
(6)计算铁矿石试样中铁的含量
(7)测定时,若铁矿石中的铜元素未除去,则铁含量测定结果
您最近一年使用:0次
4 . 为探索工业含铝、铁、铜合金废料的再利用,某同学实设计的回收利用方案如图:

(1)气体X的化学式是___ 。
(2)检验滤液D是否含有Fe3+的实验方法为___ 。
(3)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:___ 、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有___ (填序号)
A.蒸发皿 B.石棉网 C.烧杯 D.玻璃棒
(4)写出反应①的离子方程式___ 。
(5)试剂Y应该是一种___ (填“氧化剂”或“还原剂”),它不可能是___ 。
A.H2O2 B.H2S C.O2 D.铁单质
(6)浓硝酸可以溶解铜,也可以溶解上述合金。若固体未完全溶解,则滤液D中Fe元素将以___ (填“Fe3+”或“Fe2+”)离子形式存在。

(1)气体X的化学式是
(2)检验滤液D是否含有Fe3+的实验方法为
(3)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:
A.蒸发皿 B.石棉网 C.烧杯 D.玻璃棒
(4)写出反应①的离子方程式
(5)试剂Y应该是一种
A.H2O2 B.H2S C.O2 D.铁单质
(6)浓硝酸可以溶解铜,也可以溶解上述合金。若固体未完全溶解,则滤液D中Fe元素将以
您最近一年使用:0次
名校
5 . 钒基固溶体合金是一类重要的贮氢材料。某课外小组采用廉价原料 NH4VO3、TiO2和 Fe2O3,制出含VO2+、TiO2+和 Fe3+的金属盐溶液,然后选择氨水作沉淀剂进行共沉淀反应,对共沉淀物[含VO(OH)2、Ti(OH)4、Fe(OH)3]进行煅烧还原制备合金样品。制备共沉淀物的装置如下图:
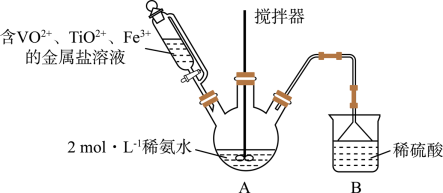
(1)实验中用浓氨水配制500mL2 mol·L-1的稀氨水,需用到的玻璃仪器有烧杯、胶头滴管和___ 、____ 、____ 。
(2)装置B的作用是_________ 。
(3)制备VO2+时,用草酸将VO2+还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为___________ 。
(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是________ 。
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是_______________ 。
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是_______ 。
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol·L-1 酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00 mL。则产品中铁的质量分数为________ 。

(1)实验中用浓氨水配制500mL2 mol·L-1的稀氨水,需用到的玻璃仪器有烧杯、胶头滴管和
(2)装置B的作用是
(3)制备VO2+时,用草酸将VO2+还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol·L-1 酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00 mL。则产品中铁的质量分数为
您最近一年使用:0次
2019-05-08更新
|
430次组卷
|
2卷引用:【市级联考】福建省宁德市2019届高三下学期5月质检理科综合化学试题
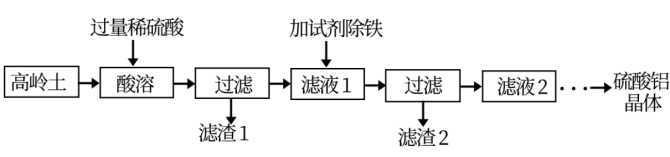
6 . 硫酸铝是一种具有广泛用途的重要化工产品,以高岭土(含SiO2、A12O3、少量Fe2O3等)为原料制备硫酸铝晶体[Al2(SO4)3·18H2O]的实验流程如图所示。
回答以下问题
(1)高岭土需进行粉碎,粉碎的目的是_____________________ 。
(2)滤渣1经过处理可作为制备水玻璃(Na2SiO3水溶液)的原料,写出滤渣1与烧碱溶液反应的化学方程式____________________________________ 。
(3)加入试剂除铁前,滤液1中的阳离子除了Al3+、Fe3+外还有的阳离子是__________ (填离子符号)。滤渣2主要成分为Fe(OH)3,由于条件控制不当,常使Fe(OH)3中混有Al(OH)3影响其回收利用,用离子方程式表示除去A1(OH)3的原理____________________________________________ 。
(4)检验滤液2中是否含有Fe3+的实验方法是(要求写出实验步骤和现象):__________________ 。
(5)要从滤液2获取硫酸铝晶体需要经过多步处理,其中从溶液中得到晶体的方法是__________ (填标号)。
a.蒸发结晶 b.蒸发浓缩、冷却结晶
(6)某兴趣小组为了测定晶体中Al2(SO4)3·18H2O(M=666g·mol-1)的质量分数,进行如下实验:
①准确称取l.00g晶体样品,溶于一定量水中;
②滴入0.100 mol·L-1 EDTA溶液,与Al3+反应所消耗EDTA溶液的体积25.00 mL。 (已知:EDTA与Al3+以物质的量之比1∶1反应,假设杂质不与EDTA反应)则晶体中Al2(SO4)3·18H2O的质量分数是__________ ;若样品中的杂质离子能与EDTA反应,所测定质量分数将会__________ (填“偏高”、“偏低”或“无影响”)。

回答以下问题
(1)高岭土需进行粉碎,粉碎的目的是
(2)滤渣1经过处理可作为制备水玻璃(Na2SiO3水溶液)的原料,写出滤渣1与烧碱溶液反应的化学方程式
(3)加入试剂除铁前,滤液1中的阳离子除了Al3+、Fe3+外还有的阳离子是
(4)检验滤液2中是否含有Fe3+的实验方法是(要求写出实验步骤和现象):
(5)要从滤液2获取硫酸铝晶体需要经过多步处理,其中从溶液中得到晶体的方法是
a.蒸发结晶 b.蒸发浓缩、冷却结晶
(6)某兴趣小组为了测定晶体中Al2(SO4)3·18H2O(M=666g·mol-1)的质量分数,进行如下实验:
①准确称取l.00g晶体样品,溶于一定量水中;
②滴入0.100 mol·L-1 EDTA溶液,与Al3+反应所消耗EDTA溶液的体积25.00 mL。 (已知:EDTA与Al3+以物质的量之比1∶1反应,假设杂质不与EDTA反应)则晶体中Al2(SO4)3·18H2O的质量分数是
您最近一年使用:0次
2017-08-21更新
|
466次组卷
|
2卷引用:福建省宁德市2016-2017学年高一下学期期末质量检测化学试题
7 . 铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。从铝土矿中提炼Al2O3的流程如下:
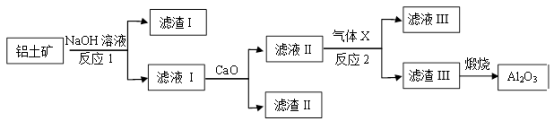
回答下列问题:
(1)写出反应1的化学方程式______________________ 。
(2)滤液Ⅰ中加入CaO生成的沉淀是_________________ ,反应2的离子方程式为_________________ 。
(3)图中多次涉及过滤操作,过滤时需要使用的玻璃仪器除漏斗外还有___________ 。
(4)请写出检验滤渣Ⅰ中含有铁元素的实验方法(要求简要的实验步骤、现象和结论)_____________ 。

回答下列问题:
(1)写出反应1的化学方程式
(2)滤液Ⅰ中加入CaO生成的沉淀是
(3)图中多次涉及过滤操作,过滤时需要使用的玻璃仪器除漏斗外还有
(4)请写出检验滤渣Ⅰ中含有铁元素的实验方法(要求简要的实验步骤、现象和结论)
您最近一年使用:0次



