名校
1 .  的配位化合物较稳定且用运广泛。
的配位化合物较稳定且用运广泛。 可与
可与 、
、 、
、 等配体形成溶液呈浅紫色的
等配体形成溶液呈浅紫色的 、红色的
、红色的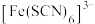 、无色的
、无色的 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: 的溶液中加入KSCN溶液生成蓝色的
的溶液中加入KSCN溶液生成蓝色的 的配离子,
的配离子, 不能与
不能与 形成配位离子。下列说法错误的是
形成配位离子。下列说法错误的是
 的配位化合物较稳定且用运广泛。
的配位化合物较稳定且用运广泛。 可与
可与 、
、 、
、 等配体形成溶液呈浅紫色的
等配体形成溶液呈浅紫色的 、红色的
、红色的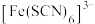 、无色的
、无色的 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: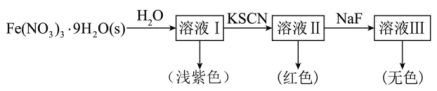
 的溶液中加入KSCN溶液生成蓝色的
的溶液中加入KSCN溶液生成蓝色的 的配离子,
的配离子, 不能与
不能与 形成配位离子。下列说法错误的是
形成配位离子。下列说法错误的是| A.Fe晶体中原子通过金属阳离子和自由电子间的静电作用相结合 |
B.可用NaF和KSCN溶液检验 溶液中是否含有 溶液中是否含有 |
C.溶液Ⅰ中 仅参与形成范德华力和氢键 仅参与形成范德华力和氢键 |
D.上述实验可得出,与 形成配合物的能力: 形成配合物的能力: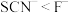 |
您最近一年使用:0次
2024-04-22更新
|
216次组卷
|
3卷引用:福建省宁德市福安市第一中学2023-2024学年高二下学期3月月考化学试题
名校
2 . 下列方程式与所给事实不相符的是
A.用KSCN溶液检验 : :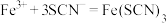 |
B.甲醛使高锰酸钾溶液褪色: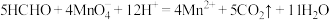 |
C.硫酸铜溶液中加过量氨水: |
D.加热 溶液,溶液变成黄绿色: 溶液,溶液变成黄绿色: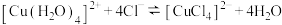  |
您最近一年使用:0次
名校
解题方法
3 . 下列离子在FeCl3溶液中不能大量存在的是
A. | B. | C.H+ | D.I- |
您最近一年使用:0次
2023-09-29更新
|
103次组卷
|
5卷引用:福建省宁德市部分达标学校2023-2024学年高三上学期期中考试化学试题
名校
解题方法
4 .  是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过
是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过 与酸性
与酸性 溶液反应制备,某化学兴趣小组同学设计了如下装置制备
溶液反应制备,某化学兴趣小组同学设计了如下装置制备 并探究其性质。
并探究其性质。

已知:浓硫酸与 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 ,回答下列问题:
,回答下列问题:
(1)A中盛装 固体的仪器名称为
固体的仪器名称为_______ 。
(2)通过装置B中反应制备 ,此反应的离子方程式为
,此反应的离子方程式为_______ 。
(3)欲制备一瓶 ,选择上图中的装置,其接口的连接顺序为a-g-h
,选择上图中的装置,其接口的连接顺序为a-g-h_______ 。
(4)装置D盛放冰水的目的_______ ,装置E的作用是_______ 。
(5)证明 的氧化性比
的氧化性比 强的实验方案是
强的实验方案是_______ 。
(6)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为_______ 克(计算结果保留一位小数)。
 是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过
是一种易溶于水且不与水反应的黄绿色气体,沸点为11℃,具有强氧化性,是一种常用的消毒剂,可用于污水杀菌和饮用水净化,可通过 与酸性
与酸性 溶液反应制备,某化学兴趣小组同学设计了如下装置制备
溶液反应制备,某化学兴趣小组同学设计了如下装置制备 并探究其性质。
并探究其性质。
已知:浓硫酸与
 固体反应可用来制备
固体反应可用来制备 ,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成
,二氧化硫易溶于水,具有还原性,在水溶液中易被氧化成 ,回答下列问题:
,回答下列问题:(1)A中盛装
 固体的仪器名称为
固体的仪器名称为(2)通过装置B中反应制备
 ,此反应的离子方程式为
,此反应的离子方程式为(3)欲制备一瓶
 ,选择上图中的装置,其接口的连接顺序为a-g-h
,选择上图中的装置,其接口的连接顺序为a-g-h(4)装置D盛放冰水的目的
(5)证明
 的氧化性比
的氧化性比 强的实验方案是
强的实验方案是(6)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(还原产物均为氯离子)。
的氧化能力(还原产物均为氯离子)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
2022-12-09更新
|
279次组卷
|
2卷引用:福建省宁德市2022-2023学年高一上学期居家检测化学试题
名校
解题方法
5 . 下列微粒在所给条件下,能大量共存的是
A.滴加KSCN溶液后显红色的溶液中: 、 、 、 、 、 、 |
B.遇酚酞显红色的溶液中: 、 、 、 、 、 、 |
C.澄清透明的酸性溶液中: 、 、 、 、 、 、 |
D.常温下, 的溶液中: 的溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
2022-11-23更新
|
443次组卷
|
3卷引用:福建省宁德第一中学2022-2023学年高一上学期12月月考化学试题
福建省宁德第一中学2022-2023学年高一上学期12月月考化学试题广东省佛山市禅城区2022-2023学年高三统一调研测试(二) 化学试题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(选择题1-5)
6 . 由下列实验操作和现象得出的结论不正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为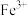 |
| B | 向 中滴加浓盐酸 中滴加浓盐酸 | 产生黄绿色气体 | 氧化性: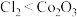 |
| C | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟 | X可能是浓盐酸 |
| D | 将 通入酸性高锰酸钾溶液中 通入酸性高锰酸钾溶液中 | 溶液褪色 |  具有漂白性 具有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-13更新
|
95次组卷
|
3卷引用:福建申宁德市部分达标校中学2022-2023学年高三上学期期中联考化学试题
7 . 硫酸亚铁在印染、医药、化肥等多个行业有广泛应用。某学习小组对硫酸亚铁晶体 的热分解产物进行探究。回答下列问题:
的热分解产物进行探究。回答下列问题:
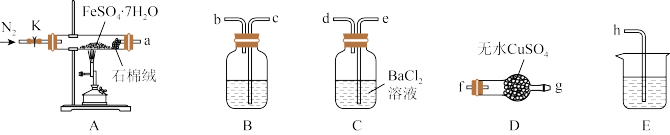
(1)装置A中石棉绒的作用为__________ 。
(2)按气流方向,上述装置合理的连接顺序为a→f、g→_____ →h(填装置口小写字母)。
(3)该小组同学按上述顺序连接各装置并进行实验,请为他们补全表格:
(4)硫酸亚铁晶体分解的化学方程式为_________ 。
(5)设计实验证明A中得到的红色粉末不含+2价铁元素:_______ (简述实验操作及现象)。
 的热分解产物进行探究。回答下列问题:
的热分解产物进行探究。回答下列问题:
(1)装置A中石棉绒的作用为
(2)按气流方向,上述装置合理的连接顺序为a→f、g→
(3)该小组同学按上述顺序连接各装置并进行实验,请为他们补全表格:
| 装置编号 | 填装试剂 | 实验现象 | 实验结论 |
| A | FeSO4·7H2O | 绿色固体逐渐变为红色粉末 | — |
| B | ① | ② | 分解产物中含有SO2 |
| C | BaCl2溶液 | 产生白色沉淀 | ③ |
| D | 无水CuSO4粉末 | 白色固体逐渐变为蓝色 | 分解产物中含有水蒸气 |
| E | ④ | — | — |
(5)设计实验证明A中得到的红色粉末不含+2价铁元素:
您最近一年使用:0次
2022-08-13更新
|
166次组卷
|
2卷引用:福建省福安市第一中学2023届高三上学期第一次检测化学试题
解题方法
8 . 向H2O2溶液中滴加少量FeSO4溶液,溶液迅速变黄,稍后产生气体;再加入KSCN溶液,溶液变红,一段时间后,溶液颜色明显变浅。依据实验现象,下列分析正确 的是
| A.产生气体的原因是FeSO4将H2O2还原生成了O2 |
| B.H2O2溶液与FeSO4溶液反应生成Fe3+的证据是“溶液迅速变黄”和“溶液变红” |
| C.溶液颜色变浅,可能是反应过程生成的水将Fe(SCN)3浓度稀释了 |
D.溶液变红的原因可用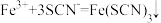 表示 表示 |
您最近一年使用:0次
9 . 以下是高中化学中的常见物质,根据要求完成下列问题:
①钠②过氧化钠③铜④硫酸⑤氯化铁
(1)①~⑤中属于电解质的是____ (填序号)。
(2)实验室中,金属钠着火能用来灭火的是____ (填标号)。
A.二氧化碳B.水C.干沙
(3)将包有少量过氧化钠固体的棉花放在石棉网上,用滴管向棉花上滴几滴水,棉花立刻燃烧起来。产生这一现象的原因是____ (用化学方程式表示)。
(4)铜能溶于热浓硫酸,写出该反应的化学方程式____ 。
(5)能用来检验溶液里含有Fe3+的试剂是____ 。
(6)向沸水中逐滴加入饱和氯化铁溶液,至液体呈透明的红褐色,可制得____ 胶体,判断实验成功的方法是____ 。
①钠②过氧化钠③铜④硫酸⑤氯化铁
(1)①~⑤中属于电解质的是
(2)实验室中,金属钠着火能用来灭火的是
A.二氧化碳B.水C.干沙
(3)将包有少量过氧化钠固体的棉花放在石棉网上,用滴管向棉花上滴几滴水,棉花立刻燃烧起来。产生这一现象的原因是
(4)铜能溶于热浓硫酸,写出该反应的化学方程式
(5)能用来检验溶液里含有Fe3+的试剂是
(6)向沸水中逐滴加入饱和氯化铁溶液,至液体呈透明的红褐色,可制得
您最近一年使用:0次
10 . 某研究小组探究铁矿石中铁元素化合价并利用碘盘法测定铁矿石中的铁含量。实验过程如下:
I.探究铁矿石中铁元素化合价
研究小组为探究铁元素化合价,设计实验如图。
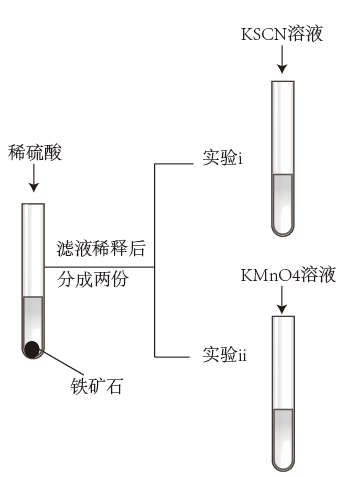
(1)乙同学通过实验得出结论:铁矿石中含+2、+3价铁。实验i的现象为___ 。实验ii反应的离子方程式为___ 。
(2)甲同学认为乙同学的结论不合理,不能判断铁矿石中有+3价铁,理由是___ 。
II.测定铁矿石中的铁含量
步骤1:称取0.3000g试样于容器中,加入无水Na2CO3和过量Na2O2,700℃加热熔融10min,铁元素转化成FeO 。
。
步骤2:将步骤1所得物质放置烧杯中,加入热水、盐酸,并加热煮沸数分钟。补加盐酸,稀释至100mL。
步骤3:将稀释液转至碘量瓶中,加入过量KI溶液,搅拌后放置1-2min,滴入淀粉溶液,用amol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液VmL。
已知:2S2O +I2=S4O
+I2=S4O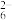 +2I-,2Cu2++4I-=2CuI↓+I2。
+2I-,2Cu2++4I-=2CuI↓+I2。
(3)以上步骤需要用到下列仪器中的___ (填标号)。
A. B.
B.  C.
C. 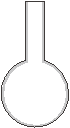 D.
D. 
(4)步骤2加热煮沸数分钟的目的是___ 。
(5)步骤3中放置时间不同对铁含量测定结果的影响如表:
铁含量测定结果随放置时间加长而变大的可能原因是___ 。
(6)计算铁矿石试样中铁的含量___ (列计算式)。
(7)测定时,若铁矿石中的铜元素未除去,则铁含量测定结果___ (填“偏高”“偏低”或“无影响")。
I.探究铁矿石中铁元素化合价
研究小组为探究铁元素化合价,设计实验如图。

(1)乙同学通过实验得出结论:铁矿石中含+2、+3价铁。实验i的现象为
(2)甲同学认为乙同学的结论不合理,不能判断铁矿石中有+3价铁,理由是
II.测定铁矿石中的铁含量
步骤1:称取0.3000g试样于容器中,加入无水Na2CO3和过量Na2O2,700℃加热熔融10min,铁元素转化成FeO
 。
。步骤2:将步骤1所得物质放置烧杯中,加入热水、盐酸,并加热煮沸数分钟。补加盐酸,稀释至100mL。
步骤3:将稀释液转至碘量瓶中,加入过量KI溶液,搅拌后放置1-2min,滴入淀粉溶液,用amol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液VmL。
已知:2S2O
 +I2=S4O
+I2=S4O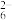 +2I-,2Cu2++4I-=2CuI↓+I2。
+2I-,2Cu2++4I-=2CuI↓+I2。(3)以上步骤需要用到下列仪器中的
A.
 B.
B.  C.
C. 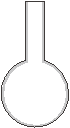 D.
D. 
(4)步骤2加热煮沸数分钟的目的是
(5)步骤3中放置时间不同对铁含量测定结果的影响如表:
| 放置时间/min | 0 | 1 | 3 | 5 | 10 |
| 测定结果/% | 25.88 | 26.83 | 26.83 | 26.97 | 27.10 |
(6)计算铁矿石试样中铁的含量
(7)测定时,若铁矿石中的铜元素未除去,则铁含量测定结果
您最近一年使用:0次



