解题方法
1 . 按题目要求完成以下内容:
(1)取少量FeCl2溶液于试管中,用胶头滴管吸取氢氧化钠溶液深入试管底部并挤出溶液,可观察到的实验现象是__ ,请书写沉淀颜色变化所涉及的化学反应方程式__ 。
(2)要除去氧化铁中的少量氧化铝,适宜的试剂是__ ,反应的离子反应方程式为:__ 。
(3)电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。某同学向两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
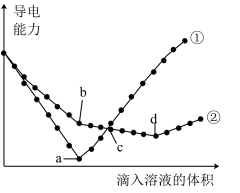
①写出该实验①中的离子方程式___ 。
②bd段对应的离子方程式是__ ;_ 点对应的溶液呈中性(填a、b、c、d);
(1)取少量FeCl2溶液于试管中,用胶头滴管吸取氢氧化钠溶液深入试管底部并挤出溶液,可观察到的实验现象是
(2)要除去氧化铁中的少量氧化铝,适宜的试剂是
(3)电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。某同学向两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。

①写出该实验①中的离子方程式
②bd段对应的离子方程式是
您最近一年使用:0次
2 . 下列物质中,不能由化合反应生成的是
| A.FeCl2 | B.Fe(OH)3 | C.Na2O2 | D.Al(OH)3 |
您最近一年使用:0次
解题方法
3 . 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
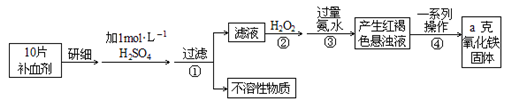
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法______________________ ,该过程的现象为:___________________
(2)步骤②加入过量H2O2的目的(用离子方程式表示):_______________ 。
(3)步骤③中反应的离子方程式:_______________________________________ 。
(4)实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________ 。
(5)步骤④中最终得到a克红棕色粉末,则一系列处理的操作步骤:_________ 、洗涤、_________ 、冷却、称量。
(6)若实验无损耗,则每片补血剂含铁元素的质量__________ g。
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含______________ mgFeSO4·7H2O的片剂。

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法
(2)步骤②加入过量H2O2的目的(用离子方程式表示):
(3)步骤③中反应的离子方程式:
(4)实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,此过程中发生的氧化还原反应为(用化学方程式表达)
(5)步骤④中最终得到a克红棕色粉末,则一系列处理的操作步骤:
(6)若实验无损耗,则每片补血剂含铁元素的质量
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含
您最近一年使用:0次
2017-03-01更新
|
168次组卷
|
2卷引用:辽宁省葫芦岛市六校协作体2016-2017学年高一下学期期初考试化学试题



