1 . 铁及其化合物与生产、生活关系密切:
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
(2) 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式_______ 。向反应后的溶液加入_______ (填名称),可回收Cu,并得到 溶液。
溶液。
(3)用废铁皮制取( )的部分流程示意图如下:
)的部分流程示意图如下:_______ 。
(4) 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为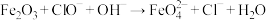 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为_______ 。
(5) 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是_______ 。当该反应转移1.2mol电子时,能产生_______ mol 。
。
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
A. | B. | C. | D. |
(2)
 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式 溶液。
溶液。(3)用废铁皮制取(
 )的部分流程示意图如下:
)的部分流程示意图如下: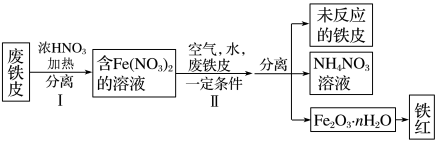
(4)
 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为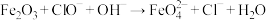 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为(5)
 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是 。
。
您最近半年使用:0次
2024-05-03更新
|
100次组卷
|
2卷引用:福建省晋江市养正中学2023-2024学年高一下学期3月第一次月考化学试题
2 . 健康人体内含铁元素大约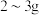 ,人体内铁元素以亚铁离子和三价铁离子的形式存在,
,人体内铁元素以亚铁离子和三价铁离子的形式存在, 易被吸收,所以给贫血者补充铁元素时,应补充含
易被吸收,所以给贫血者补充铁元素时,应补充含 的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中
的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中 的存在,设计并进行了如图实验:
的存在,设计并进行了如图实验:_____ ;试剂2的化学式为_____ 。
(2)加入新制氯水,溶液中发生反应的离子方程式是_____ 。
(3)加入试剂2时溶液为淡红色说明“速力非”中的 已被部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有
已被部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有_____ 性。
(4)不仅溶液中 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式:
氧化,请写出反应的化学方程式:______ 。
(5) 溶液存放时应在试剂瓶中加入
溶液存放时应在试剂瓶中加入______ ,防止 被氧化。
被氧化。
 ,人体内铁元素以亚铁离子和三价铁离子的形式存在,
,人体内铁元素以亚铁离子和三价铁离子的形式存在, 易被吸收,所以给贫血者补充铁元素时,应补充含
易被吸收,所以给贫血者补充铁元素时,应补充含 的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中
的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中 的存在,设计并进行了如图实验:
的存在,设计并进行了如图实验:
(2)加入新制氯水,溶液中发生反应的离子方程式是
(3)加入试剂2时溶液为淡红色说明“速力非”中的
 已被部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有
已被部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有(4)不仅溶液中
 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式:
氧化,请写出反应的化学方程式:(5)
 溶液存放时应在试剂瓶中加入
溶液存放时应在试剂瓶中加入 被氧化。
被氧化。
您最近半年使用:0次
3 . 铁及其化合物在日常生产生活中有着广泛应用。
I.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知:Fe3O4中Fe的化合价为+2价、+3价)。
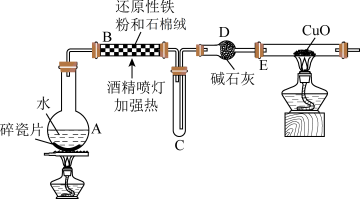
(1)装置B中发生反应的化学方程式为___________ 。
(2)装置C中导管“短进长出”的原因___________ 。
(3)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液没有出现红色,原因是___________ (用离子方程式表示)。
II.某学生设计了如图装置制备白色Fe(OH)2固体。
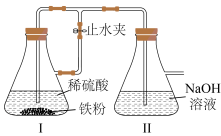
(4)开始实验时,先打开止水夹,待装置中空气已排尽,再关闭止水夹。
①关闭止水夹前,如何证明装置中空气已排尽:___________ 。
②装置II中发生反应的主要化学方程式为___________ 。
③若未排净装置中的空气,则装置II中观察到的实验现象为___________ 。
I.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。现设计如下装置完成高温下“Fe与水蒸气反应”的实验,并检验其产物(已知:Fe3O4中Fe的化合价为+2价、+3价)。

(1)装置B中发生反应的化学方程式为
(2)装置C中导管“短进长出”的原因
(3)取反应后得到的黑色粉末放入一试管中,加入稀硫酸将固体溶解,再滴加几滴KSCN溶液,振荡,溶液没有出现红色,原因是
II.某学生设计了如图装置制备白色Fe(OH)2固体。

(4)开始实验时,先打开止水夹,待装置中空气已排尽,再关闭止水夹。
①关闭止水夹前,如何证明装置中空气已排尽:
②装置II中发生反应的主要化学方程式为
③若未排净装置中的空气,则装置II中观察到的实验现象为
您最近半年使用:0次
名校
解题方法
4 . 某实验小组在实验室进行 Fe(Ⅱ)与 Fe(Ⅲ)相互转化的实验:
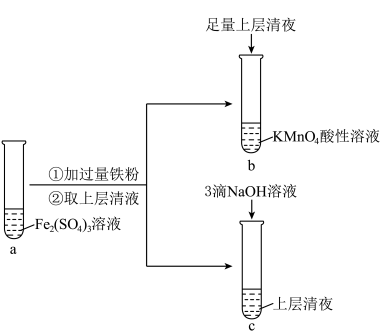
(1)向试管a 中加入过量铁粉的离子方程式是___________ 。
(2)检验试管a 的溶液中含有Fe3+的实验方案为:在试管中加入少量a 中溶液,_________________ (填操作和现象),说明其中含有Fe3+。
(3)试管b 中的实验现象是___________ 。
(4)试管c 中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式___________ 。

(1)向试管a 中加入过量铁粉的离子方程式是
(2)检验试管a 的溶液中含有Fe3+的实验方案为:在试管中加入少量a 中溶液,
(3)试管b 中的实验现象是
(4)试管c 中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式
您最近半年使用:0次
5 . 化学研究源于实验与理论的结合,得益于科学的推断与探究。
(1)一个体重 的健康人含铁
的健康人含铁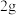 ,这
,这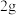 铁在人体中以
铁在人体中以 和
和 的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。
的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。
①服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收,以下为常见铁元素的几种微粒,其中既有氧化性又有还原性的是___________ 。
A. B.
B. C.
C.
②工业盐的主要成分是 ,曾多次发生过因误食
,曾多次发生过因误食 而中毒的事件,其原因是将人体内的
而中毒的事件,其原因是将人体内的 转化为
转化为 而失去了与
而失去了与 结合的能力,这说明
结合的能力,这说明 具有
具有___________ 性。
③工业盐中毒后,可服用维生素C来缓解中毒症状,这说明维生素C具有___________ 性。
(2)常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为: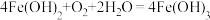 ,该脱氧反应中还原剂是
,该脱氧反应中还原剂是___________ 。
(3)某化学兴趣小组用食品脱氧剂(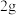 铁粉、
铁粉、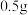 活性炭、
活性炭、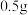 氯化钠)进行如图两个实验。
氯化钠)进行如图两个实验。
实验Ⅰ:

请回答:
①溶液丙中一定含有的金属阳离子是___________ (写离子符号)。
②检验溶液丙中 的方案是
的方案是___________ 。
③实验Ⅱ:将乙烘干后进行如图实验,物质之间的转化关系如图(部分产物路法)
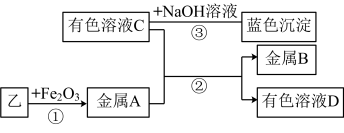
写出反应②的离子方程式___________ ,若反应消耗 金属A,转移电子的数目为
金属A,转移电子的数目为___________ 。
(1)一个体重
 的健康人含铁
的健康人含铁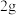 ,这
,这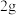 铁在人体中以
铁在人体中以 和
和 的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。
的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。①服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收,以下为常见铁元素的几种微粒,其中既有氧化性又有还原性的是
A.
 B.
B. C.
C.
②工业盐的主要成分是
 ,曾多次发生过因误食
,曾多次发生过因误食 而中毒的事件,其原因是将人体内的
而中毒的事件,其原因是将人体内的 转化为
转化为 而失去了与
而失去了与 结合的能力,这说明
结合的能力,这说明 具有
具有③工业盐中毒后,可服用维生素C来缓解中毒症状,这说明维生素C具有
(2)常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为:
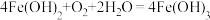 ,该脱氧反应中还原剂是
,该脱氧反应中还原剂是(3)某化学兴趣小组用食品脱氧剂(
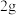 铁粉、
铁粉、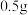 活性炭、
活性炭、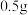 氯化钠)进行如图两个实验。
氯化钠)进行如图两个实验。实验Ⅰ:

请回答:
①溶液丙中一定含有的金属阳离子是
②检验溶液丙中
 的方案是
的方案是③实验Ⅱ:将乙烘干后进行如图实验,物质之间的转化关系如图(部分产物路法)

写出反应②的离子方程式
 金属A,转移电子的数目为
金属A,转移电子的数目为
您最近半年使用:0次
名校
6 . 以化合价为纵坐标,物质类别为横坐标的图像称为价类二维图,在地壳中的含量仅次于铝,居第四位的元素价类二维图如图所示,下列说法错误的是
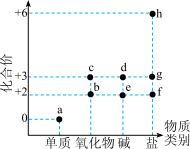

| A.a与水常温下几乎不发生反应,但在高温下可生成c |
| B.e可通过化合反应转化为d |
| C.c的用途之一是做颜料 |
| D.h的某种盐是具备净水和消毒双重功能的水处理剂 |
您最近半年使用:0次
7 . 实验室有一瓶购置时间较长的绿矾(FeSO4·7H2O),老师将其交给化学研究小组检验该药品是否变质。这位同学取绿矾做了简单的检验,得出的结论是:已经开始变质。该同学所用的试剂和判断依据是
选项 | A | B | C | D |
试剂 | 氯水 | 氢氧化钠溶液 | 高锰酸钾溶液 | KSCN溶液 |
现象 | 出现黄褐色 | 先生成白色沉淀,最后转化成红褐色沉淀 | 紫红色褪去 | 有较浅的血红色 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
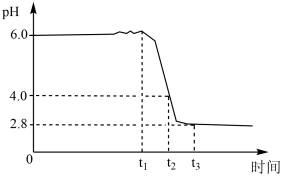
8 . 铁黄 是一种优质颜料。制备铁黄晶种时,向精制
是一种优质颜料。制备铁黄晶种时,向精制 溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至
溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至 时,开始通入空气,溶液
时,开始通入空气,溶液 随时间的变化曲线如图。下列分析不正确的是
随时间的变化曲线如图。下列分析不正确的是
 是一种优质颜料。制备铁黄晶种时,向精制
是一种优质颜料。制备铁黄晶种时,向精制 溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至
溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至 时,开始通入空气,溶液
时,开始通入空气,溶液 随时间的变化曲线如图。下列分析不正确的是
随时间的变化曲线如图。下列分析不正确的是
A.产生白色沉淀的离子方程式为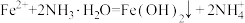 |
B. 发生的主要反应为 发生的主要反应为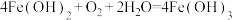 |
C. 发生的主要反应为 发生的主要反应为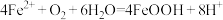 |
D.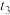 后仅发生反应4Fe2++O2+4H+=4Fe3++2H2O 后仅发生反应4Fe2++O2+4H+=4Fe3++2H2O |
您最近半年使用:0次
2023-02-26更新
|
416次组卷
|
4卷引用:福建省厦门市2022-2023学年高一上学期学业水平测试化学试题
名校
9 . 某实验小组为了探究铁及其化合物的有关性质设计了如下实验:

现象Ⅱ:生成白色沉淀,3min后沉淀基本变为红褐色
现象Ⅲ:生成白色沉淀,3min后沉淀颜色几乎不变
(1)实验I中的现象为_______ ,该现象说明 具有
具有_______ 性,确定滤液A中不含 操作及现象为
操作及现象为_______ 。
(2)用化学方程式表示“现象Ⅱ”中沉淀由白色变为红褐色的原因_______ 。
(3)探究“现象Ⅲ”中白色沉淀的组成:
①查阅资料发现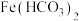 在水中不存在,由此对沉淀的组成作如下假设:
在水中不存在,由此对沉淀的组成作如下假设:
假设a:依据 溶液呈碱性,推测沉淀可能为
溶液呈碱性,推测沉淀可能为_______ ;(填化学式)
假设b:依据 溶液中存在的微粒,推测沉淀还可能为
溶液中存在的微粒,推测沉淀还可能为_______ ;(填化学式)
②验证上述假设的实验过程及现象如下,说明假设_______ 正确。(填“a”或“b”)
ⅰ.将白色沉淀进行充分洗涤后加入稀硫酸,沉淀完全溶解并产生无色气泡;
ⅱ.向ⅰ所得溶液中滴入KSCN试剂,溶液不变红;
ⅲ.向ⅱ所得溶液中再滴入少量新制氯水,溶液立即变为红色。
③实验小组发现,若将白色沉淀在空气中久置,最终也会变为红褐色。
(4)为探究溶液酸碱性对 还原性的影响,对比实验Ⅱ,设计了下图所示实验Ⅳ:
还原性的影响,对比实验Ⅱ,设计了下图所示实验Ⅳ:
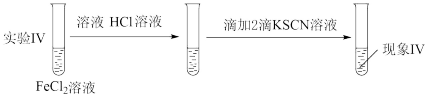
现象Ⅳ:溶液略显红色,3min后溶液颜色没有明显变深
根据实验Ⅰ~Ⅳ,避免 被空气氧化的措施有
被空气氧化的措施有_______ 。(写两条)

现象Ⅱ:生成白色沉淀,3min后沉淀基本变为红褐色
现象Ⅲ:生成白色沉淀,3min后沉淀颜色几乎不变
(1)实验I中的现象为
 具有
具有 操作及现象为
操作及现象为(2)用化学方程式表示“现象Ⅱ”中沉淀由白色变为红褐色的原因
(3)探究“现象Ⅲ”中白色沉淀的组成:
①查阅资料发现
 在水中不存在,由此对沉淀的组成作如下假设:
在水中不存在,由此对沉淀的组成作如下假设:假设a:依据
 溶液呈碱性,推测沉淀可能为
溶液呈碱性,推测沉淀可能为假设b:依据
 溶液中存在的微粒,推测沉淀还可能为
溶液中存在的微粒,推测沉淀还可能为②验证上述假设的实验过程及现象如下,说明假设
ⅰ.将白色沉淀进行充分洗涤后加入稀硫酸,沉淀完全溶解并产生无色气泡;
ⅱ.向ⅰ所得溶液中滴入KSCN试剂,溶液不变红;
ⅲ.向ⅱ所得溶液中再滴入少量新制氯水,溶液立即变为红色。
③实验小组发现,若将白色沉淀在空气中久置,最终也会变为红褐色。
(4)为探究溶液酸碱性对
 还原性的影响,对比实验Ⅱ,设计了下图所示实验Ⅳ:
还原性的影响,对比实验Ⅱ,设计了下图所示实验Ⅳ:
现象Ⅳ:溶液略显红色,3min后溶液颜色没有明显变深
根据实验Ⅰ~Ⅳ,避免
 被空气氧化的措施有
被空气氧化的措施有
您最近半年使用:0次
2023-02-16更新
|
260次组卷
|
2卷引用:福建省龙岩市2022-2023学年高一上学期期末教学质量检测化学试题
10 . 氨气在工农业生产中有重要应用。
(1)①氮气用于工业合成氨,写出氮气的电子式_______ ;
②NH3的稳定性比PH3_______ (填写“强”或“弱”)。
(2)如图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。
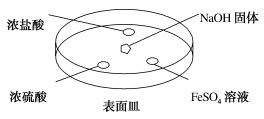
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为_______ 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是_______ (写化学式,一种即可)。
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O=Fe(OH)2↓+2NH 和
和_______ 。
(3)在微生物作用下,蛋白质在水中分解产生的NH3能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为_______ 。当反应中有0.3mol电子发生转移时,生成亚硝酸的质量为_______ g(小数点后保留两位有效数字)。
(1)①氮气用于工业合成氨,写出氮气的电子式
②NH3的稳定性比PH3
(2)如图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。

①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O=Fe(OH)2↓+2NH
 和
和(3)在微生物作用下,蛋白质在水中分解产生的NH3能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为
您最近半年使用:0次



