1 . Fe(OH)2具有较强的还原性,新制的白色Fe(OH)2会逐渐转变为灰绿色,使学生误认为氢氧化亚铁的颜色是灰绿色。为能较长时间观察到白色Fe(OH)2,某实验小组做了如下探究实验。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、___________ 、___________ 。
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是___________ 。
(3)甲同学按如图a所示操作制备Fe(OH)2 (溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:___________ 。___________ (用离子方程式表示)。
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因:___________ 。
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
①由以上实验可得到的规律是___________ 。
②NaHCO3溶液的浓度为1.5 mol/L时,FeSO4溶液的最佳浓度为___________ (填“1.0”“1.5”或“2.0”)mol/L。
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为___________ (任写一条)。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是
(3)甲同学按如图a所示操作制备Fe(OH)2 (溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因:

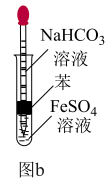
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因:
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
c(NaHCO3)/(mol/L) c(FeSO4)/(mol/L) | 1.0 | 1.5 | 2.0 | |
| 1.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 3.5 min | 9 min | 24 min | |
| 1.5 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速 |
| 稳定时间 | 13 min | 15 min | 22 min | |
| 2.0 | 现象 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 | 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率加快 | 常温下无现象,加热后产生白色沉淀 |
| 稳定时间 | 3 min | 8 min | 30 min | |
②NaHCO3溶液的浓度为1.5 mol/L时,FeSO4溶液的最佳浓度为
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为
您最近半年使用:0次
2024-04-16更新
|
266次组卷
|
2卷引用:2024届青海省百所名校高三下学期二模理科综合试题-高中化学
名校
解题方法
2 . 铁、铝是两种常见的金属,其合金在生产、生活中扮演着重要的角色,对混合物进行如下实验:

(1)操作X是___________ ;
(2)A与Cl2混合光照可能发生爆炸,A在该反应中作___________ (填“氧化剂”或“还原剂”);
(3)合金中加入足量NaOH溶液发生反应的离子方程式___________ ;
(4)加入稀盐酸发生反应的离子方程式为___________ ;
(5)向溶液D中加入NaOH溶液,观察到产生的现象是___________ ,写出相应的化学方程式:___________ ,___________ 。

(1)操作X是
(2)A与Cl2混合光照可能发生爆炸,A在该反应中作
(3)合金中加入足量NaOH溶液发生反应的离子方程式
(4)加入稀盐酸发生反应的离子方程式为
(5)向溶液D中加入NaOH溶液,观察到产生的现象是
您最近半年使用:0次
2024-03-12更新
|
52次组卷
|
2卷引用:青海省西宁市海湖中学2023-2024学年高一下学期开学考试化学试卷
解题方法
3 . 已知物质A~H之间存在如图所示转化关系:
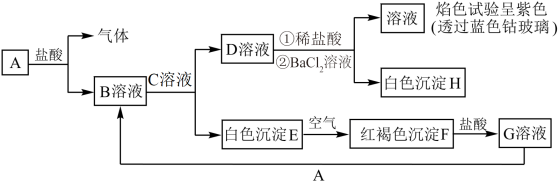
回答下列问题:
(1)D溶液为________ (填化学式)溶液。
(2)检验G溶液中是否含有B溶液中金属阳离子可以用酸性高锰酸钾溶液,写出溶液B中金属阳离子与酸性高锰酸钾溶液反应的离子方程式:________ (已知:酸性条件下高锰酸钾被还原为 )。
)。
(3)G溶液能否用铜制容器盛放,理由是________ 。
(4)白色沉淀E变为红褐色沉淀F时反应的化学方程式为________ 。
(5)下列物质不可以通过化合反应制得的是________ (填字母)。
a.物质B b.物质C c.物质F d.物质G
(6)制备溶液B时一般会加入稍过量的A,其目的是________ 。

回答下列问题:
(1)D溶液为
(2)检验G溶液中是否含有B溶液中金属阳离子可以用酸性高锰酸钾溶液,写出溶液B中金属阳离子与酸性高锰酸钾溶液反应的离子方程式:
 )。
)。(3)G溶液能否用铜制容器盛放,理由是
(4)白色沉淀E变为红褐色沉淀F时反应的化学方程式为
(5)下列物质不可以通过化合反应制得的是
a.物质B b.物质C c.物质F d.物质G
(6)制备溶液B时一般会加入稍过量的A,其目的是
您最近半年使用:0次
解题方法
4 . 某工厂的工业废水中含有大量的 和较多的
和较多的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。请根据以下流程图,回答下列问题。
和金属铜。请根据以下流程图,回答下列问题。
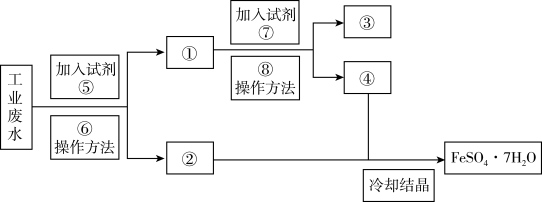
(1)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是___________ ,现象依次是___________ ;请写出该鉴别过程中属于氧化还原反应的离子方程式:___________ 。
(2)若取2mL溶液④加入试管中,然后滴加氢氧化钠溶液,产生的现象是___________ ,此过程涉及反应的化学方程式是___________ 。
 和较多的
和较多的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。请根据以下流程图,回答下列问题。
和金属铜。请根据以下流程图,回答下列问题。
(1)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是
(2)若取2mL溶液④加入试管中,然后滴加氢氧化钠溶液,产生的现象是
您最近半年使用:0次
名校
解题方法
5 . 下列离子的检验方法合理的是
| A.向某溶液中滴入硫氰化钾溶液呈红色,说明不含Fe2+ |
| B.向某溶液中通入氯气,然后再加入硫氰化钾溶液变红色,说明原溶液中含有Fe2+ |
| C.向某溶液中加入氢氧化钠溶液,得红褐色沉淀,说明溶液中含有Fe3+ |
| D.向某溶液中加入氢氧化钠溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |
您最近半年使用:0次
2022-12-20更新
|
480次组卷
|
41卷引用:青海省西宁市第四高级中学2017-2018学年高一上学期第二次月考化学试题1
青海省西宁市第四高级中学2017-2018学年高一上学期第二次月考化学试题1青海省西宁二十一中2017-2018学年高一上学期12月月考化学试题(已下线)2012-2013学年辽宁省实验中学分校高一上学期期末考试化学试卷(已下线)2012-2013年黑龙江哈尔滨第十二中学高一上学期期末考试化学试卷2015-2016学年广东省汕头金山中学高一上期末化学试卷2015-2016学年山西省晋城市高平市特立高中高二下期中文科化学试卷2016-2017学年宁夏育才中学高一上月考二化学卷22016-2017学年江西省景德镇一中高一12月月考化学卷河北省邢台市第一中学2016-2017学年高二下学期第三次月考化学试题宁夏育才中学孔德校区2017-2018学年高一12月月考化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密安徽省滁州市民办高中2018-2019学年高一上学期第三次月考化学试题【市级联考】吉林省公主岭市2018-2019学年高一上学期期末考试化学试题甘肃省武威第十八中学2018-2019学年高一上学期期末考试化学试题贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测辽宁省本溪满族自治县高级中学2019-2020学年高二下学期期末考试化学试题湖北省宜昌市葛洲坝中学2021届高三9月月考化学试题高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 教材帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 教材帮陕西省汉中市洋县第二高级中学2020-2021学年高二上学期11月月考化学试题(已下线)练习13 铁铜的获取和应用-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)江西省南昌市新建一中2020-2021学年高一上学期第二次月考化学试题(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练(已下线)【浙江新东方】双师107专题9 第二单元 探究铁及其化合物的转化-高中化学必修第二册苏教版2019(已下线)【浙江新东方】高中化学20210304-019黑龙江省牡丹江市第三中学2021-2022学年高二上学期第一次月考化学(文)试题陕西省武功县普集高级中学2021-2022学年高一上学期第二次月考化学试题湖北省咸丰春晖学校2022-2023学年高二上学期9月月考化学试题吉林江城中学2021-2022学年高三上学期9月月考化学试题浙江省丽水外国语学校高中部2021-2022学年高一下学期第一次阶段性考试(3月)化学试题山东省济南九中2022-2023学年高一第二次线上质量评估(12月份)化学试题9.2.1反应的合理选择(课中)-2019苏教版必修2课前课中课后第2课时 铁盐和亚铁盐作业(十七) 亚铁盐和铁盐(已下线)课时2 铁的重要化合物河北省高碑店市崇德实验中学2022-2023学年高一下学期期末考试化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷
名校
解题方法
6 . 下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
| A.②③①④ | B.③②①④ | C.③①②④ | D.①②③④ |
您最近半年使用:0次
2022-01-13更新
|
1222次组卷
|
83卷引用:青海省西宁市第四高级中学2017-2018学年高一上学期第二次月考化学试题1
青海省西宁市第四高级中学2017-2018学年高一上学期第二次月考化学试题1【全国百强校】青海省平安县第一高级中学2017-2018学年高一下学期期中考试(A卷)化学试题(已下线)2010年广东省湛江二中高二第二学期期中考试化学(文)试题(已下线)2010年湖南省浏阳一中高一上学期第三次阶段性测试化学卷(已下线)2010—2011学年湖北省沙市中学高一上学期期末考试化学试卷(已下线)2011-2012学年黑龙江省庆安三中高一上学期期末考试化学试卷(已下线)2012-2013学年山东省济宁市汶上一中高一3月质量检测化学试卷(已下线)2012-2013学年广东省佛山市佛山一中高一下学期期中考试化学试卷(已下线)2012-2013学年广东省佛山市佛山一中高一下学期期中考试化学试卷(已下线)2012-2013学年山西省晋中市昔阳中学高二下学期期末考试化学试卷(已下线)2012-2013学年辽宁省铁岭市六校第一次联合考试化学试卷(已下线)2013-2014学年江苏省宿迁市高一上学期第二次月考化学试卷(已下线)2015届甘肃省天水市秦安县二中高三上学期期中考试化学试卷2014-2015黑龙江省哈尔滨六中高一12月月考化学试卷2014-2015湖南省浏阳一中等三校高一12月联考化学试卷2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷14-15内蒙古北方重工业集团三中高一上学期期末化学试卷2014-2015广东省深圳市南山区上学期高一化学期末试卷陕西省咸阳市西藏民族学院附属中学2015-2016学年高一上期末化学卷2015-2016学年广东省肇庆市高一上学期期末考试化学试卷2015-2016学年黑龙江省绥棱一中高二6月月考化学试卷2015-2016学年甘肃省甘谷一中高一上期末化学试卷2017届辽宁省铁岭市高三上学期第一次联考化学试卷2016-2017学年河南省南阳一中高一上月考二化学卷2016-2017学年河南省南阳一中高一月考二化学卷2016-2017学年江西省南昌市第二中学高一上学期期末考试化学试卷2016-2017学年黑龙江省鸡西市第十九中学高一上学期期末考试化学试卷辽宁省大石桥市第二高级中学2016-2017学年高二学业水平模拟测试化学试题湖北省荆州中学2017-2018学年高一12月月考化学试题湖南省醴陵市第一中学2017-2018学年高一上学期第二次月考(12月)化学试题湖北省宜昌市葛洲坝中学2017-2018学年高一12月月考化学试题湖北省宜昌市长阳县第一高级中学2017-2018学年高一12月月考化学试题安徽省淮南市第二中学2017-2018学年高一上学期第二次月考化学试题新疆昌吉市2017-2018学年高一上学期期末考试化学试题天津市红桥区2017-2018学年高一上学期期末考试化学试题宁夏银川一中2017-2018学年高一上学期期末考试化学试题湖北省宜昌市示范高中协作体2017-2018学年高一上学期期末化学试题湖南省师范大学附属中学2017-2018学年高一上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高一化学上学期期末考试题人教版2017-2018学年高一化学必修1:3.2 几种重要的金属化合物 同步测试2【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(文)上学期10月月考化学试题河南省封丘县一中2018-2019学年高一上学期12月月考化学试题河南省信阳市第六高级中学2018-2019学年高一上学期第三次(1月)月考化学试题山西省晋中市平遥县第二中学2018-2019学年高一上学期12月月考化学试题陕西省黄陵中学2018-2019学年高一(普通班)上学期期末考试化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高一上学期期末考试化学试题新疆石河子第二中学2018-2019学年高一上学期期末考试化学试题内蒙古开来中学2018-2019学年高二下学期期末考试化学试题辽宁省实验中学东戴河分校2020届高三上学期期初摸底考试化学试题黑龙江省佳木斯市汤原高级中学2018-2019学年高二下学期期末考试化学试题江西省赣州市会昌中学2019-2020学年高一上学期第二次月考化学试题河北省安平中学2019-2020学年高一上学期第四次月考化学试题山西省晋中市平遥县第二中学2019-2020学年高一12月月考化学试题北京市昌平区新学道临川学校2019-2020学年高一上学期期末考试化学试题福建省泉州第五中学苏教版高中化学必修1专题3 单元综合练习云南省大理市下关第一中学2019-2020学年高一上学期期末考试化学试题安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(二)化学试题四川省南充市阆中中学2020届高三化学选择题专项训练(15)江西省上饶市2019-2020学年高一上学期期末考试 化学(自招班)试题天津市西青区2019-2020学年高一上学期期末考试化学试题(已下线)专题3.2 铁及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》陕西省咸阳市实验中学2019-2020学年高一上学期第三次月考化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第六次综合测试化学试题人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题黑龙江省鸡东县第二中学2020-2021学年高一上学期中考试化学试卷宁夏石嘴山市平罗中学2020-2021学年高一上学期第三次月考化学试题天津市东丽区2020-2021学年高一上学期期末考试化学试题吉林省长春市第二十中学2020-2021学年高一上学期第三次考试化学试题广西南宁市英华学校2020-2021学年高一上学期期末考试化学试题(已下线)专题3.1.3 铁盐与亚铁盐(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)吉林省长春市农安县2021-2022学年高一上学期期末考试化学试题新疆哈密市第八中学2021-2022学年高一上学期期末考试化学试题陕西省西安市阎良区关山中学2021-2022学年高一上学期第三次质量检测化学(理科)试题安徽省宿州市北方中学2021-2022学年高一上学期期末测试化学试题2023年广东省普通高中学业水平合格性考试化学科模拟测试卷(四)2023年广东省普通高中学业水平合格性考试化学科模拟仿真卷(一)天津市新华中学2022-2023学年高一上学期期末考试化学试题 云南省玉溪第一中学2022-2023学年高一下学期期中考试化学试题(已下线)专题九 铁及其化合物(已下线)合格考真题汇编8金属元素及其化合物二云南省大理白族自治州实验中学2020-2021学年高一上学期12月月考化学试题天津北京师范大学静海附属学校2023-2024学年高一上学期第三次月考化学试题
7 . 硫酸亚铁可作水处理剂,以防止水体的富营养化。某研究小组为了测定硫酸亚铁片中 FeSO4的含量,设计实验方案如下(假设硫酸亚铁片中的其它物质不参与反应)∶
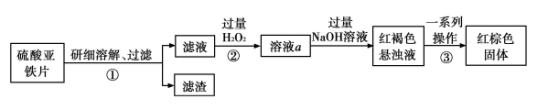
回答下列问题∶
(1)实验最终生成的红棕色固体是___________ (填化学式)。
(2)若向步骤①过滤后的滤液中加入过量的NaOH溶液,会观察到的实验现象是___________ ,该过程中发生的氧化还原反应的化学方程式为___________ 。
(3)步骤②中加入过量 H2O2的目的是___________ 。
(4)实验室检验溶液a中金属阳离子的方法是∶取适量溶液,向其中加入少量的___________ 溶液,若溶液变为___________ 色,则证明含有该阳离子。
(5)步骤③中所需的基本操作有:a.冷却 b.灼烧 c.过滤 d.洗涤,其正确的操作顺序为___________ (填选项序号)。
(6)若20g 硫酸亚铁片最终得到红棕色固体的质量为8g,则硫酸亚铁片中FeSO4的质量百分含量为___________ 。

回答下列问题∶
(1)实验最终生成的红棕色固体是
(2)若向步骤①过滤后的滤液中加入过量的NaOH溶液,会观察到的实验现象是
(3)步骤②中加入过量 H2O2的目的是
(4)实验室检验溶液a中金属阳离子的方法是∶取适量溶液,向其中加入少量的
(5)步骤③中所需的基本操作有:a.冷却 b.灼烧 c.过滤 d.洗涤,其正确的操作顺序为
(6)若20g 硫酸亚铁片最终得到红棕色固体的质量为8g,则硫酸亚铁片中FeSO4的质量百分含量为
您最近半年使用:0次
解题方法
8 . A是日常生活中最常见的金属,其转化关系如图(部分反应物或生成物已略去)。
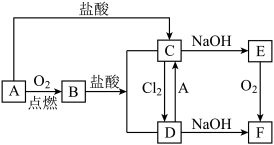
(1)写出 的化学式
的化学式_____________ ;溶液 的颜色是
的颜色是______________ 。
(2)写出下列转化的离子方程式:
① :
:_________________ 。
② :
:__________________ 。
(3) 转化为
转化为 过程中,可观察到白色沉淀迅速变成灰绿色,最后变成红褐色,该反应的化学方程式为:
过程中,可观察到白色沉淀迅速变成灰绿色,最后变成红褐色,该反应的化学方程式为:________________ 。

(1)写出
 的化学式
的化学式 的颜色是
的颜色是(2)写出下列转化的离子方程式:
①
 :
:②
 :
:(3)
 转化为
转化为 过程中,可观察到白色沉淀迅速变成灰绿色,最后变成红褐色,该反应的化学方程式为:
过程中,可观察到白色沉淀迅速变成灰绿色,最后变成红褐色,该反应的化学方程式为:
您最近半年使用:0次
名校
9 . 下列物质不能通过化合反应直接得到的是( )
| A.FeCl2 | B.Fe(OH)3 | C.CuS | D.NaHCO3 |
您最近半年使用:0次



