名校
1 . 已知A常温常压下为无色液体,A为气体时与R反应生成B和E,M、R是两种常见的金属,M是地壳中含量最多的金属元素的单质,T是淡黄色固体,B. C是无色无味的气体,E是具有磁性的黑色晶体,H是红褐色固体。
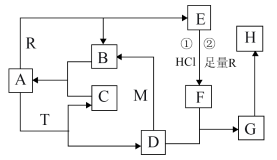
(1)物质T的化学式为___________ 。15.6g T与足量的A反应电子转移数为___________ 个(已知:阿伏伽德罗常数为NA)。
(2)D和M在溶液中反应生成B的离子反应方程式为___________ 。
(3)G在潮湿空气中转化为H的化学方程式为___________ 。
(4)T和F反应只生成C、H和一种盐,其离子反应方程式为_________ 。
(5)若向E和R的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,放出448mL(标准状况)气体,向所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的上述混合物,得到的固体质量为___________ g。

(1)物质T的化学式为
(2)D和M在溶液中反应生成B的离子反应方程式为
(3)G在潮湿空气中转化为H的化学方程式为
(4)T和F反应只生成C、H和一种盐,其离子反应方程式为
(5)若向E和R的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,放出448mL(标准状况)气体,向所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的上述混合物,得到的固体质量为
您最近一年使用:0次
2023-12-15更新
|
411次组卷
|
2卷引用:新疆乌鲁木齐八一中学2023-2024学年高一上学期1月月考化学试卷
解题方法
2 . I.Na2CO3和NaHCO3是厨房中常见的两种盐。回答下列问题:
(1)与酸反应的差异进行鉴别。甲组进行了如图4组实验。
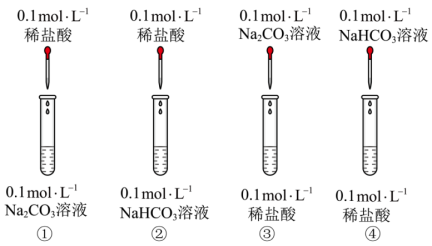
其中实验___________ 和___________ (填实验序号)可以鉴别Na2CO3和NaHCO3。
(2)利用如图实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为___________ 。
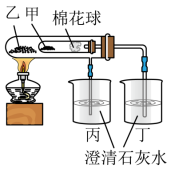
取某碳酸钠和碳酸氢钠混合物2.74g,加热到质量不再变化时,剩余固体的质量为2.12g,则混合物中碳酸钠的质量为___________ 克。
Ⅱ.如图所示,此装置可用来制备Fe(OH)2并验证其还原性,填写下列空白:
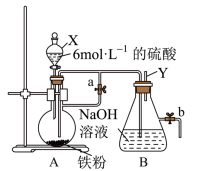
(3)制备Fe(OH)2:
仪器X的名称为___________ ,实验开始时先将止水夹“a”打开,滴入H2SO4和铁粉反应。一段时间后关闭止水夹a,使A中溶液流入B中进行反应。
(4)验证Fe(OH)2还原性:
实验完毕,打开b处止水夹,充入一部分空气,此时B瓶中发生的反应为(写化学方程式)________ ,现象:___________ 。
(5)某同学欲用36.5%浓盐酸(密度1.2g/mL)配制480mL上述实验所需盐酸。
配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果___________ (填写“偏大”、“偏小”、“不变”)。
(1)与酸反应的差异进行鉴别。甲组进行了如图4组实验。

其中实验
(2)利用如图实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为

取某碳酸钠和碳酸氢钠混合物2.74g,加热到质量不再变化时,剩余固体的质量为2.12g,则混合物中碳酸钠的质量为
Ⅱ.如图所示,此装置可用来制备Fe(OH)2并验证其还原性,填写下列空白:

(3)制备Fe(OH)2:
仪器X的名称为
(4)验证Fe(OH)2还原性:
实验完毕,打开b处止水夹,充入一部分空气,此时B瓶中发生的反应为(写化学方程式)
(5)某同学欲用36.5%浓盐酸(密度1.2g/mL)配制480mL上述实验所需盐酸。
配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果
您最近一年使用:0次
解题方法
3 . 已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体M。
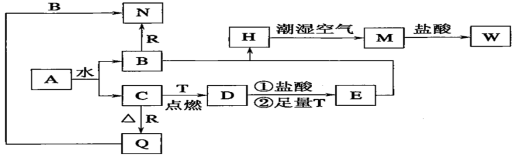
(1)写出下列物质的化学式:A:_______ ,D:_______ ,R:_______ 。
(2)按要求写下列反应方程式:
①H在潮湿空气中变成M的过程中的化学方程式:_______ ;
②B和R反应生成N的离子方程式:_______ ;
③D与盐酸反应的离子方程式:_______ 。

(1)写出下列物质的化学式:A:
(2)按要求写下列反应方程式:
①H在潮湿空气中变成M的过程中的化学方程式:
②B和R反应生成N的离子方程式:
③D与盐酸反应的离子方程式:
您最近一年使用:0次
4 . 已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
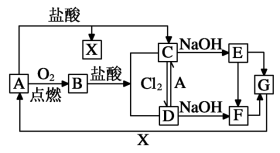
(1)写出X、B、D、F的化学式:X_____ 、B_____ 、D____ 、E_____ 、 G_____ 。
(2)写出A与水反应的化学方程式_____ 。
(3)检验D中阳离子的操作方法__________________________ 。
(4)①写出下列转化的离子方程式D→C:_____ 。
②E转化为F时的现象_____________ ,当有1molF生成时转移电子数为____ 。

(1)写出X、B、D、F的化学式:X
(2)写出A与水反应的化学方程式
(3)检验D中阳离子的操作方法
(4)①写出下列转化的离子方程式D→C:
②E转化为F时的现象
您最近一年使用:0次
名校
5 . 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2被氧化时的颜色变化,实验时必须使用铁屑、6mol/L硫酸,其他试剂任选。回答下列问题:
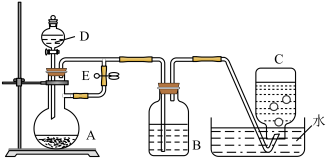
(1)仪器D的名称为________ ,该仪器中需要放入__________ ,装置B中盛有一定量的NaOH溶液,装置A中应预先加入的试剂是______ ,装置A中发生反应的离子方程式为___________ 。
(2)实验开始时应先将止水夹E______ (填“打开”或“关闭”),装置C中收集到的气体主要为______ ;待装置中空气排尽后,将止水夹E______ (填“打开”或“关闭”),此时装置B中可能发生的化学反应是:__________ (用离子方程式表示)。
(3)拔去装置B中的橡胶塞,使空气进入,此时B中发生反应的化学方程式为_________ 。

(1)仪器D的名称为
(2)实验开始时应先将止水夹E
(3)拔去装置B中的橡胶塞,使空气进入,此时B中发生反应的化学方程式为
您最近一年使用:0次
2023-01-11更新
|
130次组卷
|
2卷引用:新疆生产建设兵团第二中学2022-2023学年高一上学期期末考试化学试题
6 . 食盐是日常生活的必需品,也是重要的化工原料。
I.海水中含有大量的NaCl,以及少量的 、
、 、
、 等离子。
等离子。
(1)①为得到纯净的饱和NaCl溶液,进行了如下操作,请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中加入过量氢氧化钡溶液,过滤;
c.向滤液中加入过量_______ 溶液,过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
②步骤b中反应的离子方程式是_______ 。
(2)加入足量的稀盐酸的目的是:_______ 。
II.某透明溶液中可能大量存在 、
、 、
、 、
、 、
、 中的几种离子。
中的几种离子。
(3)取少量原溶液,向其中加入过量NaOH溶液,有白色沉淀生成,迅速变为灰绿色,最后变成红褐色,说明原溶液中肯定存在的离子是_______ ,有关反应的离子方程式为_______ 、_______ 。
(4)检验原溶液中是否存在 的实验方法是
的实验方法是_______ 。
I.海水中含有大量的NaCl,以及少量的
 、
、 、
、 等离子。
等离子。(1)①为得到纯净的饱和NaCl溶液,进行了如下操作,请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中加入过量氢氧化钡溶液,过滤;
c.向滤液中加入过量
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
②步骤b中反应的离子方程式是
(2)加入足量的稀盐酸的目的是:
II.某透明溶液中可能大量存在
 、
、 、
、 、
、 、
、 中的几种离子。
中的几种离子。(3)取少量原溶液,向其中加入过量NaOH溶液,有白色沉淀生成,迅速变为灰绿色,最后变成红褐色,说明原溶液中肯定存在的离子是
(4)检验原溶液中是否存在
 的实验方法是
的实验方法是
您最近一年使用:0次
7 . 部分物质间的转化关系如下图所示(部分物质已省略。已知A→B是实验室制取黄绿色气体的主要方法之一,H的焰色呈黄色,请完成下列填空。
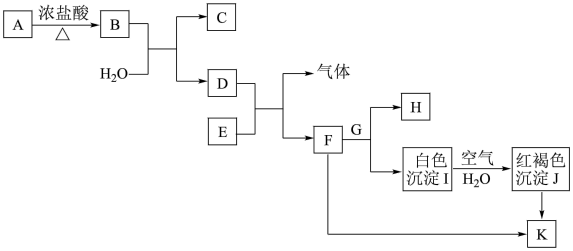
(1)检验F溶液中阳离子的试剂是_______ 。若Cu2+中含有F中阳离子的杂质,应加入_______ (填化学式)除杂。
(2)Ⅰ转化为J的化学方程式为_______ 。
(3)K的饱和溶液滴入沸水中,可得到胶体L。胶体L区别于K的饱和溶液最本质的特征是_______(填字母序号)。
(4)当前,新冠病毒变异毒株奥密克戎来势汹汹,化学消毒剂在疫情防控中起着重要作用。
①目前,很多自来水厂用黄绿色气体来杀菌、消毒。A→B的离子反应方程式为_______ 。
②C可以杀菌、消毒,但不稳定,难以保存,原因是_______ (用化学方程式表示)。
③将B通入G溶液中可得到一种漂白液,能杀菌、消毒,写出相关离子方程式_______ 。
④ClO2为国际公认的高效安全灭菌消毒剂之一、常温下,亚氯酸钠(NaClO2)固体与B反应可得到ClO2和NaCl,该反应中,氧化剂与还原剂的物质的量之比为_______ 。

(1)检验F溶液中阳离子的试剂是
(2)Ⅰ转化为J的化学方程式为
(3)K的饱和溶液滴入沸水中,可得到胶体L。胶体L区别于K的饱和溶液最本质的特征是_______(填字母序号)。
| A.胶体L具有丁达尔效应 | B.胶体L的分散质粒子直径为 |
| C.胶体L是均一的分散系 | D.胶体L比K的饱和溶液颜色深 |
①目前,很多自来水厂用黄绿色气体来杀菌、消毒。A→B的离子反应方程式为
②C可以杀菌、消毒,但不稳定,难以保存,原因是
③将B通入G溶液中可得到一种漂白液,能杀菌、消毒,写出相关离子方程式
④ClO2为国际公认的高效安全灭菌消毒剂之一、常温下,亚氯酸钠(NaClO2)固体与B反应可得到ClO2和NaCl,该反应中,氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
名校
8 . 回答下列问题
(1)下列各图示中,能较长时间观察到Fe(OH)2白色沉淀的是_______ 。

(2)用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入_______ 。
②除去蒸馏水中溶解的O2常采用_______ 的方法。
③生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_______ 。
(3)除去FeCl2溶液中少量的FeCl3,可加入_______ ,反应的离子方程式为_______ 。
(1)下列各图示中,能较长时间观察到Fe(OH)2白色沉淀的是

(2)用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入
②除去蒸馏水中溶解的O2常采用
③生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是
(3)除去FeCl2溶液中少量的FeCl3,可加入
您最近一年使用:0次
名校
解题方法
9 . A、D是生活中常见的金属单质,B、C、E、F、G、H是中学常见的6种化合物,反应①可用于焊接钢轨,相关物质间的关系如下图所示。
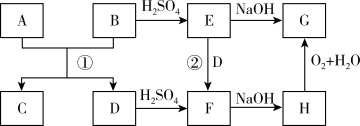
(1)H的化学式是_______ 。
(2)反应①的化学方程式是_______ 。
(3)H转化为G的实验现象是_______ ;化学方程式为:_______
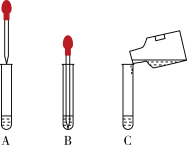
(4)为了更清楚地观察到生成H的现象,使F的溶液与NaOH溶液反应的正确操作是_______ (填下图字母)

(1)H的化学式是
(2)反应①的化学方程式是
(3)H转化为G的实验现象是
(4)为了更清楚地观察到生成H的现象,使F的溶液与NaOH溶液反应的正确操作是

您最近一年使用:0次
2022-04-05更新
|
166次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第一中学2021--2022学年高一上学期期末考试化学试题
10 . 已知A为常见的金属单质,A及其化合物之间有如图所示的转化关系,根据题目要求填空

(1)写出下列物质的化学式
A___________ B___________ F___________
(2)按照要求写出下列反应的方程式
⑤___________ (写出离子反应方程式)⑧___________ (写出化学反应方程式)
(3)写出一种鉴别D溶液中所含的阳离子的鉴别方法___________ 。
(4)写出F受热分解的化学反应方程式___________ 。

(1)写出下列物质的化学式
A
(2)按照要求写出下列反应的方程式
⑤
(3)写出一种鉴别D溶液中所含的阳离子的鉴别方法
(4)写出F受热分解的化学反应方程式
您最近一年使用:0次



