1 . Ⅰ.某小组利用数字化实验模拟制备Fe(OH)2并探究其相关性质。
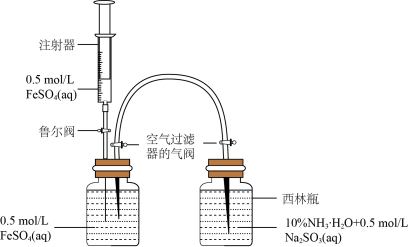
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是_____ ,Na2SO3的作用是_____ 。
(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化, 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。

对比ab、bc段溶解氧的消耗速率,可以得出什么结论_____ 。
(3)已知:在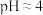 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且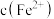 降低量大于
降低量大于 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因_____ ,检验反应后的溶液中是否存在 ,可以选择的试剂是
,可以选择的试剂是_____ 。
A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是_____ 。
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是

(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化,
 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。
对比ab、bc段溶解氧的消耗速率,可以得出什么结论
(3)已知:在
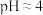 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且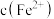 降低量大于
降低量大于 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因 ,可以选择的试剂是
,可以选择的试剂是A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
 |  | 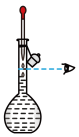 | 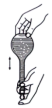 |
| A.称量 | B.转移 | C、定容 | D、摇匀 |
| A.A | B.B | C.C | D.D |
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
您最近一年使用:0次
名校
解题方法
2 . 某工厂的工业废水中含有大量的Fe2(SO4)3和较多的CuSO4。为了减少污染并变废为宝,工厂计划从该废水中回收绿矾和金属铜。请根据以下流程图,回答下列问题:
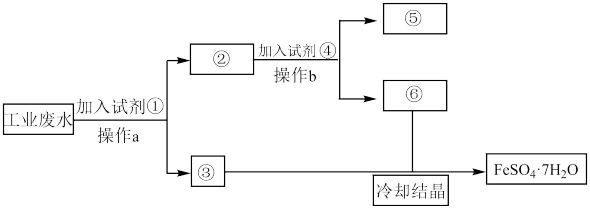
(1)操作a的名称为___________ 。
(2)②中物质为___________ ,试剂④为___________ 。鉴别溶液⑥中的金属阳离子时,应滴加的试剂依次是___________ 。请写出该鉴别过程中属于氧化还原反应的离子方程式___________ 。
(3)若取2mL溶液⑥加入试管中,然后滴加氢氧化钠溶液,产生的现象是___________ 。

(1)操作a的名称为
(2)②中物质为
(3)若取2mL溶液⑥加入试管中,然后滴加氢氧化钠溶液,产生的现象是
您最近一年使用:0次
名校
解题方法
3 . 用 溶液刻蚀铜电路板,对刻蚀后的液体(含
溶液刻蚀铜电路板,对刻蚀后的液体(含 、
、 和
和 )进行处理以提取
)进行处理以提取 和
和 ,流程如图所示:
,流程如图所示:
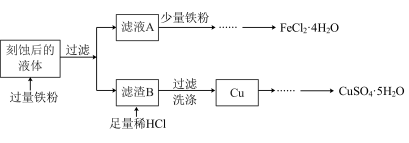
回答下列问题:
(1)氯化铁溶液刻蚀铜电路板的离子方程式为_______ ,过氧化氢和盐酸的混合溶液也可以刻蚀铜电路板,反应的化学方程式为_______ 。
(2)取少量滤液 ,滴入
,滴入 溶液,其现象:生成的白色絮状沉淀迅速变成灰绿色,最终生成
溶液,其现象:生成的白色絮状沉淀迅速变成灰绿色,最终生成_______ 沉淀。白色沉淀转化过程对应的化学方程式为_______ 。
(3)检验刻蚀后液体中 通常选用的试剂为
通常选用的试剂为_______ ,滤渣 的主要成分为
的主要成分为_______ 。
(4)检验滤渣 中提取出的
中提取出的 已经洗净的操作为
已经洗净的操作为_______ 。
 溶液刻蚀铜电路板,对刻蚀后的液体(含
溶液刻蚀铜电路板,对刻蚀后的液体(含 、
、 和
和 )进行处理以提取
)进行处理以提取 和
和 ,流程如图所示:
,流程如图所示:
回答下列问题:
(1)氯化铁溶液刻蚀铜电路板的离子方程式为
(2)取少量滤液
 ,滴入
,滴入 溶液,其现象:生成的白色絮状沉淀迅速变成灰绿色,最终生成
溶液,其现象:生成的白色絮状沉淀迅速变成灰绿色,最终生成(3)检验刻蚀后液体中
 通常选用的试剂为
通常选用的试剂为 的主要成分为
的主要成分为(4)检验滤渣
 中提取出的
中提取出的 已经洗净的操作为
已经洗净的操作为
您最近一年使用:0次
4 . 现有中学化学常见的金属单质A、B、C和气体甲、乙、丙、丁以及物质D、E、F、G、H、X,其中气体乙为黄绿色气体,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
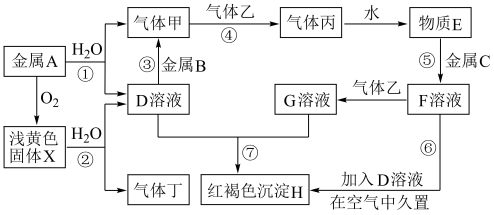
请根据以上信息完成下列各题:
(1)写出反应①的离子方程式:___________ 。
(2)写出反应②的化学方程式:___________ ,该反应的氧化剂是_____ 。
(3)写出反应③的化学方程式:___________ 。
(4)写出反应⑥的化学方程式:___________ 。

请根据以上信息完成下列各题:
(1)写出反应①的离子方程式:
(2)写出反应②的化学方程式:
(3)写出反应③的化学方程式:
(4)写出反应⑥的化学方程式:
您最近一年使用:0次
5 . 某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:
探究一:设计如图所示装置进行“铁与水蒸气反应的实验(夹持仪器略)。
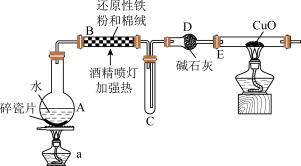
(1)硬质玻璃管B中发生反应的化学方程式为:___________ 。
(2)装置D的作用是___________ 。
探究二:设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分(已知酸性 溶液能与盐酸发生反应)
溶液能与盐酸发生反应)
(3)待硬质玻璃管B冷却后,取少许其中的固体物质继续进行如下实验:
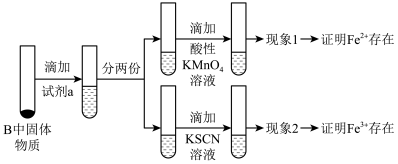
若现象2中溶液未变血红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:___________ 。
探究三:某学生设计了如图装置制备Fe(OH)2固体。
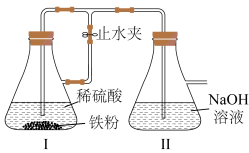
(4)开始实验时,先打开止水夹,待装置中空气已排尽,再关闭止水夹。
①装置Ⅱ中发生反应的主要化学方程式为___________ 。
②若未排净装置中的空气,则装置Ⅱ中观察到的实验现象为___________ ,其中发生的化学反应方程式是___________ 。
探究一:设计如图所示装置进行“铁与水蒸气反应的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为:
(2)装置D的作用是
探究二:设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分(已知酸性
 溶液能与盐酸发生反应)
溶液能与盐酸发生反应)(3)待硬质玻璃管B冷却后,取少许其中的固体物质继续进行如下实验:

若现象2中溶液未变血红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:
探究三:某学生设计了如图装置制备Fe(OH)2固体。

(4)开始实验时,先打开止水夹,待装置中空气已排尽,再关闭止水夹。
①装置Ⅱ中发生反应的主要化学方程式为
②若未排净装置中的空气,则装置Ⅱ中观察到的实验现象为
您最近一年使用:0次
名校
解题方法
6 . 部分铁的化合物“价—类”二维关系如图所示。
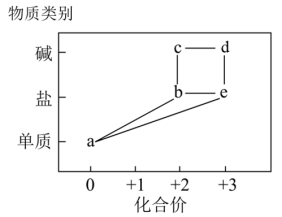
回答下列问题:
(1)c很不稳定,写出c露置在空气中被氧化的化学方程为:___________ ;观察到的现象为:___________ ;下图中___________ (填序号)能较长时间看到c。

(2)硫酸盐b的溶液中含少量硫酸盐e,除去杂质的方法是___________ 。
(3)若在b中加入盐酸,产生无色无味气体,将该气体通入澄清石灰水中,溶液变浑浊。如果在空气中高温灼烧b,可得到红色粉末,写出b在空气中灼烧的化学方程式:___________ 。
(4)工业上,常用一氧化碳在高温下与赤铁矿反应制备a,制备112kga时至少需要___________ LCO(标准状况),该反应中转移电子的物质的量是___________ 。

回答下列问题:
(1)c很不稳定,写出c露置在空气中被氧化的化学方程为:

(2)硫酸盐b的溶液中含少量硫酸盐e,除去杂质的方法是
(3)若在b中加入盐酸,产生无色无味气体,将该气体通入澄清石灰水中,溶液变浑浊。如果在空气中高温灼烧b,可得到红色粉末,写出b在空气中灼烧的化学方程式:
(4)工业上,常用一氧化碳在高温下与赤铁矿反应制备a,制备112kga时至少需要
您最近一年使用:0次
7 . 各物质间的转化关系如图所示,其中A为生活中常见金属单质,根据以下转化关系,回答问题:___________ F(红褐色沉淀)___________ 。
(2)操作1和操作2操作名称是___________ 。
(3)检验G中金属阳离子的试剂为___________ 。
(4)①E转化为红褐色沉淀化学方程式为:___________ 。
②G溶液和A反应的离子方程式为:___________ 。
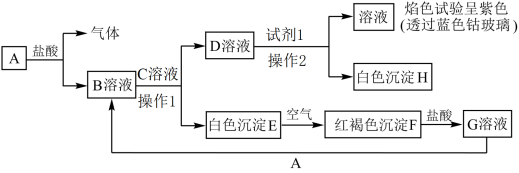
(2)操作1和操作2操作名称是
(3)检验G中金属阳离子的试剂为
(4)①E转化为红褐色沉淀化学方程式为:
②G溶液和A反应的离子方程式为:
您最近一年使用:0次
2023-02-14更新
|
213次组卷
|
3卷引用:江西省宜春市宜丰中学2022-2023学年高一下学期3月月考化学试题
名校
8 . 铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。小组同学利用化学实验进行菠菜中铁元素的检验和铁元素含量测定。
实验1.菠菜中铁元素的检验

(1)操作1的名称是_______ 。
(2)溶液②为浅红色,说明溶液①中含有_______ (填离子符号)。
(3)溶液③中_______ (填实验现象),证明溶液②中还含有 ,其推理过程是
,其推理过程是_______ 。
实验2.测定菠菜中铁元素的含量
i.沉淀法:向实验1滤液①中加入足量NaOH溶液,过滤、洗涤沉淀、加热烘干、称量。
(4)滤液①中加入足量NaOH溶液后生成的沉淀有_______ 、_______ ;在沉淀生成或后续处理过程中,沉淀转化发生的氧化还原 反应为_______ 。
ii.比色法:利用色度传感器测定其对光的透过率或者吸收率,颜色越深,吸收率越高。
测得不同浓度 的标准液吸收率如下图。
的标准液吸收率如下图。

(5) 菠菜处理后得到溶液(3)
菠菜处理后得到溶液(3) ,色度传感器测得吸收率为上图中a点,则
,色度传感器测得吸收率为上图中a点,则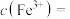
_______  ,
, 菠菜中含铁
菠菜中含铁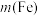 =
=_______ g。
实验1.菠菜中铁元素的检验

(1)操作1的名称是
(2)溶液②为浅红色,说明溶液①中含有
(3)溶液③中
 ,其推理过程是
,其推理过程是实验2.测定菠菜中铁元素的含量
i.沉淀法:向实验1滤液①中加入足量NaOH溶液,过滤、洗涤沉淀、加热烘干、称量。
(4)滤液①中加入足量NaOH溶液后生成的沉淀有
ii.比色法:利用色度传感器测定其对光的透过率或者吸收率,颜色越深,吸收率越高。
测得不同浓度
 的标准液吸收率如下图。
的标准液吸收率如下图。
(5)
 菠菜处理后得到溶液(3)
菠菜处理后得到溶液(3) ,色度传感器测得吸收率为上图中a点,则
,色度传感器测得吸收率为上图中a点,则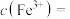
 ,
, 菠菜中含铁
菠菜中含铁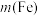 =
=
您最近一年使用:0次
2023-01-05更新
|
244次组卷
|
2卷引用:江西省萍乡市2022-2023学年高一上学期期末考试化学试题
解题方法
9 . Ⅰ.碳酸亚铁在空气中灼烧得到铁的氧化物A和一种气体。某学习小组为了探究该氧化物A的组成设计如下实验方案:
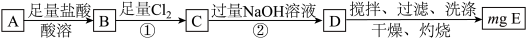
(1)若该方案中①通入 不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,他的依据是
不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,他的依据是_______ (用化学方程式表示)。
(2)若氧化物A的质量是7.84g,E的质量为8.00g,根据数据计算化合物A的化学式为_______ 。
Ⅱ.高铁酸钾( )是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知
)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知 在
在 催化下会分解,在强碱性条件下稳定。高铁酸钾(
催化下会分解,在强碱性条件下稳定。高铁酸钾( )生产流程如下:
)生产流程如下:
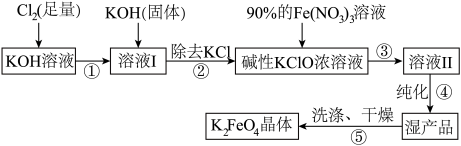
(3)在溶液Ⅰ中加入KOH固体的目的是_______。
(4)写出③反应的离子方程式_______ 。
(5)制备 时,将90%的
时,将90%的 溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是
溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是_______ 。
(6) 在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为
在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为_______ (写出化学式)。
(7) 净水时能吸附悬浮物的原因是
净水时能吸附悬浮物的原因是_______ 。
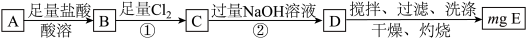
(1)若该方案中①通入
 不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,他的依据是
不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,他的依据是(2)若氧化物A的质量是7.84g,E的质量为8.00g,根据数据计算化合物A的化学式为
Ⅱ.高铁酸钾(
 )是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知
)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知 在
在 催化下会分解,在强碱性条件下稳定。高铁酸钾(
催化下会分解,在强碱性条件下稳定。高铁酸钾( )生产流程如下:
)生产流程如下:
(3)在溶液Ⅰ中加入KOH固体的目的是_______。
A.与溶液Ⅰ中过量的 继续反应,生成更多的KClO 继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高KClO产率 |
| C.为下一步反应提供碱性的环境 |
D.使 转化为KClO 转化为KClO |
(5)制备
 时,将90%的
时,将90%的 溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是
溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是(6)
 在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为
在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为(7)
 净水时能吸附悬浮物的原因是
净水时能吸附悬浮物的原因是
您最近一年使用:0次
2023-01-04更新
|
512次组卷
|
3卷引用:江西省宜春市丰城市第九中学2023-2024学年高一上学期期末考试化学试题
名校
10 . A、B、C、D、X、Y六种物质之间有如图所示转化关系,请回答下列问题。
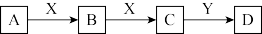
(1)若X是非金属单质O2,Y是H2O。
①当A为单质,则A不可能是___________ (填序号)。
a.Na b.Fe c.S d.N2
②当A为非金属氢化物,B是汽车尾气之一,遇空气变红棕色,则A→B的化学方程式为___________ ;将32 g铜与200 mL一定浓度的D溶液发生反应,铜完全溶解,产生B和C混合气体的体积为11.2L(标准状况),待产生的气体全部释放后,向溶液中加入500 mL 3.0 mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原D溶液的物质的量浓度为___________ mol/L。
(2)若X是金属单质Fe,Y是苛性钠,A在常温下是一种黄绿色气体,则A与C反应生成B的离子方程式为___________ ;向C溶液中加入Y溶液,可观察到的现象是___________ ;B溶液常用于蚀刻印刷电路铜板,若将该反应设计成原电池,负极电极反应式为___________ 。
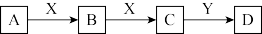
(1)若X是非金属单质O2,Y是H2O。
①当A为单质,则A不可能是
a.Na b.Fe c.S d.N2
②当A为非金属氢化物,B是汽车尾气之一,遇空气变红棕色,则A→B的化学方程式为
(2)若X是金属单质Fe,Y是苛性钠,A在常温下是一种黄绿色气体,则A与C反应生成B的离子方程式为
您最近一年使用:0次



