名校
1 . 氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

(1)写出溶解过程中发生的氧化还原反应的离子方程式:_________
(2)还原过程中发生的主要反应的离子方程式:_________ 。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是__________ 。
(4)写出氯化亚铜在空气中被氧化的化学方程式________
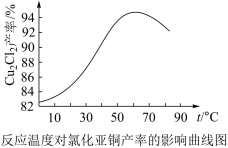
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃时,CuCl产率会下降,其原因可能是___ 。
(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:____

(1)写出溶解过程中发生的氧化还原反应的离子方程式:
(2)还原过程中发生的主要反应的离子方程式:
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是
(4)写出氯化亚铜在空气中被氧化的化学方程式
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃时,CuCl产率会下降,其原因可能是

(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:
您最近一年使用:0次
2019-06-12更新
|
1147次组卷
|
2卷引用:湖北省黄冈中学2019届高三6月适应性考试(最后一卷)理综化学试题
2019·全国·三模
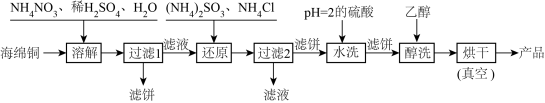
2 . CuCl广泛用于颜料、电镀和有机合成等方面。已知:CuCl在干燥空气中稳定,受潮则易变蓝到棕色,露置在空气中迅速氧化成碱式盐,呈绿色,化学反应为:4CuCl+O2+2H2O=4Cu(OH)Cl。CuCl在水中水解:CuCl+H2O CuOH+HCl,2CuOH=Cu2O+H2O。工业上,常以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化法制备CuCl,其工艺流程如下:
CuOH+HCl,2CuOH=Cu2O+H2O。工业上,常以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化法制备CuCl,其工艺流程如下:
请回答下列问题:
(1)为了提高“溶解”速率,工业生产中宜采用的措施有____________ (答两条即可)。
(2)写出“溶解”过程中属于氧化还原反应的离子方程式:_________ 。
(3)“过滤2”所得滤液经蒸发浓缩、降温结晶、过滤等操作获得一种化学肥料,它的主要成分是________ (填化学式)。写出“还原”过程中的化学方程式:_________ 。
(4)工业生产中,用pH=2的硫酸洗涤“产品”,其目的是_________ ;用乙醇洗涤的优点是________________ 。
(5)探究(NH4)2SO3、NH4Cl与Cu2+的相对用量和Cu2+沉淀率的关系如图1和图2所示。
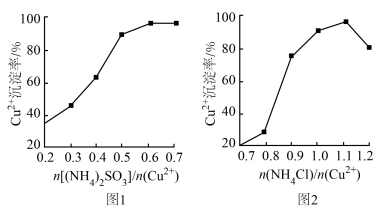
由实验表明,投料比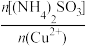 、
、 的最佳值分为
的最佳值分为______ 、_____ 。
(6)已知:现有x t工业海绵铜(铜元素的质量分数为w)经上述流程,最终得到y t CuCl产品。则CuCl的产率为____________ (用代数式表示)。
 CuOH+HCl,2CuOH=Cu2O+H2O。工业上,常以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化法制备CuCl,其工艺流程如下:
CuOH+HCl,2CuOH=Cu2O+H2O。工业上,常以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化法制备CuCl,其工艺流程如下:
请回答下列问题:
(1)为了提高“溶解”速率,工业生产中宜采用的措施有
(2)写出“溶解”过程中属于氧化还原反应的离子方程式:
(3)“过滤2”所得滤液经蒸发浓缩、降温结晶、过滤等操作获得一种化学肥料,它的主要成分是
(4)工业生产中,用pH=2的硫酸洗涤“产品”,其目的是
(5)探究(NH4)2SO3、NH4Cl与Cu2+的相对用量和Cu2+沉淀率的关系如图1和图2所示。

由实验表明,投料比
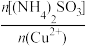 、
、 的最佳值分为
的最佳值分为(6)已知:现有x t工业海绵铜(铜元素的质量分数为w)经上述流程,最终得到y t CuCl产品。则CuCl的产率为
您最近一年使用:0次
名校
3 . 我国宋代沈括在《梦溪笔谈》中记载:信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。熬胆矾铁釜,久之亦化为铜”。某化学兴趣小组为探究胆矾(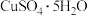 )的热分解产物,设计如图所示装置进行实验:
)的热分解产物,设计如图所示装置进行实验:

已知: 的熔点为16.8℃,沸点为46.8℃;
的熔点为16.8℃,沸点为46.8℃; 的熔点为-72℃,沸点为-10℃.
的熔点为-72℃,沸点为-10℃.
请回答下列问题:
(1)仪器a的名称是____ ,a中的棒香能复燃,说明热分解产物含有_____ (填化学式)。
(2)A中固体由蓝色变为黑色,B中的现象是____ 。
(3)C中冰水的作用是_____ 。
(4)D中品红溶液褪色,E中有 、
、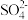 生成,写出E中生成
生成,写出E中生成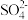 的总的离子方程式:
的总的离子方程式:____ 。
(5)若生成 和
和 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为_____ 。
(6)小组同学用滴定法测定某胆矾样品中 的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(
的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(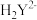 )标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应:
)标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应: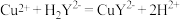 )。
)。
①样品中 的质量分数为
的质量分数为____ %(用含m、V的代数式表示)。
②下列操作会导致 含量的测定结果偏高的是
含量的测定结果偏高的是____ (填选项字母)。
a.未润洗锥形瓶
b.滴定终点时仰视读数
c.滴定终点时滴定管尖嘴中有气泡
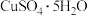 )的热分解产物,设计如图所示装置进行实验:
)的热分解产物,设计如图所示装置进行实验:
已知:
 的熔点为16.8℃,沸点为46.8℃;
的熔点为16.8℃,沸点为46.8℃; 的熔点为-72℃,沸点为-10℃.
的熔点为-72℃,沸点为-10℃.请回答下列问题:
(1)仪器a的名称是
(2)A中固体由蓝色变为黑色,B中的现象是
(3)C中冰水的作用是
(4)D中品红溶液褪色,E中有
 、
、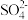 生成,写出E中生成
生成,写出E中生成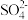 的总的离子方程式:
的总的离子方程式:(5)若生成
 和
和 的物质的量之比为1:1,则胆矾热分解的化学方程式为
的物质的量之比为1:1,则胆矾热分解的化学方程式为(6)小组同学用滴定法测定某胆矾样品中
 的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(
的含量,取mg样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用0.1000mol/L的EDTA(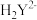 )标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应:
)标准溶液滴定至终点,平均消耗EDTA溶液VmL(滴定反应: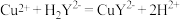 )。
)。①样品中
 的质量分数为
的质量分数为②下列操作会导致
 含量的测定结果偏高的是
含量的测定结果偏高的是a.未润洗锥形瓶
b.滴定终点时仰视读数
c.滴定终点时滴定管尖嘴中有气泡
您最近一年使用:0次
2019-04-26更新
|
774次组卷
|
3卷引用:山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题
山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)【市级联考】湖南省益阳市2019届高三下学期4月模考理科综合化学试题
4 . 2018年第十二届中国国际航空航天博览会于11月6日至11日在珠海举行。银铜合金广泛用于航空工业,从银铜合金的切割废料中回收银并制备铜化工产品的工艺如下:
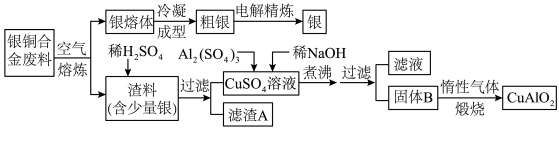
注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃。
(1)电解精炼银时,粗银作______ 极,另一电极上的电极反应式为____________ 。
(2)加快渣料(含少量银)溶于稀H2SO4的速率的措施有________ 、________ (写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为__________ 。
(4)煮沸CuSO4混合溶液的过程中,得到固体B,则固体B的组成为______ ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________ 。
(5)硫酸铜溶液可用于浸取硫铁矿中的铁元素,浸取时发生复杂的氧化还原反应。反应体系中除CuSO4和FeS2外,还有H2SO4、Cu2S、FeSO4和H2O,下列对该反应的分析正确的是______ (填字母代号)。
A.氧化剂为CuSO4和FeS2
B.反应后溶液的pH降低
C.被氧化的FeS2只占总量的30%
D.每转移2 mol电子消耗3 mol CuSO4

注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃。
(1)电解精炼银时,粗银作
(2)加快渣料(含少量银)溶于稀H2SO4的速率的措施有
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为
(4)煮沸CuSO4混合溶液的过程中,得到固体B,则固体B的组成为
(5)硫酸铜溶液可用于浸取硫铁矿中的铁元素,浸取时发生复杂的氧化还原反应。反应体系中除CuSO4和FeS2外,还有H2SO4、Cu2S、FeSO4和H2O,下列对该反应的分析正确的是
A.氧化剂为CuSO4和FeS2
B.反应后溶液的pH降低
C.被氧化的FeS2只占总量的30%
D.每转移2 mol电子消耗3 mol CuSO4
您最近一年使用:0次
解题方法
5 . 由两种元素组成的矿物A,测定A的组成流程如下:
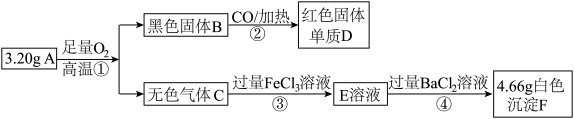
请回答:
(1)②反应中除了产生D外,还有一种气体生成,请写出该气体的电子式____________
(2)写出①的化学方程式:_______________________________________________________
(3)写出③的离子方程式:____________________________________________________
(4)检验E溶液中含有Fe2+ 的方法是:_____________________________

请回答:
(1)②反应中除了产生D外,还有一种气体生成,请写出该气体的电子式
(2)写出①的化学方程式:
(3)写出③的离子方程式:
(4)检验E溶液中含有Fe2+ 的方法是:
您最近一年使用:0次
2019-08-10更新
|
392次组卷
|
2卷引用:2019-2020学年新人教版必修2第5章第2节《氮及其化合物》作业
解题方法
6 . 孔雀石的主要成分为Cu2(OH)2CO3(含少量FeO、Fe2O3、SiO2)。某小组同学在实验室以孔雀石为原料制备胆矾,并测定所得胆矾中结晶水的含量。实验步骤如下:
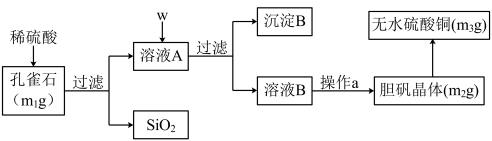
(提供试剂:NaOH溶液、 H2O2溶液、 CuO 、Na2CO3)
完成下列填空:
(1)孔雀石的主要成分与稀硫酸反应的离子方程式为________ 。
(2)按试剂加入顺序,w所代表的试剂依次为__________ 。沉淀B的成分为_______ 。
(3)a操作依次为:加热蒸发、_______ 、过滤、洗涤、__________ 。除烧杯、漏斗之外过滤还需要另一玻璃仪器,该仪器在此操作中的主要作用是_________ 。
(4)欲检验溶液A中Fe2+的试剂是___________ (选填序号)。如果测定Fe2+的含量,需要用容量瓶配制某标准溶液,请简述配制中“定容”的操作:_____ 。
a NaOH(aq) b Na2CO3(aq) c 淀粉KI(aq) d 酸性KMnO4(aq)
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果的实验误差为1.5%,可能的原因是_______________ 。
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 加热胆矾晶体时有晶体从坩埚中溅出
(6)该小组一位同学根据实验结果求出样品中孔雀石的质量分数为: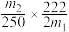 ,另一位同学不同意,其原因是
,另一位同学不同意,其原因是___________ 。

(提供试剂:NaOH溶液、 H2O2溶液、 CuO 、Na2CO3)
完成下列填空:
(1)孔雀石的主要成分与稀硫酸反应的离子方程式为
(2)按试剂加入顺序,w所代表的试剂依次为
(3)a操作依次为:加热蒸发、
(4)欲检验溶液A中Fe2+的试剂是
a NaOH(aq) b Na2CO3(aq) c 淀粉KI(aq) d 酸性KMnO4(aq)
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果的实验误差为1.5%,可能的原因是
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 加热胆矾晶体时有晶体从坩埚中溅出
(6)该小组一位同学根据实验结果求出样品中孔雀石的质量分数为:
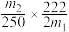 ,另一位同学不同意,其原因是
,另一位同学不同意,其原因是
您最近一年使用:0次
7 . 氯化亚铜(CuCl)在生产中广泛用作催化剂、杀菌剂、脱色剂。某兴趣小组采用加热分解氯化铜晶体(CuCl2·xH2O)的方法制备CuCl,其装置如下(夹持仪器省略)。
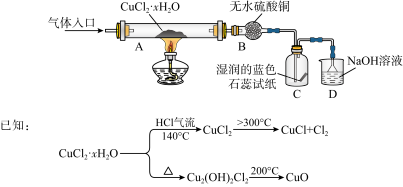
完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是___________________________ 。
(2)实验过程中需要全程通入干燥的HCl,其作用是___________________________ 。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息分析:
① 若杂质是CuCl2,则产生的原因可能是____________________________________ 。
② 若杂质是CuO,则产生的原因可能是_____________________________________ 。
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在______ (填仪器名称)中充分灼烧
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至_____________________
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =________ (精确到0.1)。
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。____________________________

完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是
(2)实验过程中需要全程通入干燥的HCl,其作用是
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息分析:
① 若杂质是CuCl2,则产生的原因可能是
② 若杂质是CuO,则产生的原因可能是
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。
您最近一年使用:0次
2019-04-17更新
|
387次组卷
|
3卷引用:【区级联考】上海市虹口区2019届高三下学期二模考试化学试题
【区级联考】上海市虹口区2019届高三下学期二模考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (练)-《2020年高考一轮复习讲练测》上海市上海师范大学附属中学2019-2020学年高三3月月考化学试题
名校
解题方法
8 . 中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________ 。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________ (写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________ 。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________ 。
(5)固体混合物B的组成为___________ ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________ 。
(6)煅烧阶段通入惰性气体的原因___________ 。

注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为
(4)过滤操作需要的玻璃仪器除烧杯外还有
(5)固体混合物B的组成为
(6)煅烧阶段通入惰性气体的原因
您最近一年使用:0次
2019-04-08更新
|
524次组卷
|
9卷引用:【市级联考】宁夏回族自治区银川市2019届高三质量检测理科综合化学试题
名校
9 . 信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
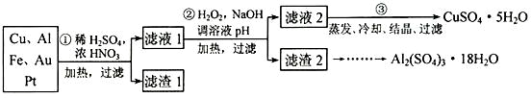
请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为__________________ ,得到滤渣 1的主要成分为_______________ 。
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是____________________ 。
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式______________ 。
(4)第③步蒸发所需玻璃仪器为__________________ 。

请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式
(4)第③步蒸发所需玻璃仪器为
您最近一年使用:0次
2019-03-04更新
|
349次组卷
|
2卷引用:步步为赢 高一化学寒假作业:作业十八 综合评估(二)
2019高三·全国·专题练习
解题方法
10 . 已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:
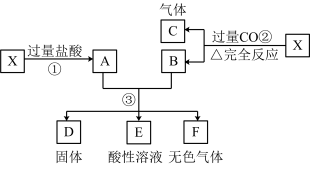
(1)写出①、②和③步所有反应的化学方程式:
①_______________ 、______________ ;
②________________ 、_____________ ;
③________________ 、_____________ 。
(2)设从③步所得固体D的质量为32 g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,试计算取用的每份X的质量为________ ,X中FeO与CuO的质量比为________ 。

(1)写出①、②和③步所有反应的化学方程式:
①
②
③
(2)设从③步所得固体D的质量为32 g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,试计算取用的每份X的质量为
您最近一年使用:0次



