名校
解题方法
1 . 研发二氧化碳的碳捕集和碳利用技术是科学研究热点问题,其中催化转化法最具应用价值。回答下列问题:
(1)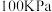 下,由最稳定单质生成
下,由最稳定单质生成 物质B的焓变,叫做物质B的标准摩尔生成焓
物质B的焓变,叫做物质B的标准摩尔生成焓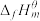 。298K,几种气态物质的标准摩尔生成焓如下表。
。298K,几种气态物质的标准摩尔生成焓如下表。
则

_______ 
(2)催化加氢制取甲醇,反应如下:
主反应:

副反应:

在一定条件下,向某 恒容密闭容器中充入
恒容密闭容器中充入
 和
和
 发生反应,起始总压强为
发生反应,起始总压强为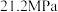 。实验测得
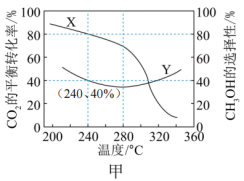
。实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度变化如图甲所示:
的选择性随温度变化如图甲所示:
已知: 的选择性
的选择性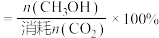 。
。
①图甲中表示平衡时 的选择性的曲线为
的选择性的曲线为_______ (填“X”或“Y”),温度高于280℃时,曲线Y随温度升高而升高的原因是_______ 。
②240℃时,反应 容器内达到平衡状态,副反应的
容器内达到平衡状态,副反应的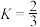 ,初始充入
,初始充入 的物质的量
的物质的量
_______ mol,主反应的平衡常数
_______ 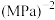 (用平衡分压代替平衡浓度,
(用平衡分压代替平衡浓度,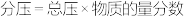 ;计算结果保留1位小数)。
;计算结果保留1位小数)。
(1)
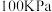 下,由最稳定单质生成
下,由最稳定单质生成 物质B的焓变,叫做物质B的标准摩尔生成焓
物质B的焓变,叫做物质B的标准摩尔生成焓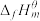 。298K,几种气态物质的标准摩尔生成焓如下表。
。298K,几种气态物质的标准摩尔生成焓如下表。则



| 物质 |  |  |  |  |
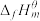 ( ( ) ) |  | 0 | 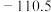 | 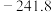 |
主反应:


副反应:


在一定条件下,向某
 恒容密闭容器中充入
恒容密闭容器中充入
 和
和
 发生反应,起始总压强为
发生反应,起始总压强为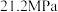 。实验测得
。实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度变化如图甲所示:
的选择性随温度变化如图甲所示:
已知:
 的选择性
的选择性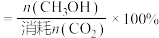 。
。①图甲中表示平衡时
 的选择性的曲线为
的选择性的曲线为②240℃时,反应
 容器内达到平衡状态,副反应的
容器内达到平衡状态,副反应的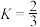 ,初始充入
,初始充入 的物质的量
的物质的量

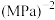 (用平衡分压代替平衡浓度,
(用平衡分压代替平衡浓度,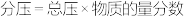 ;计算结果保留1位小数)。
;计算结果保留1位小数)。
您最近一年使用:0次
名校
2 . 乙烯是重要的化工原料,常用来衡量石油化工发展水平。工业上有多种获得方式。
I.CO2催化加氢:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) △H。
CH2=CH2(g)+4H2O(g) △H。
(1)已知:①2H2(g)+O2(g)=2H2O(g) △H1=-480kJ•mol-1;
②CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g) △H2=-1081.4kJ•mol-1。
则上述反应中△H=____ 。
(2)已知反应6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g)的v正=k正·p2(CO2)·p6(H2)、v逆=k逆·p(C2H4)·p4(H2O),该反应在温度T2℃下有k正=1.5k逆,则T2℃下的Kp=
CH2=CH2(g)+4H2O(g)的v正=k正·p2(CO2)·p6(H2)、v逆=k逆·p(C2H4)·p4(H2O),该反应在温度T2℃下有k正=1.5k逆,则T2℃下的Kp=____ 。若温度T3℃下有k正=2k逆,则T3____ (填“大于”、“小于”或“等于”)T2,理由为____ 。
II.乙烷裂解:C2H6(g) CH2=CH2(g)+H2(g) △H。
CH2=CH2(g)+H2(g) △H。
(3)工业生产中,通常采用恒压条件下在乙烷裂解原料中加入惰性气体以提高乙烯产率,试解释其原因:____ 。
(4)乙烷裂解时易发生副反应:2C2H6(g) CH2=CH2(g)+2CH4(g)。已知在一定温度下,在恒容密闭容器中充入10molC2H6进行反应,达到平衡时CH4和C2H4的体积分数均为
CH2=CH2(g)+2CH4(g)。已知在一定温度下,在恒容密闭容器中充入10molC2H6进行反应,达到平衡时CH4和C2H4的体积分数均为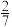 ,则乙烷的总转化率为
,则乙烷的总转化率为____ ;将裂解产物通过足量溴水后,再完全燃烧,将生成的气体通入6L2mol·L-1KOH溶液中,所得溶液中c(H2CO3)____ (填“>”、“<”或“=”)c(CO )。
)。
I.CO2催化加氢:6H2(g)+2CO2(g)
 CH2=CH2(g)+4H2O(g) △H。
CH2=CH2(g)+4H2O(g) △H。(1)已知:①2H2(g)+O2(g)=2H2O(g) △H1=-480kJ•mol-1;
②CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g) △H2=-1081.4kJ•mol-1。
则上述反应中△H=
(2)已知反应6H2(g)+2CO2(g)
 CH2=CH2(g)+4H2O(g)的v正=k正·p2(CO2)·p6(H2)、v逆=k逆·p(C2H4)·p4(H2O),该反应在温度T2℃下有k正=1.5k逆,则T2℃下的Kp=
CH2=CH2(g)+4H2O(g)的v正=k正·p2(CO2)·p6(H2)、v逆=k逆·p(C2H4)·p4(H2O),该反应在温度T2℃下有k正=1.5k逆,则T2℃下的Kp=II.乙烷裂解:C2H6(g)
 CH2=CH2(g)+H2(g) △H。
CH2=CH2(g)+H2(g) △H。(3)工业生产中,通常采用恒压条件下在乙烷裂解原料中加入惰性气体以提高乙烯产率,试解释其原因:
(4)乙烷裂解时易发生副反应:2C2H6(g)
 CH2=CH2(g)+2CH4(g)。已知在一定温度下,在恒容密闭容器中充入10molC2H6进行反应,达到平衡时CH4和C2H4的体积分数均为
CH2=CH2(g)+2CH4(g)。已知在一定温度下,在恒容密闭容器中充入10molC2H6进行反应,达到平衡时CH4和C2H4的体积分数均为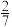 ,则乙烷的总转化率为
,则乙烷的总转化率为 )。
)。
您最近一年使用:0次
3 . “水煤气(CO和 )”是化学工业常用的原料气,请回答:
)”是化学工业常用的原料气,请回答:
I.已知:焦炭、CO的标准燃烧热分别为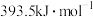 、
、 ,氢气燃烧的热化学反应方程式:
,氢气燃烧的热化学反应方程式: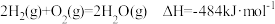
(1)试写出由焦炭和水蒸气生成水煤气的热化学反应方程式:___________
(2)下列说法正确的是___________
II.合成氨工厂以“水煤气”为原料,采用两段间接换热式绝热反应器(反应器中的催化剂对原料气的吸附时间长短,对原料气的转化率会造成一定影响)在常压下进行转换合成氨,装置如图。
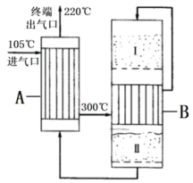
A反应器中主要发生的反应为: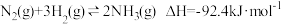
B反应器中主要发生的反应为:
主反应: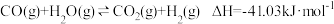
副反应:
由进气口充入一定量含CO、 、
、 、
、 的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、
的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、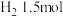 、
、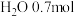 、
、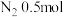 、
、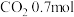 和
和 。
。
已知标准平衡常数: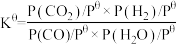 ,其中
,其中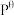 表示标准压强(
表示标准压强(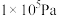 )
)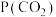 、
、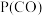 、
、 、
、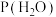 表示各组分的分压,如
表示各组分的分压,如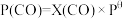 ,
, 为体系中CO的物质的量分数
为体系中CO的物质的量分数
(3)T℃时,主反应的压强平衡常数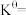
___________
(4)平衡时CO的转化率为___________
(5)进气空速对反应产品的收率有一定的影响,实验测得在不同进气空速下,测得平衡时 的收率如下图所示
的收率如下图所示
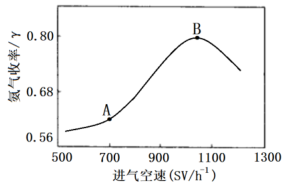
①曲线中A点到B点变化的原因是:___________
②若将绝热转换反应器改为恒温转换反应器,试在图中画出随进气空速变化的 收率曲线
收率曲线___ 。
 )”是化学工业常用的原料气,请回答:
)”是化学工业常用的原料气,请回答:I.已知:焦炭、CO的标准燃烧热分别为
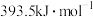 、
、 ,氢气燃烧的热化学反应方程式:
,氢气燃烧的热化学反应方程式: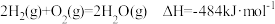
(1)试写出由焦炭和水蒸气生成水煤气的热化学反应方程式:
(2)下列说法正确的是___________
| A.将煤炭在空气中直接加强热进行干馏,制备生成水煤气的原料焦炭 |
| B.水煤气可经过催化合成获得液体燃料、碳氢化合物和含氧有机物 |
| C.水煤气也可采用高温下煤和水蒸气直接作用制得 |
| D.在恒压反应釜中,利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成 |
II.合成氨工厂以“水煤气”为原料,采用两段间接换热式绝热反应器(反应器中的催化剂对原料气的吸附时间长短,对原料气的转化率会造成一定影响)在常压下进行转换合成氨,装置如图。

A反应器中主要发生的反应为:
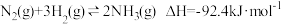
B反应器中主要发生的反应为:
主反应:
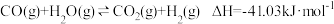
副反应:

由进气口充入一定量含CO、
 、
、 、
、 的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、
的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、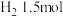 、
、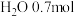 、
、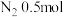 、
、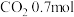 和
和 。
。已知标准平衡常数:
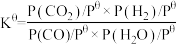 ,其中
,其中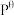 表示标准压强(
表示标准压强(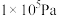 )
)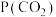 、
、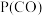 、
、 、
、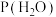 表示各组分的分压,如
表示各组分的分压,如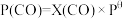 ,
, 为体系中CO的物质的量分数
为体系中CO的物质的量分数(3)T℃时,主反应的压强平衡常数
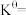
(4)平衡时CO的转化率为
(5)进气空速对反应产品的收率有一定的影响,实验测得在不同进气空速下,测得平衡时
 的收率如下图所示
的收率如下图所示
①曲线中A点到B点变化的原因是:
②若将绝热转换反应器改为恒温转换反应器,试在图中画出随进气空速变化的
 收率曲线
收率曲线
您最近一年使用:0次
2021-10-20更新
|
636次组卷
|
3卷引用:2021年海南高考化学试题变式题11-19
名校
解题方法
4 . 请回答下列问题。
Ⅰ.合成氨对人类生存具有重大意义,反应为:N2(g)+3H2(g) 2NH3(g) ∆H=-92.4kJ/mol。
2NH3(g) ∆H=-92.4kJ/mol。
(1)我国科学家在合成氨反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
①3LiH(s) + N2(g) =Li2NH(s) + LiNH2(g) ΔH1=+32.8kJ·mol-1
②Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) ΔH2=-78kJ·mol-1
③LiNH2(g)+H2(g)=LiH(s)+NH3(g) ΔH3
则ΔH3=___________ 。
(2)将10mol N2和30mol H2投入容积恒为10L的反应器中,控制不同温度与压强,得到平衡时N2的转化率与温度、压强的关系如图所示。

根据M点数据求出该条件下的平衡常数Kp=___________ 。
(3)工业上,合成氨反应在高压条件下进行,实际上Kp值不仅与温度有关,还与压力和气体组成有关。一定条件下,合成氨反应接近平衡时,遵循如下方程: 。其中r(NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,该条件下,实验测得a=0.5,则反应达到平衡时,k正、k逆、Kp三者之间的关系式为
。其中r(NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,该条件下,实验测得a=0.5,则反应达到平衡时,k正、k逆、Kp三者之间的关系式为___________ 。
Ⅱ.已知:①水体中氨氮(NH3、NH )过量会导致富营养化,国家标准要求经处理过的氨氮废水中氨氮标准限值范围为0.02mg/L~150mg/L、pH控制在6~9;②HClO的氧化性比NaClO强;③NH3比NH
)过量会导致富营养化,国家标准要求经处理过的氨氮废水中氨氮标准限值范围为0.02mg/L~150mg/L、pH控制在6~9;②HClO的氧化性比NaClO强;③NH3比NH 更易被氧化。
更易被氧化。
某研究小组用NaClO氧化法处理氨氮废水,进水pH对氨氮去除率和出水pH的影响如图所示:
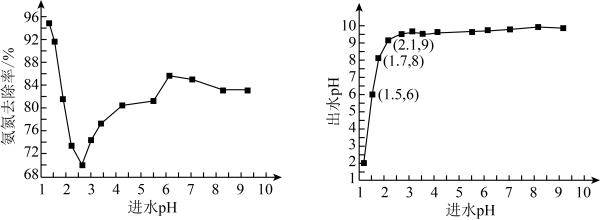
(4)①进水pH为1.25~2.75范围内,氨氮去除率随进水pH升高迅速下降的原因是___________ 。②进水pH为2.75~6.00范围内,氨氮去除率随进水pH升高而上升的原因是___________ 。
(5)常温下将0.1004mol碳酸氢铵粉末加入到1L 0.1mol/L盐酸中,充分反应后溶液pH恰好为7(此时溶液中几乎不含碳元素,忽略溶液体积变化),则溶液中c(NH )=
)=___________ ,NH3·H2O的电离平衡常数为___________ 。
Ⅰ.合成氨对人类生存具有重大意义,反应为:N2(g)+3H2(g)
 2NH3(g) ∆H=-92.4kJ/mol。
2NH3(g) ∆H=-92.4kJ/mol。(1)我国科学家在合成氨反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。
①3LiH(s) + N2(g) =Li2NH(s) + LiNH2(g) ΔH1=+32.8kJ·mol-1
②Li2NH(s)+2H2(g)=2LiH(s)+NH3(g) ΔH2=-78kJ·mol-1
③LiNH2(g)+H2(g)=LiH(s)+NH3(g) ΔH3
则ΔH3=
(2)将10mol N2和30mol H2投入容积恒为10L的反应器中,控制不同温度与压强,得到平衡时N2的转化率与温度、压强的关系如图所示。

根据M点数据求出该条件下的平衡常数Kp=
(3)工业上,合成氨反应在高压条件下进行,实际上Kp值不仅与温度有关,还与压力和气体组成有关。一定条件下,合成氨反应接近平衡时,遵循如下方程:
 。其中r(NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,该条件下,实验测得a=0.5,则反应达到平衡时,k正、k逆、Kp三者之间的关系式为
。其中r(NH3)为氨合成反应的净速率,a为常数,与催化剂性质及反应条件有关,该条件下,实验测得a=0.5,则反应达到平衡时,k正、k逆、Kp三者之间的关系式为Ⅱ.已知:①水体中氨氮(NH3、NH
 )过量会导致富营养化,国家标准要求经处理过的氨氮废水中氨氮标准限值范围为0.02mg/L~150mg/L、pH控制在6~9;②HClO的氧化性比NaClO强;③NH3比NH
)过量会导致富营养化,国家标准要求经处理过的氨氮废水中氨氮标准限值范围为0.02mg/L~150mg/L、pH控制在6~9;②HClO的氧化性比NaClO强;③NH3比NH 更易被氧化。
更易被氧化。某研究小组用NaClO氧化法处理氨氮废水,进水pH对氨氮去除率和出水pH的影响如图所示:

(4)①进水pH为1.25~2.75范围内,氨氮去除率随进水pH升高迅速下降的原因是
(5)常温下将0.1004mol碳酸氢铵粉末加入到1L 0.1mol/L盐酸中,充分反应后溶液pH恰好为7(此时溶液中几乎不含碳元素,忽略溶液体积变化),则溶液中c(NH
 )=
)=
您最近一年使用:0次
2021-09-01更新
|
528次组卷
|
2卷引用:2021年海南高考化学试题变式题11-19
名校
解题方法
5 . Ⅰ.铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=_______
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为_______
②下列条件能判断该反应达到平衡状态的是_______
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:
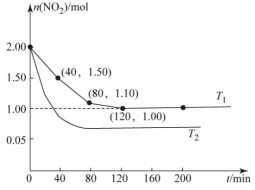
①T1_______ T2(填“>”或“<”)。
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=_______
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_______ 移动(填“正向”“逆向”或“不”)。
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为_______ (室温下,Ksp(CaCO3)=3×10-9,Ksp(CaSO4)=9×10-6)。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为
②下列条件能判断该反应达到平衡状态的是
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO
 =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为
您最近一年使用:0次
2021-06-27更新
|
1003次组卷
|
8卷引用:2021年海南高考化学试题变式题11-19
2021年海南高考化学试题变式题11-19(已下线)理综化学-2021年秋季高三开学摸底考试卷01(课标全国专用)(已下线)备战2022年高考化学精准检测卷【全国卷】08广东省湛江市第二十一中学2021—2022学年高三上学期11月月考化学试题四川省资中县球溪高级中学2022-2023学年高三上学期10月月考化学试题四川省广安市2019-2020学年高二下学期期末(零诊)化学试题湖北省天门外国语学校2022-2023学年高二上学期12月月考化学试题四川省内江市威远中学校2022-2023学年高二下学期第二次阶段性考试理综化学试题
解题方法
6 . CO和NO是汽车尾气中的主要污染物,易引起酸雨、温室效应和光化学烟雾等环境污染问题。随着我国机动车保有量的飞速发展,汽车尾气的有效处理变得迫在眉睫。其中的一种方法为2CO(g)+2NO(g)=N2(g)+2CO2(g),请回答下列问题:
(1)已知该反应为自发反应,则该反应的反应热△H___________ 0(填“>”或“<”或“=”)
(2)已知:N2 (g) + O2(g)=2NO(g) △H= a kJ•mol -1
C(s) + O2 (g)=CO2 (g) △H= b kJ•mol -1
2C(s) + O2 (g)=2CO(g) △H= c kJ•mol -1
则 2CO(g)+2NO(g)=N2 (g)+2CO2 (g) △H=___________ kJ•mol-1 (用含 a、b、c 的表达式表示)。
(3)一定温度下,将 2molCO、4molNO 充入一恒压密闭容器。已知起始压强为 1MPa,到达平衡时, 测得N2的物质的量为 0.5 mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=___________ (写出计算表示式)
②该条件下,可判断此反应到达平衡的标志是___________
A.单位时间内,断裂 2 molC=O 同时形成 1 mol N≡N。
B.混合气体的平均相对分子质量不再改变。
C.混合气体的密度不再改变。
D.CO与NO的转化率比值不再改变。
(4)某研究小组探究催化剂对 CO、NO 转化的影响。将 CO 和 NO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 N2的含量,从而确定尾气脱氮率(即 NO 的转化率),结果如图所示:
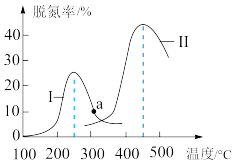
①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为___________
②若低于 200℃,图中曲线 I 脱氮率随温度升高变化不大的主要原因为___________
(5)已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=___________ mol/L,将脱氮反应后生成CO2通入氨水中使溶液恰好呈中性,则此时 =
=___________ (保留小数点后4位数字)
(6)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质A,A是___________ ,理由是___________

(1)已知该反应为自发反应,则该反应的反应热△H
(2)已知:N2 (g) + O2(g)=2NO(g) △H= a kJ•mol -1
C(s) + O2 (g)=CO2 (g) △H= b kJ•mol -1
2C(s) + O2 (g)=2CO(g) △H= c kJ•mol -1
则 2CO(g)+2NO(g)=N2 (g)+2CO2 (g) △H=
(3)一定温度下,将 2molCO、4molNO 充入一恒压密闭容器。已知起始压强为 1MPa,到达平衡时, 测得N2的物质的量为 0.5 mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=
②该条件下,可判断此反应到达平衡的标志是
A.单位时间内,断裂 2 molC=O 同时形成 1 mol N≡N。
B.混合气体的平均相对分子质量不再改变。
C.混合气体的密度不再改变。
D.CO与NO的转化率比值不再改变。
(4)某研究小组探究催化剂对 CO、NO 转化的影响。将 CO 和 NO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 N2的含量,从而确定尾气脱氮率(即 NO 的转化率),结果如图所示:

①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为
②若低于 200℃,图中曲线 I 脱氮率随温度升高变化不大的主要原因为
(5)已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=
 =
=(6)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质A,A是

您最近一年使用:0次
2021-05-24更新
|
813次组卷
|
3卷引用:2021年海南高考化学试题变式题11-19
解题方法
7 . H2在生物学、医学等领域有重要应用,传统制氢成本高、技术复杂,研究新型制氢意义重大,已成为科学家研究的重要课题。回答下列问题:
(1)我国科学家研究发现,在Rh的催化下,单分子甲酸分解制H2反应的过程如图1所示,其中带“*”的物种表示吸附在Rh表面,该反应过程中决定反应速率步骤的化学方程式为___________ ;甲酸分解制H2的热化学方程式可表示为___________ (阿伏加德罗常数用NA表示)。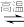 2H2(g)+S2(g)。实际生产中往刚性容器中同时通入H2S和水蒸气,水蒸气与反应体系的任何物质均不发生反应,测得容器总压(P总压)和H2S的转化率(a)随时间的变化关系如图2所示。计算反应在0~20 min内的平均反应速率v(H2)=
2H2(g)+S2(g)。实际生产中往刚性容器中同时通入H2S和水蒸气,水蒸气与反应体系的任何物质均不发生反应,测得容器总压(P总压)和H2S的转化率(a)随时间的变化关系如图2所示。计算反应在0~20 min内的平均反应速率v(H2)= ___ kPa·min-1;平衡时,p(水蒸气)=_______ kPa,平衡常数Kp=____ kPa(Kp为以分压表示的平衡常数)。
(1)我国科学家研究发现,在Rh的催化下,单分子甲酸分解制H2反应的过程如图1所示,其中带“*”的物种表示吸附在Rh表面,该反应过程中决定反应速率步骤的化学方程式为
 2H2(g)+S2(g)。实际生产中往刚性容器中同时通入H2S和水蒸气,水蒸气与反应体系的任何物质均不发生反应,测得容器总压(P总压)和H2S的转化率(a)随时间的变化关系如图2所示。计算反应在0~20 min内的平均反应速率v(H2)=
2H2(g)+S2(g)。实际生产中往刚性容器中同时通入H2S和水蒸气,水蒸气与反应体系的任何物质均不发生反应,测得容器总压(P总压)和H2S的转化率(a)随时间的变化关系如图2所示。计算反应在0~20 min内的平均反应速率v(H2)= 
(3)工业上也可采用乙苯( )气体催化脱氢法制取H2,同时生成苯乙烯(
)气体催化脱氢法制取H2,同时生成苯乙烯(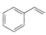 )气体。其他条件不变时,在不同催化剂(n、m、p)作用下,反应进行相同时间后,乙苯的转化率随反应温度的变化如图3所示。相同温度下,三种催化剂(n、m、p)的催化活性由高到低的顺序为
)气体。其他条件不变时,在不同催化剂(n、m、p)作用下,反应进行相同时间后,乙苯的转化率随反应温度的变化如图3所示。相同温度下,三种催化剂(n、m、p)的催化活性由高到低的顺序为
您最近一年使用:0次
2021-04-24更新
|
1153次组卷
|
8卷引用:2021年海南高考化学试题变式题11-19
2021年海南高考化学试题变式题11-19安徽省皖南八校2021届高三4月第三次联考理综化学试题(已下线)难点3 化学反应速率与化学平衡图表分析-2021年高考化学专练【热点·重点·难点】(已下线)押山东卷第18题 化学反应原理综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)01 化学反应原理综合题型集训之催化剂、活化能与反应历程(解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)T17-原理综合题
解题方法
8 . 铁及其化合物在生产、生活中应用广泛。
(1)已知: ①3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H1=a kJ·mol-1;
②2H2(g)+O2(g)=2H2O(1) △H2=b kJ·mol-1
③H2O(g)=H2O(l) △H3=c kJ·mol-1
则3Fe(s)+2O2(g))=Fe3O4(s)△H=_________ kJ·mol-1(用含 a、b、c 的代数式表示)。
(2)活性铁粉是合成氨气的催化剂。工业合成氨的原理为N2+3H2 2NH3 △H<0
2NH3 △H<0
①工业采用“高压”一般为20~50MPa,温度为 500℃。采用“温度为 500℃”的目的是____________ ;
②氨气是合成氮肥的重要原料。常温下,0.1mol·L-1(NH4)2SO4溶液中离子浓度大小排序为___________ ;
③常温下,向a mL c mol·L-1氨水中滴加b mL c mol·L-1稀硝酸恰好至溶液pH=7(溶液体积变化忽略不计),则NH3·H2O的电离常数Kb=___ ;
(3)工业上用热还原法冶炼铁。在密闭容器中,投入足量的 FeO 粉末和炭粉,在一定温度下发生反应:FeO(s)+C(s)⇌Fe(s)+CO(g) △H>0;
①若容积恒定,则下列情况表明上述反应达到平衡状态的是___________ (填代号)
A.FeO 的浓度不再改变 B.气体相对分子质量不再改变 C.气体密度不再改变 D.铁粉的质量不再改变
②在该温度下,上述反应达到平衡时c(CO)=a mol·L-1,则该反应的平衡常数为________ ;在温度不变时,将容器体积扩大至原来的4倍,则达到新平衡时,c(CO)为_____________ 。
(1)已知: ①3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H1=a kJ·mol-1;
②2H2(g)+O2(g)=2H2O(1) △H2=b kJ·mol-1
③H2O(g)=H2O(l) △H3=c kJ·mol-1
则3Fe(s)+2O2(g))=Fe3O4(s)△H=
(2)活性铁粉是合成氨气的催化剂。工业合成氨的原理为N2+3H2
 2NH3 △H<0
2NH3 △H<0①工业采用“高压”一般为20~50MPa,温度为 500℃。采用“温度为 500℃”的目的是
②氨气是合成氮肥的重要原料。常温下,0.1mol·L-1(NH4)2SO4溶液中离子浓度大小排序为
③常温下,向a mL c mol·L-1氨水中滴加b mL c mol·L-1稀硝酸恰好至溶液pH=7(溶液体积变化忽略不计),则NH3·H2O的电离常数Kb=
(3)工业上用热还原法冶炼铁。在密闭容器中,投入足量的 FeO 粉末和炭粉,在一定温度下发生反应:FeO(s)+C(s)⇌Fe(s)+CO(g) △H>0;
①若容积恒定,则下列情况表明上述反应达到平衡状态的是
A.FeO 的浓度不再改变 B.气体相对分子质量不再改变 C.气体密度不再改变 D.铁粉的质量不再改变
②在该温度下,上述反应达到平衡时c(CO)=a mol·L-1,则该反应的平衡常数为
您最近一年使用:0次
解题方法
9 . 自然界中的含硫物质在一定条件下能够相互转化,这种转化在人工条件下也能发生。
(1)最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图所示。

①H2S的电子式为_________________________________ 。
②第二步反应中SO2体现_____________ 性。(填“氧化”或“还原”)
③总反应的化学方程式为_________________________ 。
(2)利用氨水吸收烟气中的二氧化硫,涉及反应2(NH4)2SO3(aq) + O2(g) 2(NH4)2SO4(aq)。
2(NH4)2SO4(aq)。
①随温度升高,氧气氧化(NH4)2SO3的速率先增大后减小,氧化速率减小的原因可能是_______ , (NH4)2SO4溶液呈酸性的原因是__________ (用离子方程式表示)。
②常温下,向(NH4)2SO3和(NH4)2SO4的混合液中滴加足量的氯化钡溶液,充分反应后测得溶液中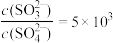 , 则Ksp(BaSO4)=
, 则Ksp(BaSO4)=__________ [已知Ksp(BaSO3)= 5×10-7]
(1)最近有人尝试用H2还原工业尾气中SO2,该反应分两步完成,如图所示。

①H2S的电子式为
②第二步反应中SO2体现
③总反应的化学方程式为
(2)利用氨水吸收烟气中的二氧化硫,涉及反应2(NH4)2SO3(aq) + O2(g)
 2(NH4)2SO4(aq)。
2(NH4)2SO4(aq)。①随温度升高,氧气氧化(NH4)2SO3的速率先增大后减小,氧化速率减小的原因可能是
②常温下,向(NH4)2SO3和(NH4)2SO4的混合液中滴加足量的氯化钡溶液,充分反应后测得溶液中
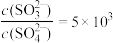 , 则Ksp(BaSO4)=
, 则Ksp(BaSO4)=
您最近一年使用:0次
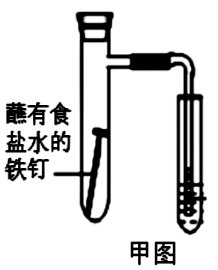
10 . 铜铁是目前人们使用量最大的合金材料,铁及其化合物也是人们日常生活中应用广泛的一类物质。回答下列问题:
(1)下图中铁钉发生的电化学腐蚀类型是________ ,负极反应式为__________ 。
(2)实验室配置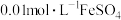 溶液时,需向溶液中滴加几滴稀硫酸,其目的是
溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________ , 溶液中离子浓度由大到小的顺序是
溶液中离子浓度由大到小的顺序是________ 。
(3)高铁盐酸是一种新型的环境消毒剂及水体净化剂,如高铁酸钾( )。其中
)。其中 的化合价是
的化合价是________ ,其净水过程中既表现出强氧化性,又表现了强吸附性,则 与水反应的离子方程式为
与水反应的离子方程式为__________ 。
(4)羰基铁酸[ ]是一种二元弱酸,其第一步电离方程式为
]是一种二元弱酸,其第一步电离方程式为__________ 。
(5)25℃时,向含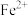 的溶液中加入一定量的
的溶液中加入一定量的 后,
后, 恰好达到溶液平衡,测得溶液的
恰好达到溶液平衡,测得溶液的 ,
,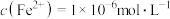 。通过计算判断所得的
。通过计算判断所得的 中是否含有
中是否含有 杂质:
杂质:________ (已知: ,
,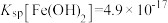 )
)
(1)下图中铁钉发生的电化学腐蚀类型是

(2)实验室配置
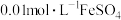 溶液时,需向溶液中滴加几滴稀硫酸,其目的是
溶液时,需向溶液中滴加几滴稀硫酸,其目的是 溶液中离子浓度由大到小的顺序是
溶液中离子浓度由大到小的顺序是(3)高铁盐酸是一种新型的环境消毒剂及水体净化剂,如高铁酸钾(
 )。其中
)。其中 的化合价是
的化合价是 与水反应的离子方程式为
与水反应的离子方程式为(4)羰基铁酸[
 ]是一种二元弱酸,其第一步电离方程式为
]是一种二元弱酸,其第一步电离方程式为(5)25℃时,向含
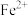 的溶液中加入一定量的
的溶液中加入一定量的 后,
后, 恰好达到溶液平衡,测得溶液的
恰好达到溶液平衡,测得溶液的 ,
,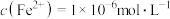 。通过计算判断所得的
。通过计算判断所得的 中是否含有
中是否含有 杂质:
杂质: ,
,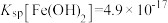 )
)
您最近一年使用:0次



