1 . 一氯甲烷主要用于生产甲基氯硅烷,一氯乙烯主要用于生产聚氯乙烯等高聚物,1,2-二氯乙烷常用作有机溶剂和化工原料。回答下列问题:
I.在加热或光照条件下,“甲烷一氯气”法得到一氯甲烷是按自由基机理进行的,即CH4(g)+Cl2(g) CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
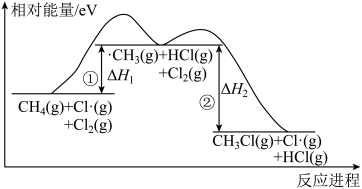
(1)已知H3C-H键能为4.56eV,H-Cl键能为4.46eV,1eV相当于96.5kJ/mol。则步骤①的焓变△H1=_______ kJ/mol;一氯取代反应的总焓变△H=______ (用△H1、△H2表示)。
Ⅱ.一氯乙烯(CH2=CHC1)的工业生产方法之一是乙烯氯化裂解法,该方法分以下两个过程进行:
乙烯氯化加成:CH2=CH2(g)+Cl2(g) ClCH2CH2Cl(g) △H1=-171.7kJ/mol
ClCH2CH2Cl(g) △H1=-171.7kJ/mol
1,2-二氯乙烷裂解:ClCH2CH2Cl(g) CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol
CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol
(2)乙烯氯化加成反应在热力学上进行的趋势很大,原因是______ 。1,2-二氯乙烷裂解反应的△S=+145.7J mol/K,则该裂解反应能自发进行的最低温度约为
mol/K,则该裂解反应能自发进行的最低温度约为______ K(保留整数)。
(3)在某恒压密闭容器中通入一定量的ClCH2CH2Cl(g),仅发生1,2-二氯乙烷裂解生成氯乙烯和氯化氢,实验测得ClCH2CH2Cl(g)的转化率随温度和反应时间的关系如图所示。

①T1、T2、T3的大小关系为_______ ,原因是_______ 。
②若M点刚好达到平衡状态,则N点的v正_____ v逆(填“大于”“小于”或“等于”)。Ka是以物质的量分数表示的平衡常数,则T2温度下1,2-二氯乙烷裂解生成氯乙烯和氯化氢的反应的Kx=_____ 保留2位小数)。
Ⅲ.一种电化学合成1,2-二氯乙婉的实验装置如图所示
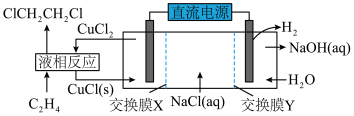
(4)交换膜X是______ 离子交换膜(填“阴”或“阳”),该实验装置合成1,2-二氯乙烷的总反应的化学方程式为______ 。
I.在加热或光照条件下,“甲烷一氯气”法得到一氯甲烷是按自由基机理进行的,即CH4(g)+Cl2(g)
 CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
(1)已知H3C-H键能为4.56eV,H-Cl键能为4.46eV,1eV相当于96.5kJ/mol。则步骤①的焓变△H1=
Ⅱ.一氯乙烯(CH2=CHC1)的工业生产方法之一是乙烯氯化裂解法,该方法分以下两个过程进行:
乙烯氯化加成:CH2=CH2(g)+Cl2(g)
 ClCH2CH2Cl(g) △H1=-171.7kJ/mol
ClCH2CH2Cl(g) △H1=-171.7kJ/mol1,2-二氯乙烷裂解:ClCH2CH2Cl(g)
 CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol
CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol(2)乙烯氯化加成反应在热力学上进行的趋势很大,原因是
 mol/K,则该裂解反应能自发进行的最低温度约为
mol/K,则该裂解反应能自发进行的最低温度约为(3)在某恒压密闭容器中通入一定量的ClCH2CH2Cl(g),仅发生1,2-二氯乙烷裂解生成氯乙烯和氯化氢,实验测得ClCH2CH2Cl(g)的转化率随温度和反应时间的关系如图所示。

①T1、T2、T3的大小关系为
②若M点刚好达到平衡状态,则N点的v正
Ⅲ.一种电化学合成1,2-二氯乙婉的实验装置如图所示

(4)交换膜X是
您最近一年使用:0次
2024-03-18更新
|
119次组卷
|
2卷引用:河北省石家庄市辛集中学、衡水中学2023-2024高三上学期期末联考化学试题
2 . 丙烷价格低廉且产量大,而丙烯及其衍生物具有较高的经济附加值,因此丙烷脱氢制丙烯具有重要的价值。
已知下列反应的热化学方程式:
①直接脱氢: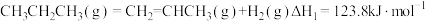
②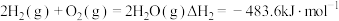
③ 氧化脱氢:
氧化脱氢:
(1)反应①_______正向自发进行。
(2)计算反应③的
_______ 。
(3)已知下列键能数据,结合反应①数据,计算 的键能是
的键能是_______ 。
(4)研究人员尝试利用 氧化丙烷脱氢制丙烯,与
氧化丙烷脱氢制丙烯,与 氧化丙烷脱氢制丙烯相比,使用
氧化丙烷脱氢制丙烯相比,使用 氧化丙烷脱氢制丙烯的优点是
氧化丙烷脱氢制丙烯的优点是_______ 。
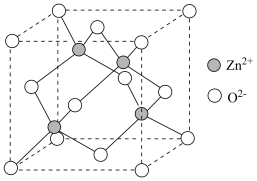
(5)一种基于 的锌基催化剂可高效催化丙烷转化为丙烯,立方
的锌基催化剂可高效催化丙烷转化为丙烯,立方 的晶胞如图所示,晶胞的边长为
的晶胞如图所示,晶胞的边长为 。每个
。每个 晶胞中
晶胞中 的数目为
的数目为_______ 个,晶体的密度
_______  。(设
。(设 为阿伏加德罗常数,用含
为阿伏加德罗常数,用含 的代数式表示,
的代数式表示, )。
)。
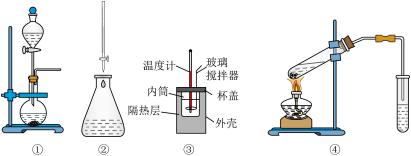
(6)下列实验装置使用不正确的是_______。
碰撞理论指出,一定温度下,气体的平均能量一定,但每个气体分子的能量大小不同
(7)标准状况下,恒容密闭容器内不同分子的能量与数目的分布情况如下图表示,其中阴影部分代表活化分子:
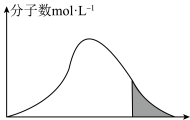
若升高温度,图像将最有可能变成(选填下图中的序号,下同)_______ ;若再继续充入适量气体,图像将最有可能变成_______ 。
A. B.
B.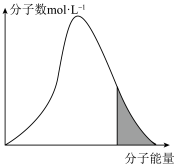 C.
C.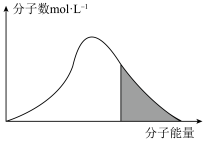
电解尿素是一种低能耗制 的方法,总反应:
的方法,总反应: 。
。

(8)写出b电极的电极方程式_______ 。
(9)已知尿素中 元素为
元素为 价,一段时间后在
价,一段时间后在 电极收集到标准状况下
电极收集到标准状况下 气体,则整个电路中转移的电子数为
气体,则整个电路中转移的电子数为_______ 个。
已知下列反应的热化学方程式:
①直接脱氢:
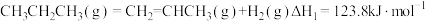
②
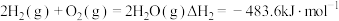
③
 氧化脱氢:
氧化脱氢:
(1)反应①_______正向自发进行。
| A.低温下能 | B.高温下能 | C.任何温度下都能 | D.任何温度下都不能 |
(2)计算反应③的

(3)已知下列键能数据,结合反应①数据,计算
 的键能是
的键能是化学键 |
|
|
|
键能 | 347.7 | 413.4 | 436.0 |
(4)研究人员尝试利用
 氧化丙烷脱氢制丙烯,与
氧化丙烷脱氢制丙烯,与 氧化丙烷脱氢制丙烯相比,使用
氧化丙烷脱氢制丙烯相比,使用 氧化丙烷脱氢制丙烯的优点是
氧化丙烷脱氢制丙烯的优点是(5)一种基于
 的锌基催化剂可高效催化丙烷转化为丙烯,立方
的锌基催化剂可高效催化丙烷转化为丙烯,立方 的晶胞如图所示,晶胞的边长为
的晶胞如图所示,晶胞的边长为 。每个
。每个 晶胞中
晶胞中 的数目为
的数目为
 。(设
。(设 为阿伏加德罗常数,用含
为阿伏加德罗常数,用含 的代数式表示,
的代数式表示, )。
)。
(6)下列实验装置使用不正确的是_______。

| A.图①装置用于二氧化锰和浓盐酸反应制氯气 |
| B.图②装置用于标准酸溶液滴定未知碱溶液 |
| C.图③装置用于测定中和反应的反应热 |
| D.图④装置用于制备乙酸乙酯 |
碰撞理论指出,一定温度下,气体的平均能量一定,但每个气体分子的能量大小不同
(7)标准状况下,恒容密闭容器内不同分子的能量与数目的分布情况如下图表示,其中阴影部分代表活化分子:

若升高温度,图像将最有可能变成(选填下图中的序号,下同)
A.
 B.
B. C.
C.
电解尿素是一种低能耗制
 的方法,总反应:
的方法,总反应: 。
。
(8)写出b电极的电极方程式
(9)已知尿素中
 元素为
元素为 价,一段时间后在
价,一段时间后在 电极收集到标准状况下
电极收集到标准状况下 气体,则整个电路中转移的电子数为
气体,则整个电路中转移的电子数为
您最近一年使用:0次
解题方法
3 . 强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢可构成火箭推进剂.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知:0.4mol液态肼与足量的液态过氧化氢反应生成N2和水蒸气时放出256.0kJ的热量。
(1)该反应的热化学方程式为________________ ;
(2)则16g液态肼与液态过氧化氢反应生成气态水时放出的热量是________________ kJ;
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________ 。
(1)该反应的热化学方程式为
(2)则16g液态肼与液态过氧化氢反应生成气态水时放出的热量是
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
您最近一年使用:0次
4 . 下列叙述正确的是

| A.由图甲可知, 2SO3(g)⇌2SO2(g)+O2(g) ∆H=(b-a)kJ·mol-1 |
| B.图乙表示反应物断键吸收的能量大于生成物成键放出的能量 |
| C.图丙表示燃料燃烧反应的能量变化 |
| D.图丁表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
您最近一年使用:0次
5 . 完成下列填空:
(1) 水解的离子方程式为
水解的离子方程式为_______ ,在配制硫化钠溶液时可以加入少量的_______ (填化学式)以抑制其水解。
(2)硫酸铁水溶液呈_______ 性,原因是_______ 用离子方程式表示)。把 溶液蒸干灼烧,最后得到的主要固体产物是
溶液蒸干灼烧,最后得到的主要固体产物是_______ 。
(3)氢能是一种理想的绿色能源,有科学家预言,氢能有可能成为人类未来的主要能源。高纯氢的制备是目前的研究热点,包括氢的制备、储存和应用三个环节。
①适量 在
在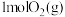 中完全燃烧,生成
中完全燃烧,生成 ,放出
,放出 的热量,请写出表示燃烧热的热化学方程式
的热量,请写出表示燃烧热的热化学方程式_______ 。
②与汽油相比,氢气作为燃料的有点是_______ 。
③下列反应均可获取 。
。
反应I:
反应II: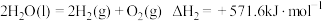
反应III: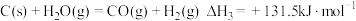
反应IV:
计算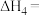
_______ 。
(1)
 水解的离子方程式为
水解的离子方程式为(2)硫酸铁水溶液呈
 溶液蒸干灼烧,最后得到的主要固体产物是
溶液蒸干灼烧,最后得到的主要固体产物是(3)氢能是一种理想的绿色能源,有科学家预言,氢能有可能成为人类未来的主要能源。高纯氢的制备是目前的研究热点,包括氢的制备、储存和应用三个环节。
①适量
 在
在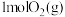 中完全燃烧,生成
中完全燃烧,生成 ,放出
,放出 的热量,请写出表示燃烧热的热化学方程式
的热量,请写出表示燃烧热的热化学方程式②与汽油相比,氢气作为燃料的有点是
③下列反应均可获取
 。
。反应I:

反应II:
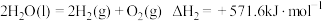
反应III:
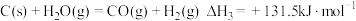
反应IV:

计算
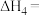
您最近一年使用:0次
6 . 已知:常温常压下,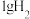 在足量
在足量 中燃烧生成HCl气体,放出92.3kJ热量。下列相关说法
中燃烧生成HCl气体,放出92.3kJ热量。下列相关说法不正确 的是
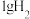 在足量
在足量 中燃烧生成HCl气体,放出92.3kJ热量。下列相关说法
中燃烧生成HCl气体,放出92.3kJ热量。下列相关说法A.一定温度下, 的溶液可能显酸性,也可能显中性或碱性 的溶液可能显酸性,也可能显中性或碱性 |
B.常温常压下,反应: 的 的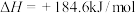 |
C.向稀硫酸中加入少量 ,能够加快Zn与稀硫酸反应的速率 ,能够加快Zn与稀硫酸反应的速率 |
D.常温下,向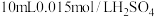 溶液中加入 溶液中加入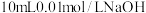 溶液,混合后溶液的 溶液,混合后溶液的 (忽略溶液密度变化) (忽略溶液密度变化) |
您最近一年使用:0次
7 . 下列与t℃时反应: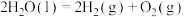
 相关的说法,正确的是
相关的说法,正确的是
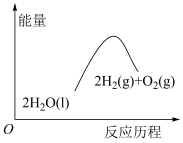
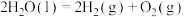
 相关的说法,正确的是
相关的说法,正确的是
A. |
B.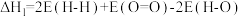 (E表示键能) (E表示键能) |
| C.上图能表示反应物与生成物总能量的相对关系 |
D.t℃时, 的燃烧热 的燃烧热 |
您最近一年使用:0次
8 . 已知:2H2(g) + O2(g) =2H2O(g),2molH2完全反应放出热量483.6 kJ,有关键能数据如下表:
则H-H的键能为(拆开1mol化学键所需吸收的能量叫做键能)
| 化学键 | H-O | O=O |
| 键能(kJ/mol) | 463.4 | 498 |
| A.413kJ/mol | B.557kJ/mol | C.221.6kJ/mol | D.436kJ/mol |
您最近一年使用:0次
2024-03-18更新
|
96次组卷
|
2卷引用:云南省保山市腾冲市第八中学2021-2022学年高二上学期期末考试化学试题
名校
9 . 二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。回答下列问题:
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ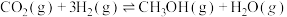
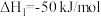
反应ⅱ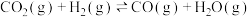

 和
和 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为___________ 。
(2)在催化剂M的作用下,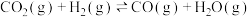 的微观反应历程和相对能量(
的微观反应历程和相对能量( )如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:●表示C,•表示O,○表示H。
)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:●表示C,•表示O,○表示H。
历程Ⅰ:
反应甲: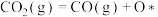
历程Ⅱ: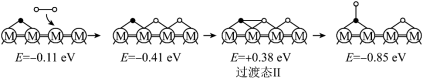
反应乙:___________
历程Ⅲ: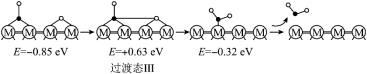
反应丙:
①历程Ⅱ中的反应乙可表示为___________ 。
②决定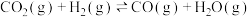 的总反应速率的是历程
的总反应速率的是历程___________ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(3)将 和
和 按物质的量之比
按物质的量之比 充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得
充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得 的平衡转化率随温度、压强变化的情况如图所示。
的平衡转化率随温度、压强变化的情况如图所示。
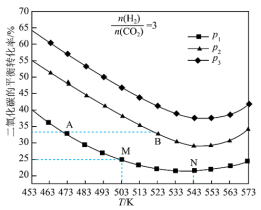
①压强 、
、 、
、 由小到大的顺序为
由小到大的顺序为___________ 。
②B点、A点的化学反应速率大小:
___________ 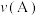 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
③温度高于543K时, 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是___________ 。
④图中M点对应的温度下,已知CO的选择性(生成的CO与转化的CO2的百分比)为40%,该温度下反应ⅱ的平衡常数为___________ (结果保留3位小数)。
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ
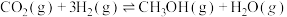
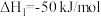
反应ⅱ
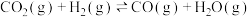

 和
和 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为(2)在催化剂M的作用下,
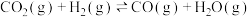 的微观反应历程和相对能量(
的微观反应历程和相对能量( )如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:●表示C,•表示O,○表示H。
)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:●表示C,•表示O,○表示H。历程Ⅰ:

反应甲:
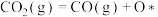
历程Ⅱ:

反应乙:___________
历程Ⅲ:

反应丙:

①历程Ⅱ中的反应乙可表示为
②决定
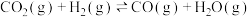 的总反应速率的是历程
的总反应速率的是历程(3)将
 和
和 按物质的量之比
按物质的量之比 充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得
充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得 的平衡转化率随温度、压强变化的情况如图所示。
的平衡转化率随温度、压强变化的情况如图所示。
①压强
 、
、 、
、 由小到大的顺序为
由小到大的顺序为②B点、A点的化学反应速率大小:

 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。③温度高于543K时,
 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是④图中M点对应的温度下,已知CO的选择性(生成的CO与转化的CO2的百分比)为40%,该温度下反应ⅱ的平衡常数为
您最近一年使用:0次
10 . CO2甲醇化(CH3OH)是化学研究的热点之一、回答下列问题:
(1) CO2的氢化反应可生成CH3OH,反应原理为 △H。已知破坏
△H。已知破坏 相关化学键所吸收的能量如下表。
相关化学键所吸收的能量如下表。
①△H=_______ kJ∙mol-1。
②反应中的活化能Ea(正)_______ (填“>”或“<”) Ea(逆),该反应应选择_______ (填“高温”或“低温”)高效催化剂。
③恒温恒容密闭容器中发生反应 ,下列状态能说明该反应达到化学平衡状态的是
,下列状态能说明该反应达到化学平衡状态的是_______ (填字母)。
A.混合气体的密度不再变化
B.CH3OH的百分含量不再变化
C.混合气体的平均相对分子质量不再变化
D.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
(2)在密闭容器中充入3molH2和1molCO2发生上述反应,在不同温度下经过相同时间,H2的转化率如图所示。

①a点时,v(正)_______ (填“>”或“<”) v(逆)。
②若b点时c(CH3OH)=4x mol·L-1,则T2K时反应的平衡常数Kc=_______ 。
③反应达到平衡状态时,若要进一步提高CH3OH体积分数,可采取的措施有_______ (任写一种)。
(3)如图为在室温条件下超快传输的氢负离子导体LaHx,应用于CO2制备CH3OH。
电极a为电源的_______ (填“正极”或“负极”),阳极的电极反应式为_______ 。

(1) CO2的氢化反应可生成CH3OH,反应原理为
 △H。已知破坏
△H。已知破坏 相关化学键所吸收的能量如下表。
相关化学键所吸收的能量如下表。| 化学键 |  |  |  |  |  |
| 能量/( kJ∙mol-1) | 745 | 436 | 463 | 351 | 409 |
②反应中的活化能Ea(正)
③恒温恒容密闭容器中发生反应
 ,下列状态能说明该反应达到化学平衡状态的是
,下列状态能说明该反应达到化学平衡状态的是A.混合气体的密度不再变化
B.CH3OH的百分含量不再变化
C.混合气体的平均相对分子质量不再变化
D.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
(2)在密闭容器中充入3molH2和1molCO2发生上述反应,在不同温度下经过相同时间,H2的转化率如图所示。

①a点时,v(正)
②若b点时c(CH3OH)=4x mol·L-1,则T2K时反应的平衡常数Kc=
③反应达到平衡状态时,若要进一步提高CH3OH体积分数,可采取的措施有
(3)如图为在室温条件下超快传输的氢负离子导体LaHx,应用于CO2制备CH3OH。
电极a为电源的

您最近一年使用:0次