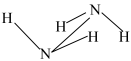
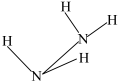
解题方法
1 . I.自热化学链重整制氢CLR(a)工艺的原理如图所示:
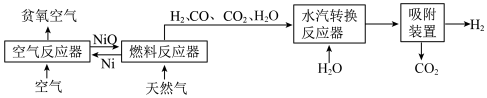
回答下列问题:
(1)25℃、101kPa时,1.0gNi与足量O2反应生成NiO放出8.0kJ的热量,则在“空气反应器”中发生反应的热化学方程式为______ 。
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) △H1=-47.0kJ∙mol−1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) △H2=+137.7kJ∙mol−1
(III)CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=+225.5kJ∙mol−1
则反应CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)的△H=______ kJ∙mol−1.
(3)“水汽转换反应器”中发生的反应为CO(g)+H2O(g) H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正)
H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正)______ υ(逆)(填“>”“=”或“<”),理由是______ 。
(4)甲烷制氢传统工艺有水蒸气重整、部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
水蒸气重整反应:CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+192kJ∙mol−1
部分氧化重整反应:CH4(g)+O2(g)=CO2(g)+2H2(g) △H=-748kJ∙mol−1
采用水蒸气重整的优点是______ ;若上述两个反应在保持自热条件下(假设无热量损失),理论上1molCH4至多可获得H2的物质的量为______ (结果保留1位小数)。
II.请按要求填空。
(5)一种以葡萄糖为燃料的微生物电池,其工作原理如图所示:

①写出负极电极反应式:______ ;
②随着电池不断放电,电解质溶液的酸性______ (填“增大”、“减小”或“不变”)。
(6)查阅资料发现AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,某同学设计了如图实验装置并进行下列实验。
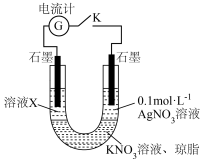
先断开电键K,向溶液X中滴加0.1mol·L-1KSCN溶液,无明显现象,说明______ ;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是______ ,溶液变红的原因是______ 、______ (用电极反应式和离子方程式表示)。
(7)一种新型燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。则通入丁烷的一极的电极反应式为:______ 。

回答下列问题:
(1)25℃、101kPa时,1.0gNi与足量O2反应生成NiO放出8.0kJ的热量,则在“空气反应器”中发生反应的热化学方程式为
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) △H1=-47.0kJ∙mol−1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) △H2=+137.7kJ∙mol−1
(III)CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=+225.5kJ∙mol−1
则反应CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)的△H=
(3)“水汽转换反应器”中发生的反应为CO(g)+H2O(g)
 H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正)
H2(g)+CO2(g)(平衡常数K=0.75),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃时进行转换,水汽转换反应器中某时刻CO、H2O、H2、CO2浓度之比为1:x:2:1,此时υ(正)(4)甲烷制氢传统工艺有水蒸气重整、部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
水蒸气重整反应:CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+192kJ∙mol−1
部分氧化重整反应:CH4(g)+O2(g)=CO2(g)+2H2(g) △H=-748kJ∙mol−1
采用水蒸气重整的优点是
II.请按要求填空。
(5)一种以葡萄糖为燃料的微生物电池,其工作原理如图所示:

①写出负极电极反应式:
②随着电池不断放电,电解质溶液的酸性
(6)查阅资料发现AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,某同学设计了如图实验装置并进行下列实验。

先断开电键K,向溶液X中滴加0.1mol·L-1KSCN溶液,无明显现象,说明
(7)一种新型燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。则通入丁烷的一极的电极反应式为:
您最近一年使用:0次
名校
解题方法
2 . H2O2广泛应用于医疗卫生、化学合成等领域。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) △H1=+akJ•mol-1(a>0)
ii.H2O2(l)+__________。
则ii中反应机理用热化学方程式表示为________ 。
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如表方案完成实验。
I.实验①和②的目的是_______ 。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2较稳定,不易分解,为达到实验目的,你对原方案的改进是_______ 。
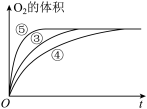
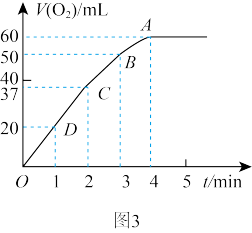
II.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?________ 。
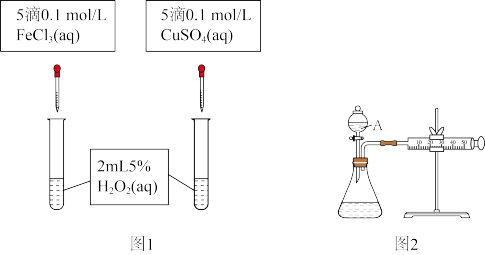
III.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。

①写出H2O2在FeCl3作用下发生反应的化学方程式:________ 。
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论·有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______ 。
③若利用图2实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是_______ 。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) △H1=+akJ•mol-1(a>0)
ii.H2O2(l)+__________。
则ii中反应机理用热化学方程式表示为
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如表方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2%H2O2溶液 | 无 |
| ② | 10mL5%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol/LFeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol/LFeCl3溶液 |
II.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?

III.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。

①写出H2O2在FeCl3作用下发生反应的化学方程式:
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论·有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
③若利用图2实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
您最近一年使用:0次
解题方法
3 . H2O2广泛应用于医疗卫生、化学合成等领域。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)= H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+_______。
则ii中反应机理用热化学方程式表示为_______ 。
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
Ⅰ.实验①和②的目的是_______ 。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下 较稳定,不易分解,为达到实验目的,你对原方案的改进是
较稳定,不易分解,为达到实验目的,你对原方案的改进是_______ 。
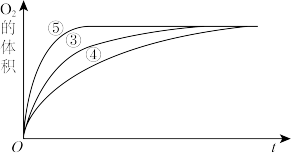
Ⅱ. 实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?
实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?_______ 。
Ⅲ.为比较 和
和 对
对 分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
①写出 在
在 作用下发生反应的化学方程式:
作用下发生反应的化学方程式: _______ 
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论 有同学提出将
有同学提出将 改为
改为 更为合理,其理由是
更为合理,其理由是 _______ ,
③若利用图2实验可进行定理分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是_______ 。
④将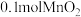 粉末加入50mL
粉末加入50mL  溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:
溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因: _______ , 初始物质的量浓度为
初始物质的量浓度为 _______ (保留两位有效数字)。
(1)已知2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,趣味实验“大象牙膏”的实验原理是H2O2溶液在KI催化作用下分解,反应的机理可表示为:
i.H2O2(l)+I-(aq)= H2O(l)+IO-(aq) △H1 = +a kJ/moL(a > 0)
ii.H2O2(l)+_______。
则ii中反应机理用热化学方程式表示为
(2)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① |  溶液 溶液 | 无 |
| ② | 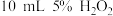 溶液 溶液 | 无 |
| ③ | 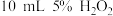 溶液 溶液 | 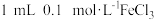 溶液 溶液 |
| ④ | 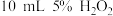 溶液 溶液 少量 HCl溶液 少量 HCl溶液 | 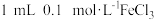 溶液 溶液 |
| ⑤ | 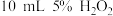 溶液 溶液 少量 NaOH溶液 少量 NaOH溶液 | 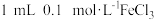 溶液 溶液 |
 较稳定,不易分解,为达到实验目的,你对原方案的改进是
较稳定,不易分解,为达到实验目的,你对原方案的改进是Ⅱ.
 实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?
实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图,结合图分析实验,能够得出什么实验结论?
Ⅲ.为比较
 和
和 对
对 分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
①写出
 在
在 作用下发生反应的化学方程式:
作用下发生反应的化学方程式: 
②利用图1实验,可通过观察产生气泡的快慢定性比较得出结论
 有同学提出将
有同学提出将 改为
改为 更为合理,其理由是
更为合理,其理由是 ③若利用图2实验可进行定理分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
④将
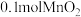 粉末加入50mL
粉末加入50mL  溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:
溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因:  初始物质的量浓度为
初始物质的量浓度为 
您最近一年使用:0次
名校
4 . 完成下列问题
(1)已知:①

 ②
②

则

___________ 。
(2)已知:①

 ②
②

则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

 ,则a=
,则a=___________ 。
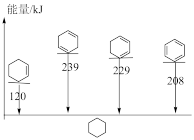
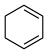
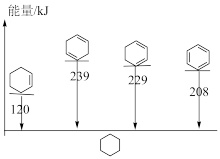
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
___________ ;反应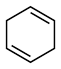 (l)=
(l)= 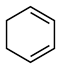 (l)的
(l)的

___________ 。
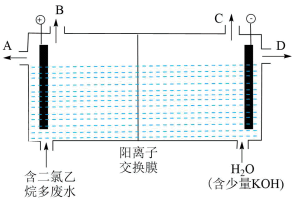
(5)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基(
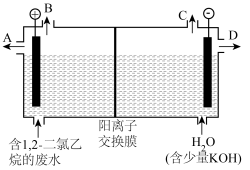
 ),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
___________ ;羟基自由基与二氯乙烷反应的化学方程式为
___________ 。
(1)已知:①

 ②
②

则


(2)已知:①

 ②
②

则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)=  (l)的
(l)的

(5)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基(
 ),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
),羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:
您最近一年使用:0次
2023-10-26更新
|
542次组卷
|
6卷引用:河南省豫北名校2024届高三毕业班上学期一轮复习联考(二)化学试题
解答题-原理综合题
|
适中(0.65)
|
解题方法
5 . 完成下列问题。
(1)已知:①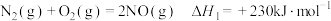
②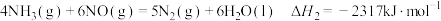
则表示氨气摩尔燃烧焓的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(2)已知几种化学键的键能和热化学方程式如下:
 ,则
,则
___________ 。
(3)4种不饱和烃分别与氢气发生加成反应生成 环己烷(
环己烷( )的能量变化如图所示。根据图示计算反应
)的能量变化如图所示。根据图示计算反应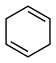 (1)=
(1)= (1)的
(1)的
___________ 。
(4)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基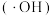 ,羟基自由基再进一步把有机物氧化为无毒物质。下图为电解含1,2-二氯乙烷的废水的装置图,写出电解池阴极的电极反应式:
,羟基自由基再进一步把有机物氧化为无毒物质。下图为电解含1,2-二氯乙烷的废水的装置图,写出电解池阴极的电极反应式:___________ ;羟基自由基与1,2-二氯乙烷反应的化学方程式为___________ 。
(1)已知:①
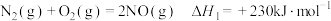
②
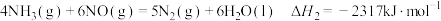
则表示氨气摩尔燃烧焓的热化学方程式为
(2)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能 | 391 | 193 | 243 |  | 432 |
 ,则
,则
(3)4种不饱和烃分别与氢气发生加成反应生成
 环己烷(
环己烷( )的能量变化如图所示。根据图示计算反应
)的能量变化如图所示。根据图示计算反应 (1)=
(1)= (1)的
(1)的

(4)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基
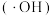 ,羟基自由基再进一步把有机物氧化为无毒物质。下图为电解含1,2-二氯乙烷的废水的装置图,写出电解池阴极的电极反应式:
,羟基自由基再进一步把有机物氧化为无毒物质。下图为电解含1,2-二氯乙烷的废水的装置图,写出电解池阴极的电极反应式:
您最近一年使用:0次
6 . Ⅰ.(1) P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 =___________ 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为____________________________ 。
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
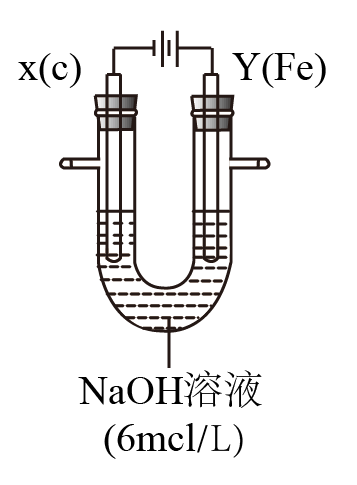
(4)电解过程中,X极区溶液的pH____________ (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和___________________ 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少___________ g。
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g)
 CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 =
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。

(4)电解过程中,X极区溶液的pH
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
您最近一年使用:0次
2016-12-09更新
|
122次组卷
|
3卷引用:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷
7 . 联氨(N2H4)又称“肼”,具高吸湿性、沸点386.5K、毒性强、还原性强等特性,燃烧释放出大量的热,常用于做火箭的燃料以及分析试剂中的还原剂。
I.联氨的制备
(1)联氨可用次氯酸钠溶液氧化过量的氨气制得,写出此反应得离子方程式___________ ;此反应中,被氧化的元素是_____ 。每生成1mol肼,转移的电子数为________ 。
Ⅱ .联氨的结构
(2)联氨具强极性,推测下列结构最接近联氨分子真实结构的是________ 。
Ⅲ .联氨的性质
(3)①一定条件下, 联氨与二氯化钴(CoCl2)溶液能形成配位化合物Co(N2H4)6Cl2,关于此配位化合物的下列说法中不正确的是_____ 。
A.中心离子是Co2+ B.配位数是8
C.配位原子是N原子 D.向此配合物的溶液中滴入硝酸银,会产生白色沉淀
②联氨具高吸湿性,原因是_____ 。
③联氨水溶液与氨水类性质相似,将联氨溶于一定浓度的稀硫酸中,除形成N2H6SO4外,还可以生成的盐是_____ (填写化学式)。实验发现0.1mol·L-1N2H6SO4溶液显酸性,原因是_____ (用离子方程式表示),溶液中各种含氮微粒存在关系c(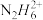 )+c(N2H6OH+)
)+c(N2H6OH+)____ 0.1-c(N2H4·2H2O)(选填“>”,“<”或“=”)。
(4)1mol液态联氨在空气中完全燃烧生成氮气和水蒸气放出621.74KJ的热量,此反应的热化学方程式是_______ 。肼有剧毒,但目前仍被普遍用作火箭的燃料,原因是________ 。
(5)联氨在一定条件下被亚硝酸氧化为叠氮酸(HN3),室温下亚硝酸、叠氮酸的电离平衡常数如表所示:
室温下,则同浓度的HNO2和HN3,其pH值:HNO2____ HN3(选填“>”、“<”或“=”),  反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为
反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为_________ 。
(6)某研究小组研究联氨和双氧水反应,查阅相关键能数据
并已知1molN2H4(l)→N2H4(g)与2molH2O2(l)→H2O2(g)共吸热23.76kJ,据此估算化学反应N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)的焓变ΔH=_______ kJ·mol-1,反应的熵变ΔS _____ 0(选填“>”、“<”)。研究小组利用此反应设计出如下电池,负极电极反应式:N2H4+4OH-−4e-=N2+4H2O。则正极电极反应式:________ 。
I.联氨的制备
(1)联氨可用次氯酸钠溶液氧化过量的氨气制得,写出此反应得离子方程式
Ⅱ .联氨的结构
(2)联氨具强极性,推测下列结构最接近联氨分子真实结构的是
|
|
| A. 反式结构 | B. 顺式结构 |
Ⅲ .联氨的性质
(3)①一定条件下, 联氨与二氯化钴(CoCl2)溶液能形成配位化合物Co(N2H4)6Cl2,关于此配位化合物的下列说法中不正确的是
A.中心离子是Co2+ B.配位数是8
C.配位原子是N原子 D.向此配合物的溶液中滴入硝酸银,会产生白色沉淀
②联氨具高吸湿性,原因是
③联氨水溶液与氨水类性质相似,将联氨溶于一定浓度的稀硫酸中,除形成N2H6SO4外,还可以生成的盐是
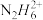 )+c(N2H6OH+)
)+c(N2H6OH+)(4)1mol液态联氨在空气中完全燃烧生成氮气和水蒸气放出621.74KJ的热量,此反应的热化学方程式是
(5)联氨在一定条件下被亚硝酸氧化为叠氮酸(HN3),室温下亚硝酸、叠氮酸的电离平衡常数如表所示:
| 酸名 | 亚硝酸(HNO2) | 叠氮酸(HN3) |
| 电离平衡常数 | 5.1 x 10-4 | 1.8 x 10-5 |
 反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为
反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为(6)某研究小组研究联氨和双氧水反应,查阅相关键能数据
| 化学键 | N-H | O-H | O-O | N-N | N≡N |
| 键能(kJ·mol-1) | 391 | 467 | 138 | 159 | 945 |
您最近一年使用:0次
名校
8 . 雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺是当前国内外研究的热点。
(1)天然气中含有的微量H2S会腐蚀管道和设备,在1200℃下进行脱硫处理,H2S会被氧气氧化为SO2,并产生水蒸气。
请写出该条件下反应的热化学方程式:_______ 。
(2)已知物质的氧化性或还原性强弱与溶液的pH有关。利用 NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝,将NO、SO2氧化为硝酸和硫酸而除去。在温度一定时, 、溶液pH对脱硫脱硝的影响如图所示:
、溶液pH对脱硫脱硝的影响如图所示:
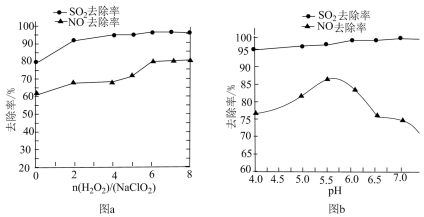
①从图a和图b中可知脱硫脱硝最佳 是
是_______ 、最佳pH是_______ 。
②图b中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因_______ 。
(3)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为 2NO2(g)+O3(g) N2O5(g)+O2(g),不同温度下,在体积为1 L的甲、乙两个恒容密闭容器中均充入l mol O3和2 mol NO2,相关信息如下图所示,请回答下列问题:
N2O5(g)+O2(g),不同温度下,在体积为1 L的甲、乙两个恒容密闭容器中均充入l mol O3和2 mol NO2,相关信息如下图所示,请回答下列问题:
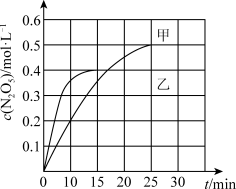
0~10 min内甲容器中反应的平均速率:v(NO2)=_______ mol·L-1·min-1
(1)天然气中含有的微量H2S会腐蚀管道和设备,在1200℃下进行脱硫处理,H2S会被氧气氧化为SO2,并产生水蒸气。
| 化学键 | H-S | O=O | H-O | SO2中共价键 |
| 键能/(kJ▪mol-1) | 339 | 498 | 464 | 1083 |
请写出该条件下反应的热化学方程式:
(2)已知物质的氧化性或还原性强弱与溶液的pH有关。利用 NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝,将NO、SO2氧化为硝酸和硫酸而除去。在温度一定时,
 、溶液pH对脱硫脱硝的影响如图所示:
、溶液pH对脱硫脱硝的影响如图所示:
①从图a和图b中可知脱硫脱硝最佳
 是
是②图b中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因
(3)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为 2NO2(g)+O3(g)
 N2O5(g)+O2(g),不同温度下,在体积为1 L的甲、乙两个恒容密闭容器中均充入l mol O3和2 mol NO2,相关信息如下图所示,请回答下列问题:
N2O5(g)+O2(g),不同温度下,在体积为1 L的甲、乙两个恒容密闭容器中均充入l mol O3和2 mol NO2,相关信息如下图所示,请回答下列问题:
0~10 min内甲容器中反应的平均速率:v(NO2)=
您最近一年使用:0次
9 . I.回答下列问题:
(1)有下列反应:Fe+Cu2+=Fe2++Cu;2Fe3++Cu=2Fe2++Cu2+;在Cu2+、Fe2+、Fe3+中,其氧化性由强到弱顺序为____ 。
(2)根据反应MnO2+4HCl MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:
①反应中n(还原剂):n(氧化剂)=____ 。
②该反应中盐酸的作用是____ (填字母)。
A.只氧化性 B.只有酸性 C.只有还原性 D.有氧化性也有酸性 E.有还原性也有酸性
③在方程式上用单线桥表示上述反应电子转移的方向和数目____ 。
MnO2+4HCl=MnCl2+Cl2↑+2H2O
④配平方程式:____ 。
______MnO +______C2O
+______C2O +______H+=______Mn2++______CO2↑+______H2O
+______H+=______Mn2++______CO2↑+______H2O
II.有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
(3)在101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题。
①氢气燃烧热的热化学方程式为____ 。
②若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ•mol-1,O=O键能为498kJ•mol-1,计算H-H键能为____ kJ•mol-1。
(4)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) △H1=-74.5kJ•mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=-64.4kJ•mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) △H3。
则△H3=____ kJ•mol-1。
(1)有下列反应:Fe+Cu2+=Fe2++Cu;2Fe3++Cu=2Fe2++Cu2+;在Cu2+、Fe2+、Fe3+中,其氧化性由强到弱顺序为
(2)根据反应MnO2+4HCl
 MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:①反应中n(还原剂):n(氧化剂)=
②该反应中盐酸的作用是
A.只氧化性 B.只有酸性 C.只有还原性 D.有氧化性也有酸性 E.有还原性也有酸性
③在方程式上用单线桥表示上述反应电子转移的方向和数目
MnO2+4HCl=MnCl2+Cl2↑+2H2O
④配平方程式:
______MnO
 +______C2O
+______C2O +______H+=______Mn2++______CO2↑+______H2O
+______H+=______Mn2++______CO2↑+______H2OII.有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
(3)在101kPa下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题。
①氢气燃烧热的热化学方程式为
②若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ•mol-1,O=O键能为498kJ•mol-1,计算H-H键能为
(4)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) △H1=-74.5kJ•mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2=-64.4kJ•mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) △H3。
则△H3=
您最近一年使用:0次
名校
10 . Ⅰ.将氮氧化物进行无害化处理对治理大气污染、建设生态文明具有重要意义。
(1) 的氧化性强于
的氧化性强于 ,能更有效地氧化NO。已知:
,能更有效地氧化NO。已知:

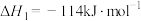

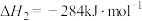
则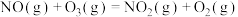
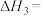
______  。
。
(2)在汽车排气管上安装催化转化器,能有效消除尾气对环境的污染:
①
 ,反应能自发进行所需温度条件
,反应能自发进行所需温度条件_______ (填“高温”或“低温”)。
②已知:反应
 ,
, 和CO在
和CO在 作用下发生的反应分两步进行:
作用下发生的反应分两步进行:
第一步;
第二步:
反应过程的能量变化如图所示:
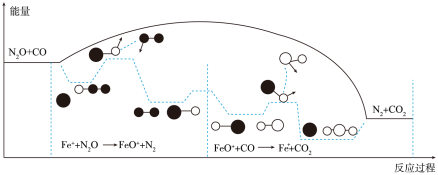
决定总反应速率的是________ (填“第一步”或“第二步)
(3)某温度下,在催化剂的作用下发生反应: ,测得密闭容器中不同时间时CO和NO的浓度如表。
,测得密闭容器中不同时间时CO和NO的浓度如表。
①温度下,该反应的平衡常数为______ 。
②该恒温恒容条件下,下列能说明该反应达到化学平衡状态的是________ (填序号)。
a.体系的压强保持不变 b.
c.混合气体的密度不变 d.NO的转化率保持不变
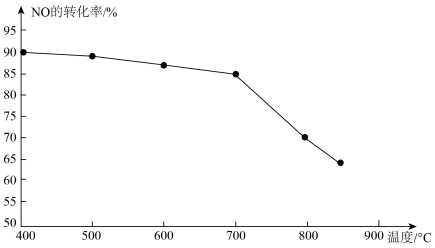
③恒容条件下,上述反应中若NO和CO的起始浓度一定,催化反应相同时间,测得NO的转化率随温度的变化如图所示,当温度超过700℃时,随温度的升高,NO的转化率下降明显,原因是________ 。
Ⅱ.由于亚硝酸钠和食盐性状相似,曾多次发生过将 误当食盐食用的事件。欲测定某样品中
误当食盐食用的事件。欲测定某样品中 的含量,某同学设计如下实验:①称取样品ag,加水溶解,配制成100mL溶液。②取25.00mL溶液于锥形概中,用
的含量,某同学设计如下实验:①称取样品ag,加水溶解,配制成100mL溶液。②取25.00mL溶液于锥形概中,用 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液VmL。
溶液VmL。
(4)在进行滴定操作时, 溶液盛装在
溶液盛装在_____ (填“酸式”或“碱式”)滴定管中。当滴入最后半滴 溶液,
溶液,_______ 时达到滴定终点。
(5)以下操作造成测定结果偏高的是________。
(6)滴定过程中发生反应的离子方程式是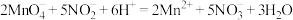 ,测得该样品中
,测得该样品中 的质量分数为
的质量分数为______ 。( 的摩尔质量
的摩尔质量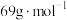 )
)
(1)
 的氧化性强于
的氧化性强于 ,能更有效地氧化NO。已知:
,能更有效地氧化NO。已知:
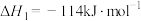

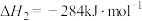
则
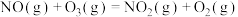
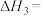
 。
。(2)在汽车排气管上安装催化转化器,能有效消除尾气对环境的污染:
①

 ,反应能自发进行所需温度条件
,反应能自发进行所需温度条件②已知:反应

 ,
, 和CO在
和CO在 作用下发生的反应分两步进行:
作用下发生的反应分两步进行:第一步;

第二步:

反应过程的能量变化如图所示:

决定总反应速率的是
(3)某温度下,在催化剂的作用下发生反应:
 ,测得密闭容器中不同时间时CO和NO的浓度如表。
,测得密闭容器中不同时间时CO和NO的浓度如表。| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
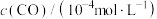 | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
 | 10.0 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
②该恒温恒容条件下,下列能说明该反应达到化学平衡状态的是
a.体系的压强保持不变 b.

c.混合气体的密度不变 d.NO的转化率保持不变
③恒容条件下,上述反应中若NO和CO的起始浓度一定,催化反应相同时间,测得NO的转化率随温度的变化如图所示,当温度超过700℃时,随温度的升高,NO的转化率下降明显,原因是

Ⅱ.由于亚硝酸钠和食盐性状相似,曾多次发生过将
 误当食盐食用的事件。欲测定某样品中
误当食盐食用的事件。欲测定某样品中 的含量,某同学设计如下实验:①称取样品ag,加水溶解,配制成100mL溶液。②取25.00mL溶液于锥形概中,用
的含量,某同学设计如下实验:①称取样品ag,加水溶解,配制成100mL溶液。②取25.00mL溶液于锥形概中,用 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液VmL。
溶液VmL。(4)在进行滴定操作时,
 溶液盛装在
溶液盛装在 溶液,
溶液,(5)以下操作造成测定结果偏高的是________。
A.滴定管未用 标准溶液润洗 标准溶液润洗 |
| B.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失 |
| C.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数 |
| D.若滴定过程中刚出现颜色变化就停止滴定 |
(6)滴定过程中发生反应的离子方程式是
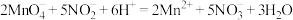 ,测得该样品中
,测得该样品中 的质量分数为
的质量分数为 的摩尔质量
的摩尔质量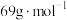 )
)
您最近一年使用:0次