1 . 已知:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H1=-akJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2=-bkJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H3=-ckJ·mol-1
则下列叙述正确的是
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2=-bkJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H3=-ckJ·mol-1
则下列叙述正确的是
| A.由上述热化学方程式可知△H2<△H3 |
| B.甲烷的燃烧热为bkJ·mol-l |
| C. 2CH3OH(g)=2CH4(g)+O2(g) △H=2(b-a)kJ/mol-1 |
| D.当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O(l)时,放出的热量为QkJ,则该混合物中甲醇的物质的量为Q/(a+2b)mol |
您最近半年使用:0次
2022-11-22更新
|
201次组卷
|
2卷引用:四川省成都外国语学校2022-2023学年高二上学期期中考试化学试题
名校
解题方法
2 . 研究含碳、氮的物质间转化的热效应,在日常生活与工业生产中均有很重要的意义。
(1)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。
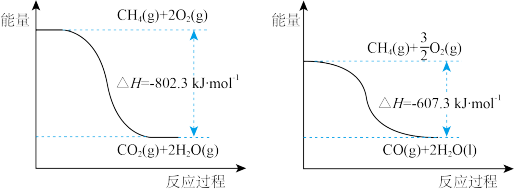
①写出表示甲烷燃烧热的热化学方程式:_______ 。
②CO的燃烧热△H=_______ kJ·mol-1。
(2)已知拆开1 molH-H、1 molN-H、1 mol N ≡N化学键需要的能量分别是436 kJ、391kJ、946kJ, 则N2与H2反应生成NH3的热化学方程式为_______ 。
(3)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。
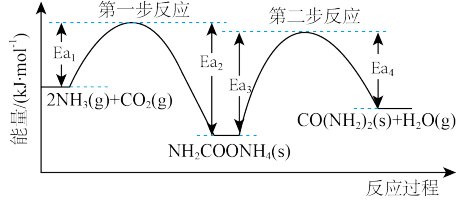
①第一步反应的热化学方程式为_______ 。
②第二步反应的△H_______ 0(填“>”、“<”或“=”)。
③从图象分析决定生产尿素的总反应的反应速率的步骤是第_______ 步反应。
(1)已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:
②CO的燃烧热△H=
(2)已知拆开1 molH-H、1 molN-H、1 mol N ≡N化学键需要的能量分别是436 kJ、391kJ、946kJ, 则N2与H2反应生成NH3的热化学方程式为
(3)以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。

①第一步反应的热化学方程式为
②第二步反应的△H
③从图象分析决定生产尿素的总反应的反应速率的步骤是第
您最近半年使用:0次
2022-09-06更新
|
800次组卷
|
6卷引用:河南省濮阳市2021-2022学年高二上学期期末学业质量监测化学试题
真题
解题方法
3 . 某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应: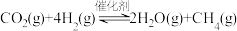
回答问题:
(1)已知:电解液态水制备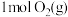 ,电解反应的
,电解反应的 。由此计算
。由此计算 的燃烧热(焓)
的燃烧热(焓)
_______  。
。
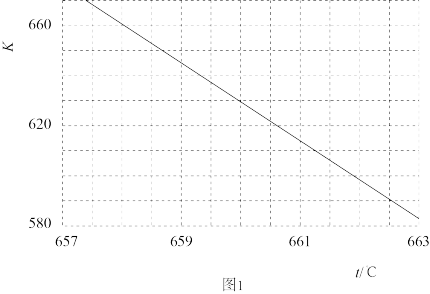
(2)已知: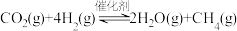 的平衡常数(K)与反应温度(t)之间的关系如图1所示。
的平衡常数(K)与反应温度(t)之间的关系如图1所示。
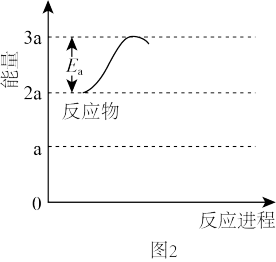
①若反应为基元反应,且反应的 与活化能(Ea)的关系为
与活化能(Ea)的关系为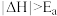 。补充完成该反应过程的能量变化示意图(图2)
。补充完成该反应过程的能量变化示意图(图2)_______ 。
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入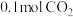 和
和 ,反应平衡后测得容器中
,反应平衡后测得容器中 。则
。则 的转化率为
的转化率为_______ ,反应温度t约为_______ ℃。
(3)在相同条件下, 与
与 还会发生不利于氧循环的副反应:
还会发生不利于氧循环的副反应: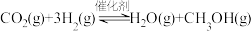 ,在反应器中按
,在反应器中按 通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中
通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中 、
、 浓度(
浓度(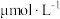 )如下表所示。
)如下表所示。
在选择使用催化剂Ⅰ和350℃条件下反应,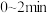 生成
生成 的平均反应速率为
的平均反应速率为_______ 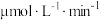 ;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是_______ 。
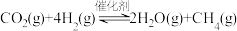
回答问题:
(1)已知:电解液态水制备
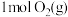 ,电解反应的
,电解反应的 。由此计算
。由此计算 的燃烧热(焓)
的燃烧热(焓)
 。
。(2)已知:
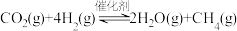 的平衡常数(K)与反应温度(t)之间的关系如图1所示。
的平衡常数(K)与反应温度(t)之间的关系如图1所示。
①若反应为基元反应,且反应的
 与活化能(Ea)的关系为
与活化能(Ea)的关系为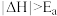 。补充完成该反应过程的能量变化示意图(图2)
。补充完成该反应过程的能量变化示意图(图2)
②某研究小组模拟该反应,温度t下,向容积为10L的抽空的密闭容器中通入
 和
和 ,反应平衡后测得容器中
,反应平衡后测得容器中 。则
。则 的转化率为
的转化率为(3)在相同条件下,
 与
与 还会发生不利于氧循环的副反应:
还会发生不利于氧循环的副反应: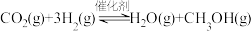 ,在反应器中按
,在反应器中按 通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中
通入反应物,在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中 、
、 浓度(
浓度( )如下表所示。
)如下表所示。| 催化剂 | t=350℃ | t=400℃ | ||
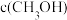 |  |  | 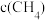 | |
| 催化剂Ⅰ | 10.8 | 12722 | 345.2 | 42780 |
| 催化剂Ⅱ | 9.2 | 10775 | 34 | 38932 |
 生成
生成 的平均反应速率为
的平均反应速率为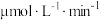 ;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是
;若某空间站的生命保障系统实际选择使用催化剂Ⅱ和400℃的反应条件,原因是
您最近半年使用:0次
2022-07-04更新
|
7801次组卷
|
10卷引用:2022年海南省高考真题化学试题
2022年海南省高考真题化学试题(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编(已下线)2022年海南省高考真题变式题15-19(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十二 原理应用中的新概念(已下线)第一部分 二轮专题突破 大题突破1 化学反应原理综合题题型研究(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)章末检测卷(二) 化学反应速率与化学平衡
2022高三·全国·专题练习
4 . 氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1) 时,
时,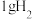 燃烧生成
燃烧生成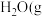 )放热
)放热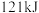 ,
, 蒸发吸热
蒸发吸热 ,表示
,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ.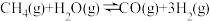
Ⅱ.
①下列操作中,能提高 平衡转化率的是
平衡转化率的是_______ (填标号)。
A.增加 用量 B.恒温恒压下通入惰性气体
用量 B.恒温恒压下通入惰性气体
C.移除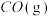 D.加入催化剂
D.加入催化剂
②恒温恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为
的物质的量为 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
_______ (写出含有α、b的计算式;对于反应 ,
,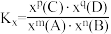 ,x为物质的量分数)。其他条件不变,
,x为物质的量分数)。其他条件不变, 起始量增加到
起始量增加到 ,达平衡时,
,达平衡时,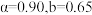 ,平衡体系中
,平衡体系中 的物质的量分数为
的物质的量分数为_______ (结果保留两位有效数字)。
(3)氢氧燃料电池中氢气在_______ (填“正”或“负”)极发生反应。
(4)在允许 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中,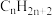 放电的电极反应式为
放电的电极反应式为_______ 。
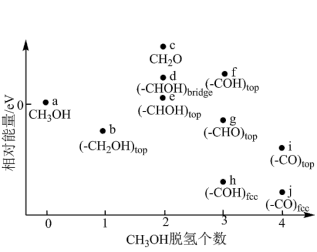
(5)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→_______ (用 等代号表示)。
等代号表示)。
(1)
 时,
时, 燃烧生成
燃烧生成 )放热
)放热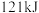 ,
, 蒸发吸热
蒸发吸热 ,表示
,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
Ⅰ.
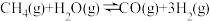
Ⅱ.

①下列操作中,能提高
 平衡转化率的是
平衡转化率的是A.增加
 用量 B.恒温恒压下通入惰性气体
用量 B.恒温恒压下通入惰性气体C.移除
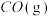 D.加入催化剂
D.加入催化剂②恒温恒压条件下,1molCH4(g)和1molH2O(g)反应达平衡时,
 的转化率为
的转化率为 ,
, 的物质的量为
的物质的量为 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
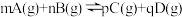 ,
,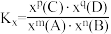 ,x为物质的量分数)。其他条件不变,
,x为物质的量分数)。其他条件不变, 起始量增加到
起始量增加到 ,达平衡时,
,达平衡时,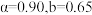 ,平衡体系中
,平衡体系中 的物质的量分数为
的物质的量分数为(3)氢氧燃料电池中氢气在
(4)在允许
 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中,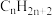 放电的电极反应式为
放电的电极反应式为(5)甲醇燃料电池中,吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步可能脱氢产物及其相对能量如图,则最可行途径为a→
 等代号表示)。
等代号表示)。
您最近半年使用:0次
2022-07-01更新
|
9871次组卷
|
9卷引用:2022年新高考河北省高考真题化学试题(部分试题)
(已下线)2022年新高考河北省高考真题化学试题(部分试题)2022年河北省高考真题化学试题(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编(已下线)热点情景汇编-专题十二 原理应用中的新概念(已下线)2022年河北省高考真题变式题(14-18)(已下线)专题17 原理综合题(已下线)专题17 原理综合题陕西省西安市西北工业大学附属中学2023-2024学年高二上学期第一次月考化学试题天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷
5 . 苯乙烯是一种重要的有机化工原料,可广泛用于合成橡胶,工程塑料及制药等。工业上可通过乙苯催化脱氢来制取苯乙烯,反应方程式如下:
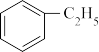 (g)
(g)
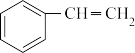 (g)+H2(g) ΔH
(g)+H2(g) ΔH
(1)已知部分物质的燃烧热数据如下表:
则
_______ 。
(2)下列关于反应的说法正确的是_______(填序号)
(3)工业装置通常采用铁基氧化物催化剂,通入过热水蒸气(615~645℃)、水油比(水与乙苯质量比)1.4~1.8、常压的条件下发生乙苯的催化脱氢反应。
①反应中通入水蒸气的作用是_______ 。
②将物质的量分数组成为m%乙苯(g)、n% 的气体通入反应器,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
的气体通入反应器,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,则苯乙烯的分压为
,则苯乙烯的分压为_______ ,平衡常数
_______ (以分压表示,分压=总压×物质的量分数)
(4)近年来,有研究者发现若将上述生产过程中通入 改为通入
改为通入 ,通入
,通入 后会发生反应
后会发生反应 。在常压下,分别按投料比为仅乙苯,乙苯
。在常压下,分别按投料比为仅乙苯,乙苯 ,乙苯
,乙苯 ,测得乙苯的平衡转化率与温度的关系如下图。
,测得乙苯的平衡转化率与温度的关系如下图。
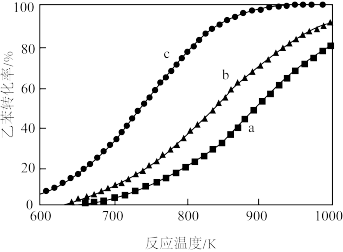
则乙苯 对应的曲线为
对应的曲线为_______ (填“a”,“b”或“c”),理由是_______ 。
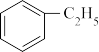 (g)
(g)
 (g)+H2(g) ΔH
(g)+H2(g) ΔH(1)已知部分物质的燃烧热数据如下表:
| 物质 | 乙苯 | 苯乙烯 | 氢气 |
燃烧热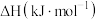 | -4610.2 | -4441.8 | -285.8 |

(2)下列关于反应的说法正确的是_______(填序号)
| A.高温有利于反应自发进行 |
| B.工业生产中应尽可能提高反应温度,并增大压强,以提高原料的利用率 |
| C.恒温恒容条件下,反应达到平衡后,向体系中再充入乙苯蒸气,乙苯的转化率将增大 |
| D.选择合适的催化剂可以缩短达到平衡的时间,但不会提高生成物中苯乙烯的含量 |
①反应中通入水蒸气的作用是
②将物质的量分数组成为m%乙苯(g)、n%
 的气体通入反应器,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
的气体通入反应器,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,则苯乙烯的分压为
,则苯乙烯的分压为
(4)近年来,有研究者发现若将上述生产过程中通入
 改为通入
改为通入 ,通入
,通入 后会发生反应
后会发生反应 。在常压下,分别按投料比为仅乙苯,乙苯
。在常压下,分别按投料比为仅乙苯,乙苯 ,乙苯
,乙苯 ,测得乙苯的平衡转化率与温度的关系如下图。
,测得乙苯的平衡转化率与温度的关系如下图。
则乙苯
 对应的曲线为
对应的曲线为
您最近半年使用:0次
6 . 与研究物质变化一样,研究化学反应中的能量变化,同样具有重要意义。请回答:
(1)已知二甲醚(CH3OCH3,常温下呈气态),H2的燃烧热分别为1455kJ/mol、286kJ/mol。请写出表示二甲醚燃烧热的热化学方程式____ 。利用二甲醚制取H2,总反应为CH3OCH3(g)+3H2O(g) 6H2(g)+2CO2(g)。已知H2O(g)=H2O(l) △H=-44kJ/mol,则总反应的△H=
6H2(g)+2CO2(g)。已知H2O(g)=H2O(l) △H=-44kJ/mol,则总反应的△H=___ 。总反应能自发进行的条件是___ (选填“高温”“低温”或“任意温度”)。
(2)二甲醚制H2的总反应分两步完成:
二甲醚水解:CH3OCH3(g)+H2O(g) 2CH3OH(g) 活化能Ea1
2CH3OH(g) 活化能Ea1
甲醇与水蒸气重整:CH3OH(g)+H2O(g) CO2(g)+3H2(g) 活化能Ea2
CO2(g)+3H2(g) 活化能Ea2
已知Ea1远小于Ea2。在恒温恒容容器内,一甲醚与水按1∶3投料进行制氢,请在图中画出甲醇(CH3OH)浓度随时间变化的曲线图___ 。
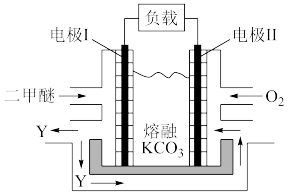
(3)二甲醚直接燃料电池具有启动快、效率高等优点。某二甲醚熔融碳酸钾燃料电池的结构如图所示,Y为氧化物。负极的电极方程式为___ 。
(1)已知二甲醚(CH3OCH3,常温下呈气态),H2的燃烧热分别为1455kJ/mol、286kJ/mol。请写出表示二甲醚燃烧热的热化学方程式
 6H2(g)+2CO2(g)。已知H2O(g)=H2O(l) △H=-44kJ/mol,则总反应的△H=
6H2(g)+2CO2(g)。已知H2O(g)=H2O(l) △H=-44kJ/mol,则总反应的△H=(2)二甲醚制H2的总反应分两步完成:
二甲醚水解:CH3OCH3(g)+H2O(g)
 2CH3OH(g) 活化能Ea1
2CH3OH(g) 活化能Ea1甲醇与水蒸气重整:CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) 活化能Ea2
CO2(g)+3H2(g) 活化能Ea2已知Ea1远小于Ea2。在恒温恒容容器内,一甲醚与水按1∶3投料进行制氢,请在图中画出甲醇(CH3OH)浓度随时间变化的曲线图

(3)二甲醚直接燃料电池具有启动快、效率高等优点。某二甲醚熔融碳酸钾燃料电池的结构如图所示,Y为氧化物。负极的电极方程式为

您最近半年使用:0次
名校
7 . 化学用语是学习化学的重要工具,下列化学用语中正确的是
A.泡沫灭火器灭火原理的离子方程式: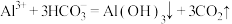 |
B.用KI溶液将AgCl沉淀转化为AgI的离子方程式: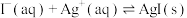 |
C. 在水中电离: 在水中电离: |
D.CO的燃烧热为283.0 kJ/mol,则CO燃烧热的热化学方程式: 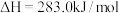 |
您最近半年使用:0次
2022-01-23更新
|
213次组卷
|
2卷引用:广东省普通高中阶段性联合测评2021-2022学年高二上学期省级联考化学试题
解题方法
8 . (1)某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。
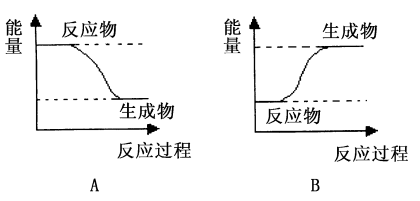
若E1>E2,则该反应为___ (填“放热”或“吸热”)反应。该反应可用图___ (填“A”或“B”)表示。
(2)燃烧1molCH4(气),生成CO2(气)和H2O(液),放出890.3kJ热量。写出该反应的热化学方程式___ 。

若E1>E2,则该反应为
(2)燃烧1molCH4(气),生成CO2(气)和H2O(液),放出890.3kJ热量。写出该反应的热化学方程式
您最近半年使用:0次
名校
解题方法
9 . 化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫作反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列∆H表示物质燃烧热的是_______ ;不能表示物质中和热的是_______ 。(填字母)
A.H2(g)+ O2(g)=2H2O(g) ∆H1
O2(g)=2H2O(g) ∆H1
B.C(s)+ O2(g)=CO(g) ∆H2
O2(g)=CO(g) ∆H2
C.CH4(g)+2O2g)=CO2(g)+2H2O(l) ∆H3
D.C(s)+O2(g)=CO2(g) ∆H4
E.C6H12O6(s)+3O2(g)=6CO(g)+6H2O(1) ∆H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ∆H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ∆H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ∆H8
(2)2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.8kJ的热量,写出该反应燃烧热的热化学方程式:_______
(3)充分燃烧一定量的丁烷放出的热量为Q,生成的CO2恰好与100mL浓度为4mol∙L-1的KOH溶液完全反应生成正盐。则燃烧lmol丁烷放出的热量为_______ 。
(4)4.4g丙烷完全燃烧生成的CO2与100 mL浓度为4mol∙L-1的KOH溶液恰好完全反应,则反应后的溶液中酸式盐的物质的量是_______ mol
(5)氢能源有可能实现能源的贮存,也有可能实现经济,高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如,LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.65、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附840体积的氢气(钯粉的密度为10.64g∙cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式_____ 。
(1)下列∆H表示物质燃烧热的是
A.H2(g)+
 O2(g)=2H2O(g) ∆H1
O2(g)=2H2O(g) ∆H1 B.C(s)+
 O2(g)=CO(g) ∆H2
O2(g)=CO(g) ∆H2C.CH4(g)+2O2g)=CO2(g)+2H2O(l) ∆H3
D.C(s)+O2(g)=CO2(g) ∆H4
E.C6H12O6(s)+3O2(g)=6CO(g)+6H2O(1) ∆H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ∆H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ∆H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ∆H8
(2)2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.8kJ的热量,写出该反应燃烧热的热化学方程式:
(3)充分燃烧一定量的丁烷放出的热量为Q,生成的CO2恰好与100mL浓度为4mol∙L-1的KOH溶液完全反应生成正盐。则燃烧lmol丁烷放出的热量为
(4)4.4g丙烷完全燃烧生成的CO2与100 mL浓度为4mol∙L-1的KOH溶液恰好完全反应,则反应后的溶液中酸式盐的物质的量是
(5)氢能源有可能实现能源的贮存,也有可能实现经济,高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如,LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.65、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附840体积的氢气(钯粉的密度为10.64g∙cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式
您最近半年使用:0次
名校
10 . 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得较高反应速率,反应过程如图:
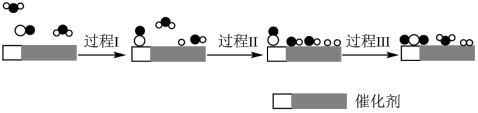
| A.若已知CO和H2的标准燃烧热,由此可推算出该反应的ΔH |
| B.过程Ⅰ、过程Ⅱ均为吸热过程,且吸收的热量相等 |
| C.在该反应过程中,实际有两个H2O参与反应,断裂了三个氢氧键 |
| D.使用催化剂降低了水煤气变换反应的ΔH,提高了反应速率 |
您最近半年使用:0次
2020-05-07更新
|
480次组卷
|
2卷引用:浙江省台州市2020届高三4月教学质量评估化学试题



