1 . 研究电解质在水溶液中的平衡能了解它的存在形式。已知部分弱酸的电离常数如下表:
(1)①常温下,pH相同的三种溶液HF、H2CO3、H2S,物质的量浓度最小的是_______ 。
②将少量H2S通入Na2CO3溶液,反应的离子方程式是_______ 。
③0.1mol·L-1的HF溶液,其电离百分数为8%,则该溶液的pH=_______ (已知lg2=0.3)
(2)25℃时,向足量的NaCN溶液中通入少量CO2,所发生反应的离子方程式为_______ 。
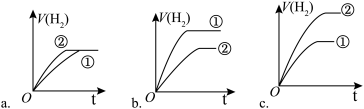
(3)pH相同、体积相同的盐酸和氢氟酸两种溶液盐酸分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______ (填字母)。(①表示盐酸,②表示氢氟酸)
(4)烟气中的SO2可引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过程中,溶液中H2SO3、 、
、 三者所占物质的量分数(a)随pH变化的关系如图所示。由图可知H2SO3第一级电离平衡常数Ka1=
三者所占物质的量分数(a)随pH变化的关系如图所示。由图可知H2SO3第一级电离平衡常数Ka1=_______ 。

(5)25℃,101KPa时,1g氢气完全燃烧生成液态水,放出142.9kJ热量,请写出氢气燃烧热的热化学方程式_______ (结果取整数)。
| 化学式 | HF | H2CO3 | H2S | HCN |
| 电离平衡常数K(25℃) | 7.2×10-4 | Ka1=4.4×10-7 Ka2=9.1×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-11 | K=4.9×10-10 |
(1)①常温下,pH相同的三种溶液HF、H2CO3、H2S,物质的量浓度最小的是
②将少量H2S通入Na2CO3溶液,反应的离子方程式是
③0.1mol·L-1的HF溶液,其电离百分数为8%,则该溶液的pH=
(2)25℃时,向足量的NaCN溶液中通入少量CO2,所发生反应的离子方程式为
(3)pH相同、体积相同的盐酸和氢氟酸两种溶液盐酸分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是

(4)烟气中的SO2可引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过程中,溶液中H2SO3、
 、
、 三者所占物质的量分数(a)随pH变化的关系如图所示。由图可知H2SO3第一级电离平衡常数Ka1=
三者所占物质的量分数(a)随pH变化的关系如图所示。由图可知H2SO3第一级电离平衡常数Ka1=
(5)25℃,101KPa时,1g氢气完全燃烧生成液态水,放出142.9kJ热量,请写出氢气燃烧热的热化学方程式
您最近一年使用:0次
2 . 完成下列填空:
(1) 水解的离子方程式为
水解的离子方程式为_______ ,在配制硫化钠溶液时可以加入少量的_______ (填化学式)以抑制其水解。
(2)硫酸铁水溶液呈_______ 性,原因是_______ 用离子方程式表示)。把 溶液蒸干灼烧,最后得到的主要固体产物是
溶液蒸干灼烧,最后得到的主要固体产物是_______ 。
(3)氢能是一种理想的绿色能源,有科学家预言,氢能有可能成为人类未来的主要能源。高纯氢的制备是目前的研究热点,包括氢的制备、储存和应用三个环节。
①适量 在
在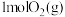 中完全燃烧,生成
中完全燃烧,生成 ,放出
,放出 的热量,请写出表示燃烧热的热化学方程式
的热量,请写出表示燃烧热的热化学方程式_______ 。
②与汽油相比,氢气作为燃料的有点是_______ 。
③下列反应均可获取 。
。
反应I:
反应II: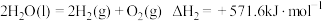
反应III: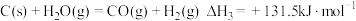
反应IV:
计算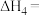
_______ 。
(1)
 水解的离子方程式为
水解的离子方程式为(2)硫酸铁水溶液呈
 溶液蒸干灼烧,最后得到的主要固体产物是
溶液蒸干灼烧,最后得到的主要固体产物是(3)氢能是一种理想的绿色能源,有科学家预言,氢能有可能成为人类未来的主要能源。高纯氢的制备是目前的研究热点,包括氢的制备、储存和应用三个环节。
①适量
 在
在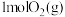 中完全燃烧,生成
中完全燃烧,生成 ,放出
,放出 的热量,请写出表示燃烧热的热化学方程式
的热量,请写出表示燃烧热的热化学方程式②与汽油相比,氢气作为燃料的有点是
③下列反应均可获取
 。
。反应I:

反应II:
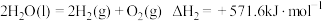
反应III:
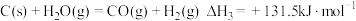
反应IV:

计算
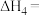
您最近一年使用:0次
3 . 生产、生活中的化学反应都伴随着能量的变化。回答下列问题:
(1) 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下:
 ,则常温下,
,则常温下, (单斜)与
(单斜)与 (斜方)中较稳定的是
(斜方)中较稳定的是______ [填“ (单斜)”或“
(单斜)”或“ (斜方)”]
(斜方)”]
(2)丙烷( )常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成
)常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成 和
和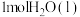 过程中的能量变化图。写出丙烷燃烧的热化学方程式:
过程中的能量变化图。写出丙烷燃烧的热化学方程式:______ ,丙烷的燃烧热( )为
)为_____ 。
(3)水煤气是由 和
和 组成的混合气体,在工业上常用作燃料。已知:
组成的混合气体,在工业上常用作燃料。已知: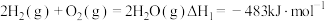 ;
; 。现取
。现取 (标准状况)水煤气,使其完全燃烧生成
(标准状况)水煤气,使其完全燃烧生成 和
和 ,测得反应共放热
,测得反应共放热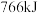 ,则水煤气中
,则水煤气中 与
与 的物质的量之比是
的物质的量之比是___ 。
(4)盖斯定律:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。
①反应 分两步进行:
分两步进行:
(ⅰ)
(ⅱ)
下列示意图中,能正确表示总反应过程中能量变化的是___ (填字母)。
A.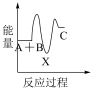 B.
B. 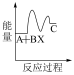 C.
C. 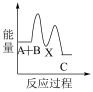 D.
D.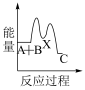
②已知:
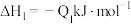

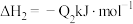


若将 液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为___  (用含
(用含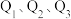 的代数式表示)。
的代数式表示)。
(5)下表中的数据表示断裂 化学键需消耗的能量(即键能,单位为
化学键需消耗的能量(即键能,单位为 ):
):
热化学方程式: ,则
,则 键的键能为
键的键能为______  。
。
(1)
 分子可形成单斜硫和斜方硫,转化过程如下:
分子可形成单斜硫和斜方硫,转化过程如下:
 ,则常温下,
,则常温下, (单斜)与
(单斜)与 (斜方)中较稳定的是
(斜方)中较稳定的是 (单斜)”或“
(单斜)”或“ (斜方)”]
(斜方)”](2)丙烷(
 )常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成
)常用作运动会火炬燃料。如图是一定量丙烷完全燃烧生成 和
和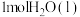 过程中的能量变化图。写出丙烷燃烧的热化学方程式:
过程中的能量变化图。写出丙烷燃烧的热化学方程式: )为
)为
(3)水煤气是由
 和
和 组成的混合气体,在工业上常用作燃料。已知:
组成的混合气体,在工业上常用作燃料。已知: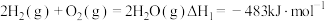 ;
; 。现取
。现取 (标准状况)水煤气,使其完全燃烧生成
(标准状况)水煤气,使其完全燃烧生成 和
和 ,测得反应共放热
,测得反应共放热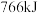 ,则水煤气中
,则水煤气中 与
与 的物质的量之比是
的物质的量之比是(4)盖斯定律:不管化学过程是一步完成或分多步完成,整个过程的总热效应相同。
①反应
 分两步进行:
分两步进行:(ⅰ)

(ⅱ)

下列示意图中,能正确表示总反应过程中能量变化的是
A.
 B.
B.  C.
C.  D.
D.
②已知:

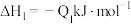

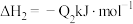


若将
 液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为 (用含
(用含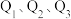 的代数式表示)。
的代数式表示)。(5)下表中的数据表示断裂
 化学键需消耗的能量(即键能,单位为
化学键需消耗的能量(即键能,单位为 ):
):| 化学键 |  |  |
| 键能 | 436 | 431 |
 ,则
,则 键的键能为
键的键能为 。
。
您最近一年使用:0次
名校
4 . I.50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
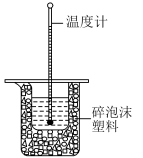
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________ 。
(2)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_______ (填“相等”、“不相等”),所求中和热______ 。(填“相等”、“不相等”)
(3)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是_____ (填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(4)已知N2(g)+2O2(g)=2 NO2(g) ΔH =+67.7 kJ·mol-1
N2H4(g)+O2(g)= N2(g)+2H2O (l) ΔH =-534 kJ·mol-1
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式___________ 。
Ⅱ.CO、SO2、NO均为大气污染物,通过下列反应可以实现可持续发展。已知:
①2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0kJ/mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol -1
③2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.5kJ·mol -1
请回答:
(5)反应①属于______  填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。
(6)反应②生成0.5mol S(g)时,ΔH=________ 。
(7)反应③消耗30g NO(g)时,ΔH=________ 。

(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(3)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是
a.Ba(OH)2·8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(4)已知N2(g)+2O2(g)=2 NO2(g) ΔH =+67.7 kJ·mol-1
N2H4(g)+O2(g)= N2(g)+2H2O (l) ΔH =-534 kJ·mol-1
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
Ⅱ.CO、SO2、NO均为大气污染物,通过下列反应可以实现可持续发展。已知:
①2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0kJ/mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol -1
③2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.5kJ·mol -1
请回答:
(5)反应①属于
 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。(6)反应②生成0.5mol S(g)时,ΔH=
(7)反应③消耗30g NO(g)时,ΔH=
您最近一年使用:0次
2024-02-02更新
|
107次组卷
|
2卷引用:四川省眉山市仁寿第一中学校(北校区)2023-2024学年高二上学期11月期中化学试题
名校
5 . 我国向世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和。而研发二氧化碳捕捉和碳利用技术则是关键,其中 催化加氢合成甲酸(反应为:
催化加氢合成甲酸(反应为: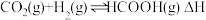 )是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
)是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
(1)已知: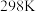 时,部分物质的相对能量如表所示。
时,部分物质的相对能量如表所示。
则
_________  ,此条件下
,此条件下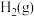 的燃烧热
的燃烧热
________ (填“大于”、“小于”或“等于”) 的燃烧热
的燃烧热 。
。
(2) 催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
(3)恒容密闭容器中充入一定量的 和
和 去合成
去合成 ,下列示意图正确且能说明该反应进行到
,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是___________(填选项字母)。
时刻达到平衡状态的是___________(填选项字母)。
(4)恒温、恒容的密闭容器中充入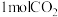 ,
,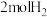 和
和 (不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
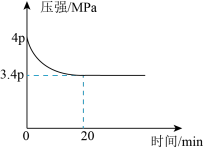
① ,用
,用 表示的化学反应速率为
表示的化学反应速率为___________ 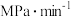 ;
;
②此反应的分压平衡常数
___________ ( 为以分压表示的平衡常数,
为以分压表示的平衡常数,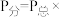 物质的量分数;用含P的式子表示)。
物质的量分数;用含P的式子表示)。
 催化加氢合成甲酸(反应为:
催化加氢合成甲酸(反应为: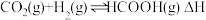 )是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:
)是一种很有前景的方法,且生成的甲酸是重要化工原料。回答下列问题:(1)已知:
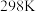 时,部分物质的相对能量如表所示。
时,部分物质的相对能量如表所示。| 物质 |  | 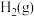 |  |
相对能量/( ) ) |  | 0 |  |

 ,此条件下
,此条件下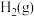 的燃烧热
的燃烧热
 的燃烧热
的燃烧热 。
。(2)
 催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。
催化加氢合成甲酸的过程中,不断升高温度,下列图像正确的是________(填选项字母)。A.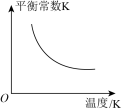 | B.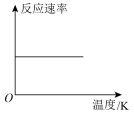 | C.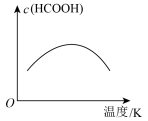 | D. |
(3)恒容密闭容器中充入一定量的
 和
和 去合成
去合成 ,下列示意图正确且能说明该反应进行到
,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是___________(填选项字母)。
时刻达到平衡状态的是___________(填选项字母)。A.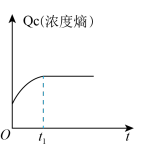 | B. | C. | D. |
(4)恒温、恒容的密闭容器中充入
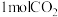 ,
,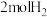 和
和 (不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
(不参与反应)发生反应合成甲酸,测得反应过程中体系压强随时间的变化曲线如图所示。
①
 ,用
,用 表示的化学反应速率为
表示的化学反应速率为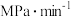 ;
;②此反应的分压平衡常数

 为以分压表示的平衡常数,
为以分压表示的平衡常数,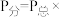 物质的量分数;用含P的式子表示)。
物质的量分数;用含P的式子表示)。
您最近一年使用:0次
名校
6 . 按要求填空:
(1)已知常温下拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则 与
与 反应生成
反应生成 的热化学方程式为:
的热化学方程式为:___________ 。
(2)已知反应①
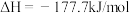
②

③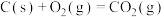
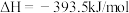
④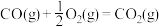
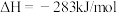
⑤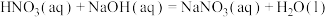

上述热化学方程式中,不正确的有___________ ;(填序号,以下同)表示燃烧热的热化学方程式是___________ ;表示中和热的热化学方程式是___________ 。
(3)下列六种溶液① ②
② ③
③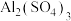 ④
④ ⑤
⑤ ⑥
⑥
加热蒸干后能得到原来物质的是(可以含有结晶水)___________ (填序号);写出②和③混合反应得离子方程式___________ ;写出②和⑤混合反应的离子方程式___________ ;等物质的量的①和②混合所得溶液中物料守恒关系式___________ 。
(1)已知常温下拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则
 与
与 反应生成
反应生成 的热化学方程式为:
的热化学方程式为:(2)已知反应①

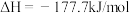
②


③
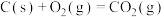
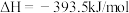
④
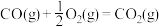
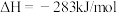
⑤
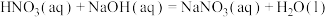

上述热化学方程式中,不正确的有
(3)下列六种溶液①
 ②
② ③
③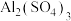 ④
④ ⑤
⑤ ⑥
⑥
加热蒸干后能得到原来物质的是(可以含有结晶水)
您最近一年使用:0次
名校
解题方法
7 . 环氧乙烷( ,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:
,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:
主反应:

副反应:

(1)已知
 ,则EO的燃烧热为
,则EO的燃烧热为___________ 。
(2)在温度为T,压强为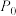 的环境下,欲提高乙烯的平衡转化率,需
的环境下,欲提高乙烯的平衡转化率,需___________ 体系中氮气分压(填“增大”或“减小”)。但在实际生产中并非如此,其可能原因是___________ 。
(3)向温度为T,体积为V的容器中加入投料比为2:3:2.8的乙烯、氧气、氮气。已知平衡后: ,
,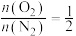 (其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为
(其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为_______ ,副反应的平衡常数为___________ 。
(4)以Ag为催化剂的反应机理如下:
反应Ⅰ: 慢
慢
反应Ⅱ: 快
快
反应Ⅲ: 快
快
①定能够提高主反应反应速率的措施有_______ (填标号)。
A.降低温度 B.通入惰性气体
C.增大 浓度 D.增大
浓度 D.增大 浓度
浓度
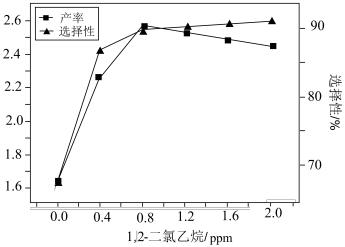
②加入1,2-二氯乙烷会发生 。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是
。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是_______ 。
 ,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:
,简称EO)是在有机合成中常用的试剂。EO常温下易燃易爆,其爆炸极限为3~100%。近年来,常用以乙烯、氧气、氮气混合气投料的乙烯氧化法制备EO。部分涉及反应为:主反应:


副反应:


(1)已知

 ,则EO的燃烧热为
,则EO的燃烧热为(2)在温度为T,压强为
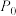 的环境下,欲提高乙烯的平衡转化率,需
的环境下,欲提高乙烯的平衡转化率,需(3)向温度为T,体积为V的容器中加入投料比为2:3:2.8的乙烯、氧气、氮气。已知平衡后:
 ,
,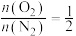 (其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为
(其中二碳化合物为分子中含两个碳原子的化合物)。忽略其他反应,乙烯的平衡转化率为(4)以Ag为催化剂的反应机理如下:
反应Ⅰ:
 慢
慢反应Ⅱ:
 快
快反应Ⅲ:
 快
快①定能够提高主反应反应速率的措施有
A.降低温度 B.通入惰性气体
C.增大
 浓度 D.增大
浓度 D.增大 浓度
浓度②加入1,2-二氯乙烷会发生
 。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是
。一定条件下,反应经过一定时间后,EO产率及选择性与1,2-二氯乙烷浓度关系如图。1,2-二氯乙烷能使EO产量先增加后降低的原因是
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题:
(1)已知:①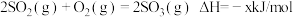
②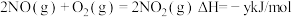
则反应 的ΔH=
的ΔH=___________ kJ·mol−1。反应②的ΔS___________ (填“>”或“<”)0,若y>0,则反应②在___________ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)已知: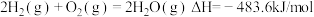 ,查阅文献资料,化学键的键能如下表:
,查阅文献资料,化学键的键能如下表:
①氨分解反应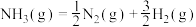 的活化能Ea1=300kJ·mol−1,则合成氨反应
的活化能Ea1=300kJ·mol−1,则合成氨反应 的活化能Ea2=
的活化能Ea2=___________ kJ·mol−1。
②氨气完全燃烧生成N2(g)和气态水的热化学方程式为___________ 。
(3)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热ΔH1=−2220kJ/mol;正丁烷的燃烧热ΔH2=−2878kJ/mol,异丁烷的燃烧热ΔH3=−2869.6kJ/mol。
①写出丙烷燃烧热的热化学方程式___________ 。
②下列有关说法不正确的是___________ 。
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(1)已知:①
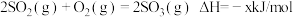
②
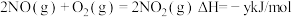
则反应
 的ΔH=
的ΔH=(2)已知:
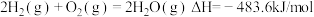 ,查阅文献资料,化学键的键能如下表:
,查阅文献资料,化学键的键能如下表:| 化学键 | H−H键 | N≡N键 | N−H键 |
| E/(kJ·mol−1) | 436 | 946 | 391 |
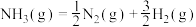 的活化能Ea1=300kJ·mol−1,则合成氨反应
的活化能Ea1=300kJ·mol−1,则合成氨反应 的活化能Ea2=
的活化能Ea2=②氨气完全燃烧生成N2(g)和气态水的热化学方程式为
(3)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热ΔH1=−2220kJ/mol;正丁烷的燃烧热ΔH2=−2878kJ/mol,异丁烷的燃烧热ΔH3=−2869.6kJ/mol。
①写出丙烷燃烧热的热化学方程式
②下列有关说法不正确的是
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
您最近一年使用:0次
名校
解题方法
9 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为___________ 。
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na.电解反应方程式如下: ,加入
,加入 的目的是
的目的是___________ 。
(3) 的电子式为
的电子式为___________ 。在25℃和101kPa时,Na与 反应生成1mol
反应生成1mol 放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:___________ 。 可作供氧剂,写出
可作供氧剂,写出 与CO2反应的化学方程式
与CO2反应的化学方程式___________ 。若有78g 参加反应则转移电子的物质的量为
参加反应则转移电子的物质的量为___________ mol。
(4)采用空气和Na为原料可直接制备 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(5)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为___________ 。

(1)基态Na原子的价层电子轨道表示式为
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na.电解反应方程式如下:
 ,加入
,加入 的目的是
的目的是(3)
 的电子式为
的电子式为 反应生成1mol
反应生成1mol 放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式: 可作供氧剂,写出
可作供氧剂,写出 与CO2反应的化学方程式
与CO2反应的化学方程式 参加反应则转移电子的物质的量为
参加反应则转移电子的物质的量为(4)采用空气和Na为原料可直接制备
 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(5)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为

您最近一年使用:0次
名校
解题方法
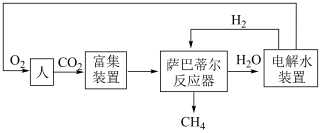
10 . 某空间站利用萨巴蒂尔反应: ,配合水的电解实现氧气再生的流程简图如下。
,配合水的电解实现氧气再生的流程简图如下。
(1)已知:电解液态水制备1mol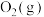 ,电解反应的
,电解反应的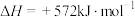 。由此计算
。由此计算 的摩尔燃烧焓
的摩尔燃烧焓
___________  。
。
(2)已知:萨巴蒂尔反应的平衡常数(K)与反应温度(t)之间的关系如图。
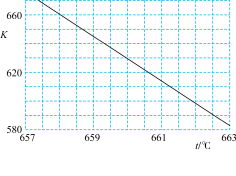
①萨巴蒂尔反应在___________ (选填“高温”或“低温”)下能自发进行。
②某研究小组模拟该反应,温度t下,向容积为10L的密闭容器中通入0.1mol 和0.4mol
和0.4mol ,反应平衡后测得容器中
,反应平衡后测得容器中 。则
。则 的转化率为
的转化率为______ ,反应温度t约为____ ℃。
(3)在相同条件下, 与
与 还会发生不利于氧循环的副反应:
还会发生不利于氧循环的副反应:
 ,在反应器中按
,在反应器中按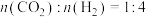 通入反应物在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中
通入反应物在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中 、
、 浓度
浓度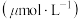 如表。
如表。
若选用催化剂Ⅰ,在350℃条件下反应,0~2min生成 的平均反应速率为
的平均反应速率为_____ 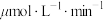 ;结合表格信息分析,从提高循环系统制氧效率的角度,反应器的最佳反应条件应选择催化剂
;结合表格信息分析,从提高循环系统制氧效率的角度,反应器的最佳反应条件应选择催化剂___________ (填“Ⅰ”或“Ⅱ”)和
___________ 。
(4)令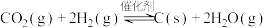 代替萨巴蒂尔反应,虽可实现氢、氧元素完全循环利用,但使用一段时间后催化剂的催化效果会明显下降,其原因是
代替萨巴蒂尔反应,虽可实现氢、氧元素完全循环利用,但使用一段时间后催化剂的催化效果会明显下降,其原因是___________ 。
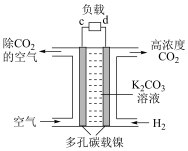
(5)“富集装置”可利用电化学法富集空间站内“空气”中的 作为萨巴蒂尔反应器的原料气之一,装置如右图。a极为
作为萨巴蒂尔反应器的原料气之一,装置如右图。a极为______ 极(填“正”或“负”),b电极上发生的电极反应为___________ 。
 ,配合水的电解实现氧气再生的流程简图如下。
,配合水的电解实现氧气再生的流程简图如下。
(1)已知:电解液态水制备1mol
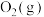 ,电解反应的
,电解反应的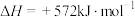 。由此计算
。由此计算 的摩尔燃烧焓
的摩尔燃烧焓
 。
。(2)已知:萨巴蒂尔反应的平衡常数(K)与反应温度(t)之间的关系如图。

①萨巴蒂尔反应在
②某研究小组模拟该反应,温度t下,向容积为10L的密闭容器中通入0.1mol
 和0.4mol
和0.4mol ,反应平衡后测得容器中
,反应平衡后测得容器中 。则
。则 的转化率为
的转化率为(3)在相同条件下,
 与
与 还会发生不利于氧循环的副反应:
还会发生不利于氧循环的副反应: ,在反应器中按
,在反应器中按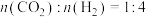 通入反应物在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中
通入反应物在不同温度、不同催化剂条件下,反应进行到2min时,测得反应器中 、
、 浓度
浓度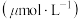 如表。
如表。| 催化剂 | 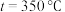 | 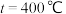 | ||
 | 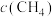 |  | 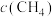 | |
| 催化剂Ⅰ | 10.8 | 12722 | 345.2 | 42780 |
| 催化剂Ⅱ | 9.2 | 10775 | 34 | 38932 |
 的平均反应速率为
的平均反应速率为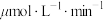 ;结合表格信息分析,从提高循环系统制氧效率的角度,反应器的最佳反应条件应选择催化剂
;结合表格信息分析,从提高循环系统制氧效率的角度,反应器的最佳反应条件应选择催化剂
(4)令
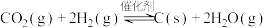 代替萨巴蒂尔反应,虽可实现氢、氧元素完全循环利用,但使用一段时间后催化剂的催化效果会明显下降,其原因是
代替萨巴蒂尔反应,虽可实现氢、氧元素完全循环利用,但使用一段时间后催化剂的催化效果会明显下降,其原因是(5)“富集装置”可利用电化学法富集空间站内“空气”中的
 作为萨巴蒂尔反应器的原料气之一,装置如右图。a极为
作为萨巴蒂尔反应器的原料气之一,装置如右图。a极为
您最近一年使用:0次



