名校
解题方法
1 . Ⅰ.已知:
①
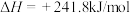
②
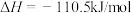
③

请填写下列空白。
(1)上述反应中属于吸热反应的是_______ (填序号)。
(2)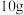
 完全燃烧生成水蒸气,放出的热量为
完全燃烧生成水蒸气,放出的热量为_______ 。
Ⅱ.由于亚硝酸钠和食盐性状相似,曾多次发生过将 误当食盐食用的事件。欲测定某样品中
误当食盐食用的事件。欲测定某样品中 的含量,某同学设计如下实验:①称取样品
的含量,某同学设计如下实验:①称取样品 ,加水溶解,配制成
,加水溶解,配制成 溶液。②取
溶液。②取 溶液于锥形瓶中,用
溶液于锥形瓶中,用
 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液
溶液 。
。
(3)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还有_______ 。
(4)在进行滴定操作时, 溶液盛装在
溶液盛装在_______ (填“酸式”或“碱式”)滴定管中。当滴入最后半滴 溶液,
溶液,_______ 时达到滴定终点。
(5)滴定过程中发生反应的离子方程式是_______ ;测得该样品中 的质量分数为
的质量分数为_______ 。
(6)以下操作造成测定结果偏高的是_______ 。
A.滴定管未用 标准溶液润洗
标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
①

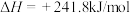
②

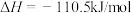
③


请填写下列空白。
(1)上述反应中属于吸热反应的是
(2)
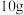
 完全燃烧生成水蒸气,放出的热量为
完全燃烧生成水蒸气,放出的热量为Ⅱ.由于亚硝酸钠和食盐性状相似,曾多次发生过将
 误当食盐食用的事件。欲测定某样品中
误当食盐食用的事件。欲测定某样品中 的含量,某同学设计如下实验:①称取样品
的含量,某同学设计如下实验:①称取样品 ,加水溶解,配制成
,加水溶解,配制成 溶液。②取
溶液。②取 溶液于锥形瓶中,用
溶液于锥形瓶中,用
 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液
溶液 。
。(3)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还有
(4)在进行滴定操作时,
 溶液盛装在
溶液盛装在 溶液,
溶液,(5)滴定过程中发生反应的离子方程式是
 的质量分数为
的质量分数为(6)以下操作造成测定结果偏高的是
A.滴定管未用
 标准溶液润洗
标准溶液润洗B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
您最近一年使用:0次
名校
解题方法
2 . 一些烷烃的燃烧热如下表:
下列表达正确的是
| 化合物 | 燃烧热 |
| 甲烷 | 891.0 |
| 乙烷 | 1560.8 |
| 丙烷 | 2221.5 |
| 正丁烷 | 2878.0 |
| 异丁烷 | 2869.6 |
| 2-甲基丁烷 | 3531.3 |
A.正戊烷的燃烧热大于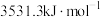 |
| B.稳定性:正丁烷>异丁烷 |
C.乙烷燃烧的热化学方程式为 |
| D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
您最近一年使用:0次
名校
3 . 完成下列问题。
(1)在 时,
时, 在足量的氧气中充分燃烧生成二氧化硫,放出
在足量的氧气中充分燃烧生成二氧化硫,放出 的热量,则表示S的燃烧热的热化学方程式为
的热量,则表示S的燃烧热的热化学方程式为___________ 。
(2)现有反应: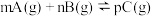 ,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
①该反应的逆反应为___________ 热反应,且
___________ p(填“>”、“=”或“<”)。
②减压时,A的质量分数___________ 。(填“增大”、“减小”或“不变”,下同)
③若加入B(体积不变),则A的转化率___________ 。
④若升高温度,则平衡时B、C的浓度之比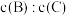 将
将___________ 。
⑤若加入催化剂,平衡时气体混合物的总物质的量___________ 。
⑥若B是有色物质,A、C均无色,则加入C(体积不变)后混合物颜色___________ ;(填“变深”、“变浅”或“不变”,下同)维持容器内压强不变,充入氖气后,混合物颜色___________ 。
(3)已知相同条件下
反应I:
反应Ⅱ:
则反应
___________ 。(用 表示)。
表示)。
(1)在
 时,
时, 在足量的氧气中充分燃烧生成二氧化硫,放出
在足量的氧气中充分燃烧生成二氧化硫,放出 的热量,则表示S的燃烧热的热化学方程式为
的热量,则表示S的燃烧热的热化学方程式为(2)现有反应:
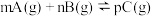 ,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:①该反应的逆反应为

②减压时,A的质量分数
③若加入B(体积不变),则A的转化率
④若升高温度,则平衡时B、C的浓度之比
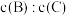 将
将⑤若加入催化剂,平衡时气体混合物的总物质的量
⑥若B是有色物质,A、C均无色,则加入C(体积不变)后混合物颜色
(3)已知相同条件下
反应I:

反应Ⅱ:

则反应

 表示)。
表示)。
您最近一年使用:0次
名校
4 . 过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq) CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
(1)利用上述反应制备760g CHCOH,放出的热量为_______ kJ。
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
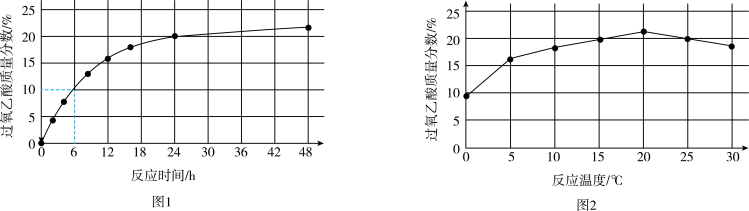 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=_____ g/h。(用含m的代数式表示)
②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是_______ (写出2条)。
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
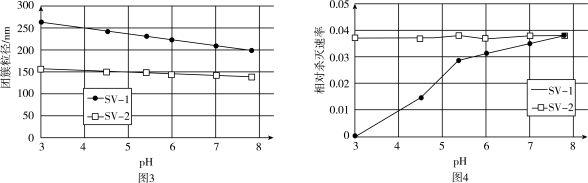
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是___________ 。
 CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol(1)利用上述反应制备760g CHCOH,放出的热量为
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。

依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是
您最近一年使用:0次
5 . Ⅰ.燃料电池电动汽车是利用氢气、甲醇、天然气(主要成分为甲烷)、汽油等燃料和空气中的氧在催化剂的作用下在燃料电池中经电化学反应产生的电能,并作为主要动力源驱动的汽车。
(1)汽车行驶的过程中,能量的转化形式为_______ 。
Ⅱ.利用下表数据回答下列问题:
(2)表示乙烷燃烧热的热化学方程式为_______ 。
(3)稳定性:正丁烷_______ 异丁烷(填“>”“<”或“=”);原因_______ 。
(4)相同质量的燃料,_______ (填“C”或“H”)的质量分数越大,燃烧放出的热量越多。
(5)二氧化碳是重要的温室气体,从环保角度分析,放出相同的热量时选择_______ (填“乙烷”或“甲醇”)作为燃料产生的CO2较少。
(6)现有氢气和丙烷混合气体3 mol,完全燃烧共产生2791.5 kJ的热量,则氢气和丙烷的物质的量之比为_______ 。
(1)汽车行驶的过程中,能量的转化形式为
Ⅱ.利用下表数据回答下列问题:
| 燃料 | 燃烧热/(kJ·mol-1) | 燃料 | 燃烧热/(kJ·mol-1) |
| 氢气 | 285.8 | 甲醇(CH3OH) | 726.51 |
| 甲烷(CH4) | 890.3 | 正丁烷(CH3CH2CH2CH3) | 2878.0 |
| 乙烷(C2H6) | 1559.8 | 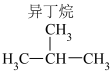 | 2869.6 |
| 丙烷(C3H8) | 2219.9 |
(3)稳定性:正丁烷
(4)相同质量的燃料,
(5)二氧化碳是重要的温室气体,从环保角度分析,放出相同的热量时选择
(6)现有氢气和丙烷混合气体3 mol,完全燃烧共产生2791.5 kJ的热量,则氢气和丙烷的物质的量之比为
您最近一年使用:0次
6 . 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)  =-890kJ/mol
=-890kJ/mol
CO(g)+1/2O2(g)=CO2(g) =-282.5kJ/mol。
=-282.5kJ/mol。
假如标准状况下由CH4、CO、CO2组成的89.6升混和气体完全燃烧时能放出1010千焦的热量,并生成18克液态水,那么燃烧前混和气体中CO占的体积百分含量约为
 =-890kJ/mol
=-890kJ/molCO(g)+1/2O2(g)=CO2(g)
 =-282.5kJ/mol。
=-282.5kJ/mol。假如标准状况下由CH4、CO、CO2组成的89.6升混和气体完全燃烧时能放出1010千焦的热量,并生成18克液态水,那么燃烧前混和气体中CO占的体积百分含量约为
| A.40% | B.50% | C.60% | D.70% |
您最近一年使用:0次
名校
7 . 下列图示与对应叙述相符的是
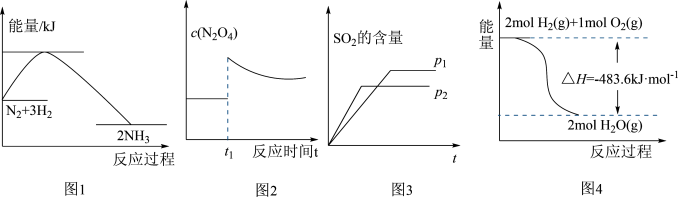

| A.图1反应达平衡后,升高温度,平衡常数K值增大 |
B.图2表示平衡 在t1时迅速将体积缩小后c(N2O4)的变化 在t1时迅速将体积缩小后c(N2O4)的变化 |
C.图3表示可逆反应“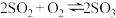 ”中SO2的含量与压强的关系,且P2>P1 ”中SO2的含量与压强的关系,且P2>P1 |
D.图4表示H2与O2发生反应过程中的能量变化,则H2的燃烧热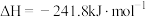 |
您最近一年使用:0次
名校
8 . 周期表中ⅡA族元素及其化合物应用广泛。铍的化合物性质与铝相似, 的熔点为
的熔点为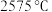 ,熔融时
,熔融时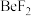 能导电,而
能导电,而 不能导电;
不能导电; 的燃烧热为
的燃烧热为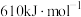 ,实验室中常用酸性
,实验室中常用酸性 测定物品中不溶性
测定物品中不溶性 的含量。铍镍合金可用于制造弹簧秤的弹簧,
的含量。铍镍合金可用于制造弹簧秤的弹簧, 可用作隔音材料,
可用作隔音材料, 可用作工业废气脱硫剂。下列化学反应表示正确的是
可用作工业废气脱硫剂。下列化学反应表示正确的是
 的熔点为
的熔点为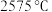 ,熔融时
,熔融时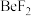 能导电,而
能导电,而 不能导电;
不能导电; 的燃烧热为
的燃烧热为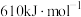 ,实验室中常用酸性
,实验室中常用酸性 测定物品中不溶性
测定物品中不溶性 的含量。铍镍合金可用于制造弹簧秤的弹簧,
的含量。铍镍合金可用于制造弹簧秤的弹簧, 可用作隔音材料,
可用作隔音材料, 可用作工业废气脱硫剂。下列化学反应表示正确的是
可用作工业废气脱硫剂。下列化学反应表示正确的是A. 与 与 溶液反应: 溶液反应: |
B.镁的燃烧:  |
C.向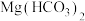 溶液中滴加足量 溶液中滴加足量 溶液: 溶液: |
D.用酸性 测定 测定 的含量: 的含量: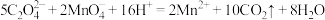 |
您最近一年使用:0次
2024-01-28更新
|
605次组卷
|
3卷引用:2024届江苏省连云港市高三第一次调研考试(一模)化学试题
2024届江苏省连云港市高三第一次调研考试(一模)化学试题河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
9 . 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。[已知:2SO2(g)+O2(g) 2SO3(g) ΔH=﹣196.9kJ•mol﹣1]
2SO3(g) ΔH=﹣196.9kJ•mol﹣1]
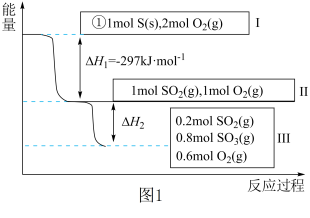
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:___________ 。
(2)恒容条件下,下列措施中能使n(SO3)/n(SO2)比图1所示情况增大的有___________。
(3)恒温恒容时,1mol SO2和2mol O2充分反应,放出热量的数值比|ΔH2|___________ (填“大”、“小”或“相等”)。
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是___________ ;图中表示平衡混合物中SO3的含量最高的一段时间是___________ 。

 2SO3(g) ΔH=﹣196.9kJ•mol﹣1]
2SO3(g) ΔH=﹣196.9kJ•mol﹣1]
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:
(2)恒容条件下,下列措施中能使n(SO3)/n(SO2)比图1所示情况增大的有___________。
| A.升高温度 | B.充入He | C.再充入1mol SO2(g)和1mol O2(g) | D.使用催化剂 |
(3)恒温恒容时,1mol SO2和2mol O2充分反应,放出热量的数值比|ΔH2|
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是

您最近一年使用:0次
10 . 2020年东京奥运会火炬传递的火炬样式将采用樱花形状。奥运会火炬常用的燃料为丙烷、丁烷等。
已知:丙烷的燃烧热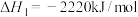 ;正丁烷的燃烧热
;正丁烷的燃烧热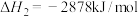 ,异丁烷的燃烧热
,异丁烷的燃烧热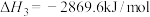 。
。
(1)写出丙烷燃烧热的热化学方程式:_______ 。
(2)下列有关说法不正确的是_______ (填标号)。
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(3)已知A气体的燃烧热为30kJ/mol,B气体的燃烧热为500kJ/mol。现有6mol由A和B组成的混合气体,完全燃烧放出的热量是2000kJ,则该混合气体中气体A和气体B的物质的量之比是_______ 。
(4)Deacon直接氧化法可按下列催化过程进行:
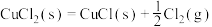
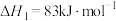
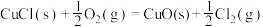


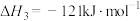
则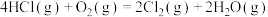 的
的
_______  。
。
(5)恒温恒容条件下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应: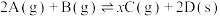 ,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为
,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为 。
。
①从开始反应至达到平衡状态,生成C的平均反应速率为_______ 。
②
_______ 。
③下列各项可作为该反应达到平衡状态的标志的是_______ (填字母)。
A.压强不再变化 B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1 D.A的百分含量保持不变
已知:丙烷的燃烧热
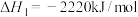 ;正丁烷的燃烧热
;正丁烷的燃烧热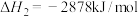 ,异丁烷的燃烧热
,异丁烷的燃烧热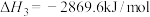 。
。(1)写出丙烷燃烧热的热化学方程式:
(2)下列有关说法不正确的是
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(3)已知A气体的燃烧热为30kJ/mol,B气体的燃烧热为500kJ/mol。现有6mol由A和B组成的混合气体,完全燃烧放出的热量是2000kJ,则该混合气体中气体A和气体B的物质的量之比是
(4)Deacon直接氧化法可按下列催化过程进行:
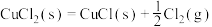
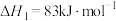
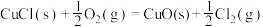


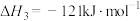
则
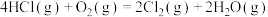 的
的
 。
。(5)恒温恒容条件下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:
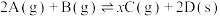 ,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为
,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为 。
。①从开始反应至达到平衡状态,生成C的平均反应速率为
②

③下列各项可作为该反应达到平衡状态的标志的是
A.压强不再变化 B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1 D.A的百分含量保持不变
您最近一年使用:0次



