10-11高二下·安徽马鞍山·期中
名校
解题方法
1 . 一些烷烃的燃烧热如下表:
下列说法正确的是
| 化合物 | ΔH/(kJ·mol-1) | 化合物 | ΔH/(kJ·mol-1) |
| 甲烷 | -891.0 | 正丁烷 | -2878.0 |
| 乙烷 | -1560.8 | 异丁烷 | -2869.6 |
| 丙烷 | -2221.5 | 2-甲基丁烷 | -3531.3 |
| A.正戊烷的燃烧热大约是3540 kJ·mol-1 |
| B.热稳定性:正丁烷>异丁烷 |
| C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1560.8 kJ·mol-1 |
| D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
您最近一年使用:0次
2021-08-27更新
|
574次组卷
|
17卷引用:2010-2011学年安徽省马鞍山市第二中学高二下学期期中素质测试化学试卷
(已下线)2010-2011学年安徽省马鞍山市第二中学高二下学期期中素质测试化学试卷(已下线)2010—2011学年安徽省马鞍山二中高二下学期期中考试化学试卷(理科)江西省上饶市玉山县第一中学2015-2016学年高二下学期重点班第一次月考化学卷(已下线)2018年10月16日 《每日一题》人教选修4-燃烧热及表示燃烧热的热化学方程式(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点步步为赢 高二化学暑假作业:作业七 化学反应与能量黑龙江省牡丹江市第一高级中学2019-2020学年高二上学期开学检测化学试题浙江省杭州市西湖高级中学2019-2020学年高二10月月考化学试题(已下线)考点08 化学反应中的能量变化——《备战2020年高考精选考点专项突破题集》第23届(2009年)全国高中学生化学竞赛(安徽赛区)初赛试题宁夏银川一中2020-2021学年高二上学期期末考试化学试题河南省洛阳市豫西名校2020-2021学年高二下学期第一次联考化学试题(已下线)1.1.3 能源的充分利用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1) 福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题(已下线)必考点01 化学反应的热效应-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)河南省信阳市2021-2022学年高二上学期期中考试化学试题湖北省部分重点中学2022-2023学年高三下学期2月质量检测化学试题
解题方法
2 . 能源、资源、环境等问题是当前人类社会面临的重大课题。回答下列问题:
(1)直接利用物质燃烧提供热能在当今社会仍然占很大比重,但存在利用率低的问题。CH4、CO、CH3OH都是重要的能源物质,等质量的上述物质充分燃烧,消耗O2最多的是_______ (填化学式)。
(2)燃料电池的能量转化效率比直接燃烧的高,如图为甲烷一空气燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,甲烷从_______ 口通入(填“A”或“B”)。
②a极的电极反应式为____________________________ 。
(3)某同学设计的原电池如图所示,当导线中有3.01×1023个电子通过时,溶液质量减轻_______ g。

(4)铁炭混合物(铁屑和活性炭的混合物)在水溶液中可形成许多微电池。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________________________________________ 。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是____________________________ 。
(1)直接利用物质燃烧提供热能在当今社会仍然占很大比重,但存在利用率低的问题。CH4、CO、CH3OH都是重要的能源物质,等质量的上述物质充分燃烧,消耗O2最多的是
(2)燃料电池的能量转化效率比直接燃烧的高,如图为甲烷一空气燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,甲烷从
②a极的电极反应式为
(3)某同学设计的原电池如图所示,当导线中有3.01×1023个电子通过时,溶液质量减轻

(4)铁炭混合物(铁屑和活性炭的混合物)在水溶液中可形成许多微电池。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是
您最近一年使用:0次
3 . 一些烷烃的燃烧热(kJ•mol﹣1)如表:
下列表达正确的是( )
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
下列表达正确的是( )
| A.燃烧热:正丁烷>异丁烷 |
| B.热稳定性:正丁烷>异丁烷 |
| C.正戊烷的燃烧热小于3531.3kJ•mol﹣1 |
| D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
您最近一年使用:0次
名校
解题方法
4 . 一些烷烃的燃烧热(kJ/mol)如下:
下列推断正确的是
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
下列推断正确的是
| A.热稳定性:正丁烷>异丁烷 |
| B.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)+1560.8kJ |
| C.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量就越多 |
| D.正戊烷的燃烧热大约在3540 kJ/mol左右 |
您最近一年使用:0次
2020-03-22更新
|
201次组卷
|
3卷引用:上海市奉贤区2015届高三上学期期中调研测试化学试题
名校
5 . 按要求完成下列问题。
(1)已知充分燃烧一定量的乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为_______ 。
(2)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应时,每生成 会放出
会放出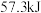 的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:
的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:_______ 。
(3)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)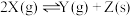
(乙)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是_______ ;能表明(乙)达到化学平衡状态是_______ 。
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
(1)已知充分燃烧一定量的乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为
(2)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应时,每生成
 会放出
会放出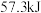 的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:
的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:(3)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)
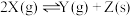
(乙)

当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
您最近一年使用:0次
2021-09-22更新
|
306次组卷
|
2卷引用:天津市新华中学2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
6 . 为了合理利用化学能确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得:5g液态甲醇(CH3OH)在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5kJ的热量。试写出甲醇燃烧热的热化学方程式:___ 。
(2)合成甲醇的主要反应是2H2(g)+CO(g) CH3OH(g)ΔH=-90.8kJ·mol-1,t℃时,向2L的密闭容器中投入2molH2和mmolCO,反应10min后测得各组分的浓度如下:
CH3OH(g)ΔH=-90.8kJ·mol-1,t℃时,向2L的密闭容器中投入2molH2和mmolCO,反应10min后测得各组分的浓度如下:
则该时间段内反应速率v(H2)=___ ,m=___ mol。
(3)恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
①若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=___ mol。
②反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为___ ,原混合气体中a:b=___ (写出最简整数比,下同)。
③达到平衡时,N2和H2的转化率之比α(N2):α(H2)=___ 。
(1)实验测得:5g液态甲醇(CH3OH)在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5kJ的热量。试写出甲醇燃烧热的热化学方程式:
(2)合成甲醇的主要反应是2H2(g)+CO(g)
 CH3OH(g)ΔH=-90.8kJ·mol-1,t℃时,向2L的密闭容器中投入2molH2和mmolCO,反应10min后测得各组分的浓度如下:
CH3OH(g)ΔH=-90.8kJ·mol-1,t℃时,向2L的密闭容器中投入2molH2和mmolCO,反应10min后测得各组分的浓度如下:| 物质 | H2 | CO | CH3OH |
| 浓度(mol·L-1) | 0.2 | 0.1 | 0.4 |
(3)恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)
 2NH3(g)
2NH3(g)①若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=
②反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为
③达到平衡时,N2和H2的转化率之比α(N2):α(H2)=
您最近一年使用:0次
名校
解题方法
7 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。

(1) 和
和 反应生成
反应生成 过程中能量的变化如图,该化学反应属于
过程中能量的变化如图,该化学反应属于_______ (放热或吸热)反应,一般来说反应使用催化剂后,会使图中 点升高还是降低?
点升高还是降低?_______ ; 点对应
点对应 的大小对该反应的反应热有无影响?
的大小对该反应的反应热有无影响?_______ 。
(2)请写出该反应的热化学方程式:_______ 。
(3)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为 ,请写出氢气的燃烧热热化学方程式:
,请写出氢气的燃烧热热化学方程式:_______ 。

(1)
 和
和 反应生成
反应生成 过程中能量的变化如图,该化学反应属于
过程中能量的变化如图,该化学反应属于 点升高还是降低?
点升高还是降低? 点对应
点对应 的大小对该反应的反应热有无影响?
的大小对该反应的反应热有无影响?(2)请写出该反应的热化学方程式:
(3)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为
 ,请写出氢气的燃烧热热化学方程式:
,请写出氢气的燃烧热热化学方程式:
您最近一年使用:0次
8 . I.氮是地球上含量丰富的一种元素,氨、肼(N2H4)、尿素、偏二甲肼(C2H8N2)是氮的常见化合物,在科学技术和生产中有重要的应用。
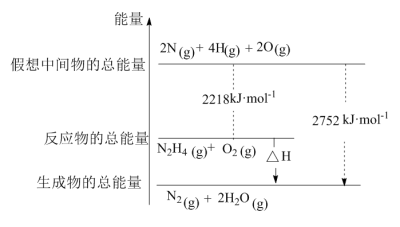
(1)肼(N2H4)是一种高能燃料,写出肼的电子式________ ,有关化学反应的能量变化如下图所示,已知H2O(g)=H2O(l) ΔH=-44kJ·mol-1,写出肼燃烧的燃烧热的热化学方程式为 __________ 。
(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为____________ 。
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
则平衡时容器的体积V甲____________ V丙,平衡常数K丙_________ K乙(填>、<或=)
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)⇌ H2NCOONH4(氨基甲酸铵)(l) △H1,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是________
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:_________ 。

(1)肼(N2H4)是一种高能燃料,写出肼的电子式

(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molN2、3molH2 | 2molNH3 | 2molNH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | υ甲 | υ乙 | υ丙 |
则平衡时容器的体积V甲
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)⇌ H2NCOONH4(氨基甲酸铵)(l) △H1,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:

您最近一年使用:0次
名校
解题方法
9 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请问该化学反应属于___ (放热或吸热)反应,请写出该反应的热化学方程式:___ 。

②上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为285.8kJ·mol-1,请写出氢气的燃烧热热化学方程式:___ 。
①如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请问该化学反应属于

②上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为285.8kJ·mol-1,请写出氢气的燃烧热热化学方程式:
您最近一年使用:0次
2020-11-18更新
|
94次组卷
|
3卷引用:西藏自治区日喀则市第二高级中学2020-2021学年高二上学期期中考试化学试题
名校
10 . 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH = -196.6 kJ/mol。请回答下列问题:
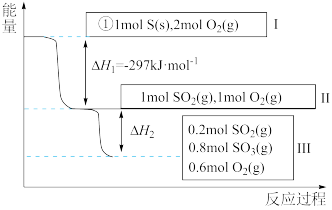
(1)写出能表示硫的燃烧热的热化学方程式:____ 。
(2)状态Ⅱ到状态Ⅲ放出的热量为____ 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣______ (填“大”、“小”或“相等”)。
(4)反应2SO2(g)+O2(g)⇌2SO3(g)的平衡常数表达式______ ;若状态Ⅲ处于平衡状态,保持温度不变,将容器体积迅速增大到原来2倍,则此时v(正)_____ v(逆)(填“>”、“<”或“=”)。
(5)恒容条件下,在状态Ⅱ时采取下列措施,能使n(SO3)/ n(SO2)增大的有___ 。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是______ ;图中表示平衡混合物中SO3的含量最高的一段时间是______ 。


(1)写出能表示硫的燃烧热的热化学方程式:
(2)状态Ⅱ到状态Ⅲ放出的热量为
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣
(4)反应2SO2(g)+O2(g)⇌2SO3(g)的平衡常数表达式
(5)恒容条件下,在状态Ⅱ时采取下列措施,能使n(SO3)/ n(SO2)增大的有
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是

您最近一年使用:0次



