名校
解题方法
1 . (1)为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
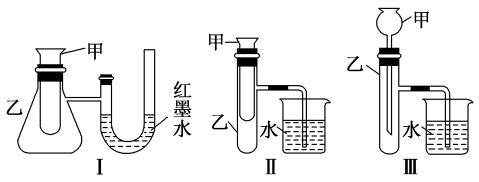
①上述装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是________________ (填序号)。
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是________________ 。
(2)化学反应的焓变通常用实验进行测定,也可进行理论推算。
①实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出a kJ的热量,试写出表示甲烷燃烧热的热化学方程式:_____________________ ;
②已知反应CH3—CH3(g)→ CH2=CH2(g)+H2(g)ΔH,有关化学键的键能如下:
通过计算得出该反应的焓变ΔH=___________________ ;
(3)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
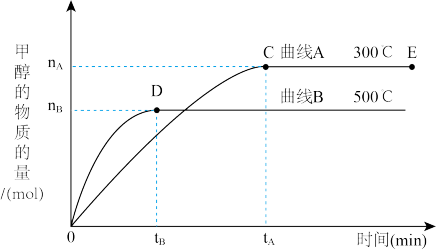
①反应达到平衡时,降低温度,平衡常数K值_______ (填“增大”、“减小”或“不变”)
②在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_______
a.正反应速率加快,逆反应速率也加快
b.甲醇的物质的量增加
c.氢气的浓度减少
d.重新平衡时n(H2)/n(CH3OH)减小

①上述装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是
(2)化学反应的焓变通常用实验进行测定,也可进行理论推算。
①实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出a kJ的热量,试写出表示甲烷燃烧热的热化学方程式:
②已知反应CH3—CH3(g)→ CH2=CH2(g)+H2(g)ΔH,有关化学键的键能如下:
| 化学键 | C—H | C=C | C—C | H—H |
| 键能/kJ·mol-1 | 414.4 | 615.3 | 347.3 | 435.3 |
通过计算得出该反应的焓变ΔH=
(3)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)根据题意完成下列各题:

①反应达到平衡时,降低温度,平衡常数K值
②在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.正反应速率加快,逆反应速率也加快
b.甲醇的物质的量增加
c.氢气的浓度减少
d.重新平衡时n(H2)/n(CH3OH)减小
您最近一年使用:0次
2 . 下列说法或表述正确的是
①常温时 的KOH溶液与
的KOH溶液与 的醋酸等体积混合,所得溶液
的醋酸等体积混合,所得溶液
②二氧化硅是酸性氧化物,但它能与某种酸反应
③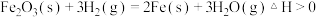 ,
,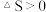 任何条件下都不能自发进行
任何条件下都不能自发进行
④丁达尔效应可用于区别溶液和胶体,电泳现象能证明胶体带电荷
⑤钢铁的吸氧腐蚀,正极发生反应: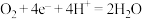
⑥ 的燃烧热为
的燃烧热为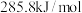 ,则表示
,则表示 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为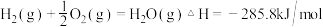 。
。

①常温时
 的KOH溶液与
的KOH溶液与 的醋酸等体积混合,所得溶液
的醋酸等体积混合,所得溶液
②二氧化硅是酸性氧化物,但它能与某种酸反应
③
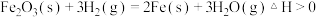 ,
,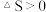 任何条件下都不能自发进行
任何条件下都不能自发进行 ④丁达尔效应可用于区别溶液和胶体,电泳现象能证明胶体带电荷
⑤钢铁的吸氧腐蚀,正极发生反应:
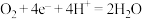
⑥
 的燃烧热为
的燃烧热为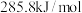 ,则表示
,则表示 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为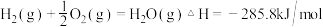 。
。| A.①④ | B.①② | C.④⑥ | D.③⑤ |
您最近一年使用:0次
19-20高二·浙江·期末
解题方法
3 . 下列说法不正确的是
A.已知冰的熔化热为6.0 ,冰中氢键键能为20 ,冰中氢键键能为20 。假设每摩尔冰中有2 。假设每摩尔冰中有2 氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 |
B.由于键能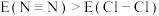 ,故单质的沸点: ,故单质的沸点: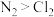 |
C.实验测得环己烷、环己烯和苯的标准燃烧热分别为-3916 、-3747 、-3747 和-3265 和-3265 ,可以证明在苯分子中不存在独立的碳碳双键 ,可以证明在苯分子中不存在独立的碳碳双键 |
| D.碳纤维是一种高性能纤维材料,其不属于有机物范畴 |
您最近一年使用:0次
4 . 下列说法或表示方法正确的( )
A.在稀溶液中, ; ; ,若将含 ,若将含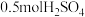 的硫酸与含1molNaOH的溶液混合,放出的热一定为 的硫酸与含1molNaOH的溶液混合,放出的热一定为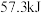 |
B.由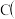 石墨 石墨 金刚石 金刚石 : : 可知,金刚石比石墨稳定 可知,金刚石比石墨稳定 |
C.实验测得环己烷 、环己烯 、环己烯 和苯 和苯 的标准燃烧分别为 的标准燃烧分别为 、 、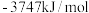 和 和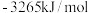 ,可以证明在苯分子中不存在独立的碳碳双键 ,可以证明在苯分子中不存在独立的碳碳双键 |
D.在101kPa时,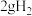 完全燃烧生成液态水,放出 完全燃烧生成液态水,放出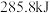 热量,则表示氢气燃烧热的热化学方程式为: 热量,则表示氢气燃烧热的热化学方程式为: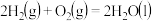 ; ;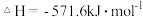 |
您最近一年使用:0次
2019-08-10更新
|
320次组卷
|
3卷引用:浙江省宁波市九校2018-2019学年高二上学期期末考试化学试题
5 . 化学反应既有物质变化,又有能量变化。能量变化通常以热、电、光等形式表现出来。
(1)相同温度下,相同质量的单质硫分别在足量空气中和足量纯氧中燃烧,放出的热量分别为a kJ和b kJ,则a_______ b(填“>”、“=”或“<”)。
(2)为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
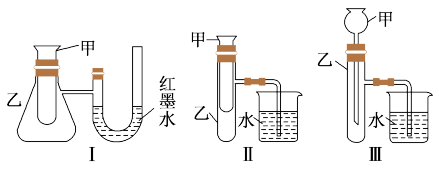
①上述装置中,不能证明“锌和稀硫酸反应是吸热反应还是放热反应”的是_______ (填序号)。
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是_______ ,化学反应方程式为_______ 。
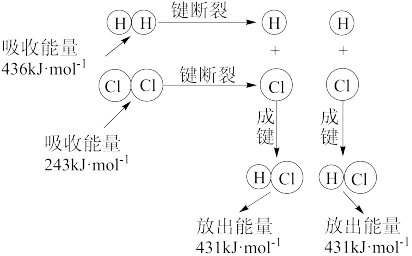
(3)在25℃、101kPa的条件下,断裂1mol H-H键吸收436 kJ能量,断裂1 mol Cl-Cl键吸收243 kJ能量,形成1mol H-Cl键放出431 kJ能量。该条件下反应H2+Cl2=2HCl中的能量变化可用下图表示,则对应的热化学方程式为_______ 。
(4)已知:CH4、H2的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1,则CO2和H2反应生成CH4和液态H2O的热化学方程式是_______ 。
(5)铅酸蓄电池是典型的可充电电池,它的正、负极格板是惰性材料,电池总反应式为:2PbSO4+2H2O Pb+PbO2+2H2SO4。放电时正极的电极反应式为
Pb+PbO2+2H2SO4。放电时正极的电极反应式为_______ ;室温下,若将铅酸电池作为电解饱和食盐水装置的电源,假设饱和食盐水体积为500mL且电解过程中溶液体积不变,当溶液pH=13时,铅酸电池负极质量将增加_______ g。
(1)相同温度下,相同质量的单质硫分别在足量空气中和足量纯氧中燃烧,放出的热量分别为a kJ和b kJ,则a
(2)为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

①上述装置中,不能证明“锌和稀硫酸反应是吸热反应还是放热反应”的是
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是
(3)在25℃、101kPa的条件下,断裂1mol H-H键吸收436 kJ能量,断裂1 mol Cl-Cl键吸收243 kJ能量,形成1mol H-Cl键放出431 kJ能量。该条件下反应H2+Cl2=2HCl中的能量变化可用下图表示,则对应的热化学方程式为

(4)已知:CH4、H2的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1,则CO2和H2反应生成CH4和液态H2O的热化学方程式是
(5)铅酸蓄电池是典型的可充电电池,它的正、负极格板是惰性材料,电池总反应式为:2PbSO4+2H2O
 Pb+PbO2+2H2SO4。放电时正极的电极反应式为
Pb+PbO2+2H2SO4。放电时正极的电极反应式为
您最近一年使用:0次
6 . 为减少交通事故,新交规明令禁止酒后驾车并对酒后驾车行为予以重罚。为检验驾驶员是否酒后驾车,可采用的检验方法有多种。回答以下问题:
(1)早期曾经采用五氧化二碘和某种高分子化合物X的混合溶液来检测酒精的存在。理是:I2O5与CH3CH2OH先发生反应(I2O5+5CH3CH2OH=I2+5Y+5H2O),生成的I2与高分子化合物X作用而变蓝。交警依据此原理来检测驾驶员是否饮酒。则:X的化学式是_____________ ;Y的化学式是_________ ;
(2)已知:I2O5是白色固体,可用于检验并定量测定空气中CO;两者在常温条件下发生的反应为5CO+I2O5=5CO2+I2(空气中其余气体不与I2O5反应);某同学设计如图实验装置完成上述目的。
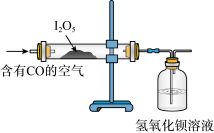
①指出能证明空气中有CO存在的现象:_____________ 。
②将上述反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗vmLcmol·L﹣1Na2S2O3溶液,则该空气样品中CO的体积分数是________ 。
③有同学提出只要依据参与反应的空气体积和洗气瓶中白色沉淀的质量也可求得空气中CO。此方案是否可行?_________ 。
(3)燃料电池酒精检测仪(该电池以硫酸溶液为电解质溶液)也是检测酒精含量的一种方法。总反应是:CH3CH2OH+O2=CH3COOH+H2O。该电池负极电极反应式是________________ 。
(4)酒精是一种较为环保的燃料,298K时,1g乙醇完全燃烧放出热量qkJ,写出乙醇燃烧的热化学方程式________ 。
(1)早期曾经采用五氧化二碘和某种高分子化合物X的混合溶液来检测酒精的存在。理是:I2O5与CH3CH2OH先发生反应(I2O5+5CH3CH2OH=I2+5Y+5H2O),生成的I2与高分子化合物X作用而变蓝。交警依据此原理来检测驾驶员是否饮酒。则:X的化学式是
(2)已知:I2O5是白色固体,可用于检验并定量测定空气中CO;两者在常温条件下发生的反应为5CO+I2O5=5CO2+I2(空气中其余气体不与I2O5反应);某同学设计如图实验装置完成上述目的。

①指出能证明空气中有CO存在的现象:
②将上述反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗vmLcmol·L﹣1Na2S2O3溶液,则该空气样品中CO的体积分数是
③有同学提出只要依据参与反应的空气体积和洗气瓶中白色沉淀的质量也可求得空气中CO。此方案是否可行?
(3)燃料电池酒精检测仪(该电池以硫酸溶液为电解质溶液)也是检测酒精含量的一种方法。总反应是:CH3CH2OH+O2=CH3COOH+H2O。该电池负极电极反应式是
(4)酒精是一种较为环保的燃料,298K时,1g乙醇完全燃烧放出热量qkJ,写出乙醇燃烧的热化学方程式
您最近一年使用:0次
名校
7 . 图1是部分短周期元素的常见化合价与原子序数的关系图:

请回答下列问题:
(1)元素F在周期表中的位置为________________
(2)C、D、E、G的简单离子半径由大到小的顺序为_______________ (用离子符号表示)。
(3)二元化合物X是含有元素A的18电子分子,3 g X(g)在25 ℃ 101 kPa 下完全燃烧生成稳定的化合物时放出Q kJ的热量,写出表示X燃烧热的热化学方程式:________________
(4)某同学设计实验用图2所示装置证明元素A、B、F的非金属性强弱(其中溶液b和溶液c均足量)。
①溶液b为_________________
②溶液c中发生反应的离子方程式为__________________

请回答下列问题:
(1)元素F在周期表中的位置为
(2)C、D、E、G的简单离子半径由大到小的顺序为
(3)二元化合物X是含有元素A的18电子分子,3 g X(g)在25 ℃ 101 kPa 下完全燃烧生成稳定的化合物时放出Q kJ的热量,写出表示X燃烧热的热化学方程式:
(4)某同学设计实验用图2所示装置证明元素A、B、F的非金属性强弱(其中溶液b和溶液c均足量)。
①溶液b为
②溶液c中发生反应的离子方程式为
您最近一年使用:0次
2019-12-30更新
|
116次组卷
|
3卷引用:湖南浏阳市第三中学2019—2020学年高三上学期12月月考化学考试题
解题方法
8 . 下列热化学方程式或离子方程式中,正确的是( )
| A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) ΔH = -890.3 kJ·mol-1 |
B.500ºC、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g) 2NH3(g) ΔH = -38.6 kJ·mol-1 2NH3(g) ΔH = -38.6 kJ·mol-1 |
| C.向明矾溶液中加入过量的氢氧化钡溶液:Al3+ + 2SO42-+ 2Ba2+ + 4OH- = 2BaSO4↓+ 2H2O + AlO2- |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5 O2↑+8H2O |
您最近一年使用:0次
名校
解题方法
9 . 有六种短周期元素,已知A的单质是最清洁的能源物质,其他元素的原子半径及主要化合价如下表:
根据上述信息回答以下问题。
(1)D在元素周期表中的位置____ ;E的离子结构示意图____ 。
(2)关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由________ 。
(3)用电子式表示B的单质与D的单质形成化合物的过程________ 。
(4)下列各项比较,正确的是___________ 。
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
(5)E单质常用于自来水消毒。用必要的文字和离子方程式解释原因___________ 。
(6)写出C的单质与B的最高价氧化物的水化物反应的离子方程式_____ 。
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为_____ 。
(8)已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式_____ 。
(9)已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论________ 。
| 元素代号 | B | C | D | E | F |
| 原子半径/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +1 | +3 | +6、-2 | +7、-1 | -2 |
根据上述信息回答以下问题。
(1)D在元素周期表中的位置
(2)关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由
(3)用电子式表示B的单质与D的单质形成化合物的过程
(4)下列各项比较,正确的是
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
(5)E单质常用于自来水消毒。用必要的文字和离子方程式解释原因
(6)写出C的单质与B的最高价氧化物的水化物反应的离子方程式
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为
(8)已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式
(9)已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论
您最近一年使用:0次
10 . Ⅰ.(1)在反应A(g)+3B(g)===2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L-1·min-1,则以物质B的化学反应速率为__________ mol·L-1·min-1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的此化学反应速率为vB=_________ mol·L-1·s-1。
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________ ,若此后各物质的量均不再变化,则证明此可逆反应达到了______ 的程度。
A.反应彻底 B.反应终止 C.化学平衡 D.无法判断
Ⅱ. 已知:①2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1;②N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1,则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH =________ 。
Ⅲ. 下列热化学方程式书写正确的是(ΔH的绝对值均正确)________ 。
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g)ΔH=-296.8 kJ·mol-1(燃烧热)
D.2NO2===O2+2NOΔH=+116.2 kJ·mol-1(反应热)
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的此化学反应速率为vB=
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)
 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有A.反应彻底 B.反应终止 C.化学平衡 D.无法判断
Ⅱ. 已知:①2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1;②N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1,则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH =
Ⅲ. 下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g)ΔH=-296.8 kJ·mol-1(燃烧热)
D.2NO2===O2+2NOΔH=+116.2 kJ·mol-1(反应热)
您最近一年使用:0次



