名校
1 . 过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq) CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
(1)利用上述反应制备760g CHCOH,放出的热量为_______ kJ。
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
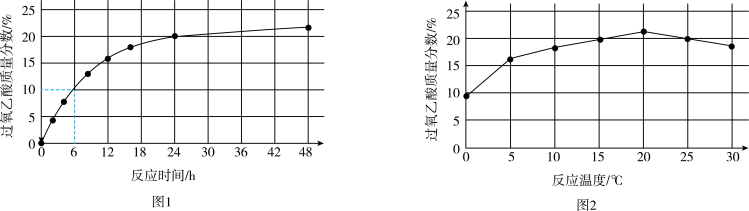 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=_____ g/h。(用含m的代数式表示)
②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是_______ (写出2条)。
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
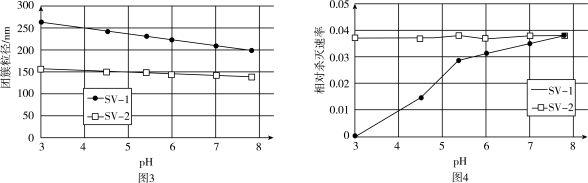
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是___________ 。
 CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol(1)利用上述反应制备760g CHCOH,放出的热量为
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。

依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是
您最近一年使用:0次
名校
解题方法
2 . 一些烷烃的燃烧热如下表:
下列说法正确的是
| 化合物 | ΔH/(kJ·mol-1) | 化合物 | ΔH/(kJ·mol-1) |
| 甲烷 | -891.0 | 正丁烷 | -2878.0 |
| 乙烷 | -1560.8 | 异丁烷 | -2869.6 |
| 丙烷 | -2221.5 | 2-甲基丁烷 | -3531.3 |
| A.正戊烷的燃烧热大约是3540 kJ·mol-1 |
| B.热稳定性:正丁烷>异丁烷 |
| C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1560.8 kJ·mol-1 |
| D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
您最近一年使用:0次
2021-08-27更新
|
574次组卷
|
17卷引用:宁夏银川一中2020-2021学年高二上学期期末考试化学试题
宁夏银川一中2020-2021学年高二上学期期末考试化学试题河南省洛阳市豫西名校2020-2021学年高二下学期第一次联考化学试题(已下线)1.1.3 能源的充分利用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1) 福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题(已下线)必考点01 化学反应的热效应-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)河南省信阳市2021-2022学年高二上学期期中考试化学试题(已下线)2010-2011学年安徽省马鞍山市第二中学高二下学期期中素质测试化学试卷(已下线)2010—2011学年安徽省马鞍山二中高二下学期期中考试化学试卷(理科)江西省上饶市玉山县第一中学2015-2016学年高二下学期重点班第一次月考化学卷(已下线)2018年10月16日 《每日一题》人教选修4-燃烧热及表示燃烧热的热化学方程式(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点步步为赢 高二化学暑假作业:作业七 化学反应与能量黑龙江省牡丹江市第一高级中学2019-2020学年高二上学期开学检测化学试题浙江省杭州市西湖高级中学2019-2020学年高二10月月考化学试题(已下线)考点08 化学反应中的能量变化——《备战2020年高考精选考点专项突破题集》第23届(2009年)全国高中学生化学竞赛(安徽赛区)初赛试题湖北省部分重点中学2022-2023学年高三下学期2月质量检测化学试题
名校
解题方法
3 . 重庆火锅、重庆小面都离不开辣椒,而辣椒的味道主要来自于辣椒素.兴趣小组探究其组成和性质,获得如下信息:
①元素分析仪测得该物质有C、H、O、N四种元素,其中氧元素含量为
②质谱仪测定该物质相对分子质量为305
③取 辣椒素完全燃烧,测得有
辣椒素完全燃烧,测得有 和
和 ,放出的热量可以使
,放出的热量可以使 水上升9.2℃(水的比热容为
水上升9.2℃(水的比热容为 )
)
④能与 反应放出
反应放出 ,但不能与
,但不能与 反应
反应
⑤能在强酸和强碱条件下水解
下列对辣椒素推测错误的是
①元素分析仪测得该物质有C、H、O、N四种元素,其中氧元素含量为

②质谱仪测定该物质相对分子质量为305
③取
 辣椒素完全燃烧,测得有
辣椒素完全燃烧,测得有 和
和 ,放出的热量可以使
,放出的热量可以使 水上升9.2℃(水的比热容为
水上升9.2℃(水的比热容为 )
)④能与
 反应放出
反应放出 ,但不能与
,但不能与 反应
反应⑤能在强酸和强碱条件下水解
下列对辣椒素推测错误的是
A.它的分子式为 |
B.它的燃烧热为 |
| C.它完全燃烧的产物可以不进行尾气处理 |
| D.它的结构中有多种含氧官能团 |
您最近一年使用:0次
2022-04-03更新
|
161次组卷
|
2卷引用:重庆市第一中学2021-2022学年高三上学期第三次月考化学试题
名校
4 . 下列说法正确的是
| A.需要加热才能发生的化学反应一定属于吸热反应 |
B.反应 在一定条件下能自发进行,则该反应的 在一定条件下能自发进行,则该反应的 |
| C.牙膏中加入氟化物可以防止龋齿,因此牙膏中氟含量越多越能保障人体健康 |
D.已知: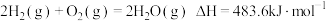 ,则氢气的燃烧热 ,则氢气的燃烧热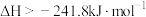 |
您最近一年使用:0次
5 . I、已知下列热化学方程式:
①2H2O(l)=2H2(g)+O2(g)△H=+570kJ/mol
②H2(g)+ O2(g)=H2O(l)△H=-285.6kJ/mol
O2(g)=H2O(l)△H=-285.6kJ/mol
③C(s)+ O2(g)=CO (g) △H=—110.5KJ/moL
O2(g)=CO (g) △H=—110.5KJ/moL
④C(s)+O2(g)=CO2(g) △H=—393.5KJ/moL。回答下列各问:
(1)上述反应中属于吸热反应的是_________________________ (填写对应序号)。
(2)H2的燃烧热△H=___ kJ/mol,C的燃烧热△H=_______ kJ/mol。
(3)燃烧10gH2生成液态水,放出的热量为____________ kJ。
(4)CO的燃烧热△H=__________ kJ/mol
II、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(5)图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______________________ 。
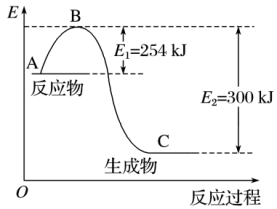
(6)该反应通常用铁触媒作催化剂,加铁触媒会使△H______ (填“变大”、“变小”或“不变”)
(7)若已知下列数据:
试根据表中及图中数据计算N—H的键能为_______ kJ/mol。
①2H2O(l)=2H2(g)+O2(g)△H=+570kJ/mol
②H2(g)+
 O2(g)=H2O(l)△H=-285.6kJ/mol
O2(g)=H2O(l)△H=-285.6kJ/mol ③C(s)+
 O2(g)=CO (g) △H=—110.5KJ/moL
O2(g)=CO (g) △H=—110.5KJ/moL ④C(s)+O2(g)=CO2(g) △H=—393.5KJ/moL。回答下列各问:
(1)上述反应中属于吸热反应的是
(2)H2的燃烧热△H=
(3)燃烧10gH2生成液态水,放出的热量为
(4)CO的燃烧热△H=
II、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(5)图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(6)该反应通常用铁触媒作催化剂,加铁触媒会使△H
(7)若已知下列数据:
| 化学键 | H—H | N≡N |
| 键能 (kJ/mol) | 435 | 943 |
试根据表中及图中数据计算N—H的键能为
您最近一年使用:0次
名校
6 . 请按照要求完成下列填空。
(1)在配制 的氯化钠溶液过程中,以下可能导致所配溶液浓度偏低的是
的氯化钠溶液过程中,以下可能导致所配溶液浓度偏低的是
(2)请写出实验室制乙炔的反应方程式___________ 制取的乙炔常含有硫化氢等杂质,用___________ 溶液除去。
(3)葡萄酒中通常要加 作为抗氧化剂和保鲜剂,为测定
作为抗氧化剂和保鲜剂,为测定 的含量通常用酸性高锰酸钾滴定的方法,请写出该反应原理的离子方程式:
的含量通常用酸性高锰酸钾滴定的方法,请写出该反应原理的离子方程式:___________
(4)漂白剂和洁厕灵(含盐酸)同时使用会使人中毒是什么原因呢?请用离子方程式解释:___________
(5)25℃,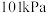 时,32g甲烷在足量的氧气中完全燃烧放出
时,32g甲烷在足量的氧气中完全燃烧放出 的热量,请写出甲烷燃烧热的热化学方程式:
的热量,请写出甲烷燃烧热的热化学方程式:___________
(1)在配制
 的氯化钠溶液过程中,以下可能导致所配溶液浓度偏低的是
的氯化钠溶液过程中,以下可能导致所配溶液浓度偏低的是| A.氯化钠固体不纯 | B.定容时仰视读数 |
| C.装瓶时有少量溶液洒出 | D.称量时砝码端忘垫质量相同的纸片 |
(3)葡萄酒中通常要加
 作为抗氧化剂和保鲜剂,为测定
作为抗氧化剂和保鲜剂,为测定 的含量通常用酸性高锰酸钾滴定的方法,请写出该反应原理的离子方程式:
的含量通常用酸性高锰酸钾滴定的方法,请写出该反应原理的离子方程式:(4)漂白剂和洁厕灵(含盐酸)同时使用会使人中毒是什么原因呢?请用离子方程式解释:
(5)25℃,
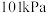 时,32g甲烷在足量的氧气中完全燃烧放出
时,32g甲烷在足量的氧气中完全燃烧放出 的热量,请写出甲烷燃烧热的热化学方程式:
的热量,请写出甲烷燃烧热的热化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 纳米金属燃料已应用到生活和高科技领域中。一些原子序数较小的金属、非金属和常用燃料的单位质量燃烧热的比较如图所示。

回答下列问题:
(1)结合元素在地壳中的含量,在单位质量燃烧热大于汽油和氢单质的物质中,最具发展潜力的两种新型燃料可以是___________ (填元素符号)。这些物质作为燃料使用,除具有高燃烧热值外,还具有的优点是___________ (填一项)。
(2)金属在较低温度下燃烧的关键技术之一是将其制成纳米颗粒,使得燃烧更为容易和充分,其原因是___________ 。
(3)Be粉和MnO2粉末在高温下可以发生反应(类似铝热反应),每消耗1 g Be粉放出a kJ热量,写出该反应的热化学方程式:___________ 。
(4)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1= +108.0 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2= -534.0 kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH3=___________ kJ·mol-1。

回答下列问题:
(1)结合元素在地壳中的含量,在单位质量燃烧热大于汽油和氢单质的物质中,最具发展潜力的两种新型燃料可以是
(2)金属在较低温度下燃烧的关键技术之一是将其制成纳米颗粒,使得燃烧更为容易和充分,其原因是
(3)Be粉和MnO2粉末在高温下可以发生反应(类似铝热反应),每消耗1 g Be粉放出a kJ热量,写出该反应的热化学方程式:
(4)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1= +108.0 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2= -534.0 kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH3=
您最近一年使用:0次
名校
解题方法
8 . 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ②
则途径I放出的热量___________ (填“大于”“等于”或“小于”)途径II放出的热量;ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是___________ 。
(2)在25℃、101kPa下,2g甲醇完全燃料放热45.36kJ,写出甲醇燃烧热的热化学方程式___________ 。
(3)已知①CO(g)+ O2(g)=CO2(g) ∆H1=-283.0kJ/mol
O2(g)=CO2(g) ∆H1=-283.0kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=___________ 。
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应I:2H2SO4(l)=2SO2(g)+2H2O(g) ∆H1=+551kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ∆H3=-297kJ/mol
反应Ⅱ的热化学方程式:___________
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)=2H2O(g) ΔH4<0 ④
则途径I放出的热量
(2)在25℃、101kPa下,2g甲醇完全燃料放热45.36kJ,写出甲醇燃烧热的热化学方程式
(3)已知①CO(g)+
 O2(g)=CO2(g) ∆H1=-283.0kJ/mol
O2(g)=CO2(g) ∆H1=-283.0kJ/mol②H2(g)+ O2(g)=H2O(l) ΔH2=-285.8kJ/mol
O2(g)=H2O(l) ΔH2=-285.8kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应I:2H2SO4(l)=2SO2(g)+2H2O(g) ∆H1=+551kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ∆H3=-297kJ/mol
反应Ⅱ的热化学方程式:
您最近一年使用:0次
2021-10-15更新
|
194次组卷
|
2卷引用:广东省梅州市梅江区梅州中学2021-2022学年高二上学期阶段性考试化学试题
9 . 在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的物质。
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJmol-1
②C和CO的燃烧热分别为393.5kJmol1和283kJmol1
则2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=_______ 。
(2)已知充分燃烧乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为_______ 。
(3)25℃,101kPa时,强酸与强碱的稀溶液反应时,每生成1molH2O(l)会放出57.3kJ的热量,写出表示氢氧化钠溶液和稀硫酸反应的中和热的热化学方程式为:_______
(4)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)2X(g)⇌Y(g)Z(s)
(乙)A(s)2B(g)⇌C(g)D(g)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是_______ ;能表明(乙)达到化学平衡状态是_______ 。
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJmol-1
②C和CO的燃烧热分别为393.5kJmol1和283kJmol1
则2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=
(2)已知充分燃烧乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为
(3)25℃,101kPa时,强酸与强碱的稀溶液反应时,每生成1molH2O(l)会放出57.3kJ的热量,写出表示氢氧化钠溶液和稀硫酸反应的中和热的热化学方程式为:
(4)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)2X(g)⇌Y(g)Z(s)
(乙)A(s)2B(g)⇌C(g)D(g)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
您最近一年使用:0次
解题方法
10 . 化学物质在汽车的动力、安全等方面有着极为重要的作用。
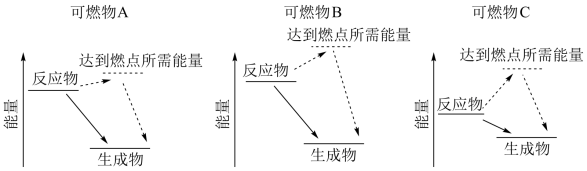
(1)某同学根据所查阅的资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图,你认为可燃物_______ (填“A”、“B”或“C”)更适合用作车用燃料。(已知:燃点是指在规定的条件下,应用外部热源使物质表面起火并持续燃烧一定时间所需的最低温度,燃点较低时存在安全隐患。)
(2)汽车尾气中含有 、
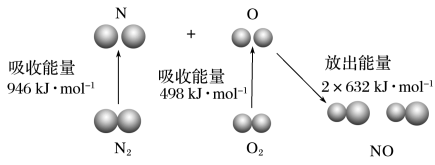
、 等污染物。其中
等污染物。其中 生成过程的能量变化如图,由该图数据计算可得,该反应为
生成过程的能量变化如图,由该图数据计算可得,该反应为_______ (填“吸热”或“放热”)反应。
(3)通过 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
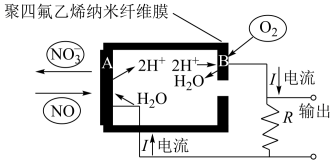
①A电极发生的是_______ 反应(填“氧化”或“还原”)。
②B电极反应为_______ 。
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应为 。
。
①当有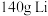 消耗时,电路中转移电子数目为
消耗时,电路中转移电子数目为_______ 。
②根据①的计算思路,分析 做电极优于
做电极优于 的原因是
的原因是_______ 。
(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有 、
、 、
、 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。
①药剂中 做冷却剂原因是
做冷却剂原因是_______ 。
②根据产气药剂的组成,在设计气囊中所运用的化学反应时,需要考虑的角度有_______ (填标号)。
A.固体反应物的颜色 B.气体产物的毒性 C.反应的快慢 D.反应的能量变化
(1)某同学根据所查阅的资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图,你认为可燃物

(2)汽车尾气中含有
 、
、 等污染物。其中
等污染物。其中 生成过程的能量变化如图,由该图数据计算可得,该反应为
生成过程的能量变化如图,由该图数据计算可得,该反应为
(3)通过
 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
①A电极发生的是
②B电极反应为
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应为
 。
。①当有
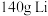 消耗时,电路中转移电子数目为
消耗时,电路中转移电子数目为②根据①的计算思路,分析
 做电极优于
做电极优于 的原因是
的原因是(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有
 、
、 、
、 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。①药剂中
 做冷却剂原因是
做冷却剂原因是②根据产气药剂的组成,在设计气囊中所运用的化学反应时,需要考虑的角度有
A.固体反应物的颜色 B.气体产物的毒性 C.反应的快慢 D.反应的能量变化
您最近一年使用:0次



