9-10高二下·福建泉州·期中
名校
1 . 共价键的断裂有均裂和异裂两种方式,即均裂:A∶B → A·+B· ;异裂:A∶B → A++[∶B]-。下列化学反应中发生共价键均裂的是
| A.2K+2H2O=2KOH+H2↑ |
| B.2Na+2C2H5OH → 2C2H5ONa+H2↑ |
C.Na2CO3+H2O NaHCO3+NaOH NaHCO3+NaOH |
D.CH3COOH+C2H5OH 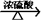 H2O+CH3COOC2H5 H2O+CH3COOC2H5 |
您最近一年使用:0次
2018-06-25更新
|
168次组卷
|
5卷引用:2010—2011学年山西省平遥中学高二下学期期中考试化学试卷
(已下线)2010—2011学年山西省平遥中学高二下学期期中考试化学试卷(已下线)2009—2010泉州七中学年度下学期高二年期中考试化学卷云南省石屏县一中2017-2018学年高二下学期六月份月考化学试题安徽省师范大学附属中学2019届高三上学期9月测试(二)化学试题云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题
2 . Ⅰ.纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:C(s)+ O2(g)=CO(g)ΔH =–110.4kJ•mol-1,
O2(g)=CO(g)ΔH =–110.4kJ•mol-1,
2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJ•mol-1,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为________ 。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:
CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
①该反应的ΔH___ 0 (填“>”或“<”);600K时,Y点甲醇的v(正) ____ v(逆)(填“>”或“<”)。
②从Y点到X点可采取的措施是___________________________________ 。
③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=_____________ , 温度为t1时,该反应的平衡常数K=____________ 。
Ⅱ.金属铜因导电性强而应用广泛。
由黄铜矿冶炼得到的粗铜经过电解精炼才能得到纯铜。电解时,粗铜作______ 极,阴极的电极反应式为_______________ 。
Ⅲ.含铜离子的的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
已知:Ksp[CuS]=1×10-36,要使铜离子的浓度符合排放标准(不超过0.5mg/L),溶液中的硫离子的物质的量浓度至少为__________ mol/L(保留至小数点后一位)。
(1)已知:C(s)+
 O2(g)=CO(g)ΔH =–110.4kJ•mol-1,
O2(g)=CO(g)ΔH =–110.4kJ•mol-1,
2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJ•mol-1,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:
CH3OH(g)
 HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。①该反应的ΔH
②从Y点到X点可采取的措施是
③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=
Ⅱ.金属铜因导电性强而应用广泛。
由黄铜矿冶炼得到的粗铜经过电解精炼才能得到纯铜。电解时,粗铜作
Ⅲ.含铜离子的的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
已知:Ksp[CuS]=1×10-36,要使铜离子的浓度符合排放标准(不超过0.5mg/L),溶液中的硫离子的物质的量浓度至少为
您最近一年使用:0次
2018-11-07更新
|
183次组卷
|
3卷引用:【全国百强校】山西省晋中市平遥县平遥中学2019届高三上学期12月月考化学试题
14-15高二上·甘肃庆阳·期中
名校
3 . 根据碘与氢气反应的热化学方程式 (i)I2(g)+H2(g) 2HI(g) △H=-9.48kJ/mol ,(ii) I2(s)+H2(g)
2HI(g) △H=-9.48kJ/mol ,(ii) I2(s)+H2(g) 2HI(g) △H=+26.48kJ/mol,下列判断正确的是
2HI(g) △H=+26.48kJ/mol,下列判断正确的是
 2HI(g) △H=-9.48kJ/mol ,(ii) I2(s)+H2(g)
2HI(g) △H=-9.48kJ/mol ,(ii) I2(s)+H2(g) 2HI(g) △H=+26.48kJ/mol,下列判断正确的是
2HI(g) △H=+26.48kJ/mol,下列判断正确的是| A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1mol气态碘所含的能量相差l7.00 kJ |
| C.反应(i)的产物比反应(ii)的产物稳定 |
| D.反应(i) 拆开1mol I-I键与1mol H-H键需要的总能量小于拆开2mol H-I键需要的总能量 |
您最近一年使用:0次
2016-09-18更新
|
318次组卷
|
7卷引用:山西省晋中市和诚中学2019-2020学年高一3月月考化学试题
名校
4 . (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。
反应的热化学方程式为___________________________________________ 。
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是___________ kJ。
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为___________________ 。
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:___________ 。
反应的热化学方程式为
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:
您最近一年使用:0次
2018-11-30更新
|
137次组卷
|
2卷引用:山西省晋中市平遥县第二中学2018-2019学年高二上学期期中考试化学试题
名校
解题方法
5 . CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)利用废气中的二氧化碳为原料可以制取甲醇。一定条件下,在恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ ·mol-1
CH3OH(l)= CH3OH(g)△H=+35.2kJ·mol-1
H2O(l)=H2O(g)△H=+44kJ·mol-1。
则CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=
CH3OH(g)+H2O(g)△H=_____ kJ·mol-1。有利于提高H2平衡转化率的条件是_______ (填选项字母)。
A高温低压B低温高压C高温高压D低温低压
②某温度下,向体积为2L的容器中充入6molH2、4molCO2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为____ (保留两位有效数字)。
③起始条件(T1℃、2L密闭容器)如下表所示:

达到平衡时,该反应的平衡常数K(I)____ K(II)(填“>”“<”或“=”,下同)。平衡时CH3OH的浓度:c(I)______ c(II)。
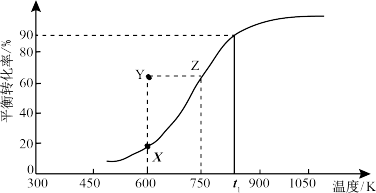
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)→CH2=CH2(g)+4H2O(g)△H= -127.8 kJ·mol-1。0.1MPa下,按n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(φ)如图所示:
①曲线b、c表示的物质分别为_________________ (填化学式)。
②保持温度不变,在体积为VL的恒容容器中以n(CO2):n(H2)=2:3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象_________
(3)工业上,还可以利用太阳能以CO2为原料制取C,使得二氧化碳资源化,其原理如下图所示:
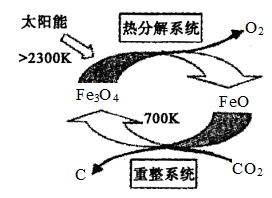
整个过程中____ (填“Fe3O4”或“FeO”)是反应的催化剂。重整系统中每生成1mol Fe3O4,转移电子的物质的量为____ 。
(1)利用废气中的二氧化碳为原料可以制取甲醇。一定条件下,在恒容密闭容器中发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ ·mol-1
CH3OH(l)= CH3OH(g)△H=+35.2kJ·mol-1
H2O(l)=H2O(g)△H=+44kJ·mol-1。
则CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=
CH3OH(g)+H2O(g)△H=A高温低压B低温高压C高温高压D低温低压
②某温度下,向体积为2L的容器中充入6molH2、4molCO2,发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为③起始条件(T1℃、2L密闭容器)如下表所示:

达到平衡时,该反应的平衡常数K(I)
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)→CH2=CH2(g)+4H2O(g)△H= -127.8 kJ·mol-1。0.1MPa下,按n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(φ)如图所示:

①曲线b、c表示的物质分别为
②保持温度不变,在体积为VL的恒容容器中以n(CO2):n(H2)=2:3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象

(3)工业上,还可以利用太阳能以CO2为原料制取C,使得二氧化碳资源化,其原理如下图所示:

整个过程中
您最近一年使用:0次
名校
解题方法
6 . 雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO 2CO2(g)+N2(g) △H<O
2CO2(g)+N2(g) △H<O
①反应的速率时间图像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是(填对应字母)__________
B.b1<b2
C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)__________
已知:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g) N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:__________ .
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2O⇌CO+3H2,该反应在不同温度下的化学平衡常数如表:
①该反应是__________ 反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投入l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O CO+3H2的平衡常数K=
CO+3H2的平衡常数K=__________ ;
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。__________
②电解后溶液的pH=__________ (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是__________ L。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO
 2CO2(g)+N2(g) △H<O
2CO2(g)+N2(g) △H<O①反应的速率时间图像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是(填对应字母)

B.b1<b2
C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)
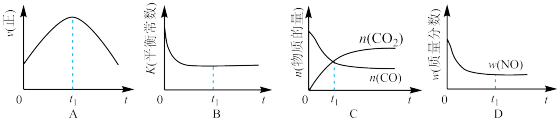
已知:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol2NO2(g)
 N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol
N2O4(g)△H=﹣56.9kJ/mol H2O(g)=H2O(l)△H=﹣44.0kJ/mol写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2O⇌CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投入l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O
 CO+3H2的平衡常数K=
CO+3H2的平衡常数K=(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
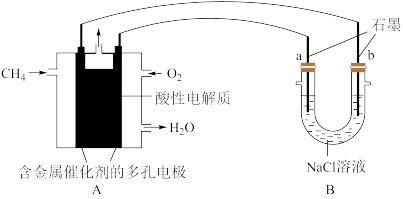
②电解后溶液的pH=
③阳极产生气体的体积在标准状况下是
您最近一年使用:0次
2017-02-17更新
|
377次组卷
|
7卷引用:2016届山西省祁县中学高三5月月考理综化学试卷
解题方法
7 . 臭氧(O3)主要分布在大气层的平流层中,能够吸收紫外线,被称为地球的保护伞。回答下列问题:
(1)NOx对臭氧层的破坏作用极大,已知:①NO+O3=NO2+O2 K1;NO2+O2=NO+O3; K2;③O2+O=O3 K3,反应2O3=3O2的平衡常数K=_______ (用K1、K2、K3表示),写出一种保护臭氧层的措施:__________ 。
(2)用臭氧氧化烟气中的SO2的主要反应为SO2(g)+O3(g)=SO3(g)+O2(g) △H,已知①2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ/mol,②2O3(g)=3O2(g) △H2=+284.2kJ/mol
①上述反应中△H=____ kJ•mol-1。
②一定温度下,向2L固定容积的密闭容器中加入2molO3和2molSO2发生上述反应,5min后达到平衡,测得容器中含有0.4mol•L-1SO3,此时SO2的转化率为_______ ,欲提高O3的利用率可采取的措施有_______ (填字母)。
a.适当增大压强 b.升高温度 c.使用优质催化剂 d.及时分离出SO3
(3)工业上用CaSO3悬浊液吸收上述转化生成的SO3可制备石膏。已知:298K时Ksp(CaSO4)=9.0×10-6,Ksp(CaSO3)=1.5×10-7,向1LCaSO3悬浊液中加入Na2SO4,若有0.1molCaSO3参与反应,则需加入_______ molNa2SO4。
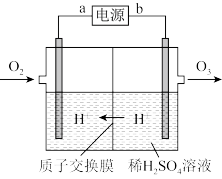
(4)工业上可采用惰性电极电极电解稀硫酸的方法制备O3,反应装置如上图所示,电源的a极为_____ 极,通入O2的电极反应式为_______ 。
(1)NOx对臭氧层的破坏作用极大,已知:①NO+O3=NO2+O2 K1;NO2+O2=NO+O3; K2;③O2+O=O3 K3,反应2O3=3O2的平衡常数K=
(2)用臭氧氧化烟气中的SO2的主要反应为SO2(g)+O3(g)=SO3(g)+O2(g) △H,已知①2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ/mol,②2O3(g)=3O2(g) △H2=+284.2kJ/mol
①上述反应中△H=
②一定温度下,向2L固定容积的密闭容器中加入2molO3和2molSO2发生上述反应,5min后达到平衡,测得容器中含有0.4mol•L-1SO3,此时SO2的转化率为
a.适当增大压强 b.升高温度 c.使用优质催化剂 d.及时分离出SO3
(3)工业上用CaSO3悬浊液吸收上述转化生成的SO3可制备石膏。已知:298K时Ksp(CaSO4)=9.0×10-6,Ksp(CaSO3)=1.5×10-7,向1LCaSO3悬浊液中加入Na2SO4,若有0.1molCaSO3参与反应,则需加入

(4)工业上可采用惰性电极电极电解稀硫酸的方法制备O3,反应装置如上图所示,电源的a极为
您最近一年使用:0次
名校
解题方法
8 . 研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_______ kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_____ (填序号)。
A.容器内的混合气体的密度保持不变 B.反应体系总压强保持不变
C.断裂3NA个H-O键同时断裂2NA个C=O键 D.CH3OH和H2O的浓度之比保持不变
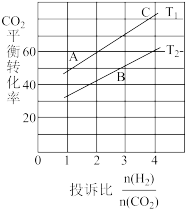
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
此时v正___ v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)%=____ %。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=______ 。KA、KB、KC三者之间的关系是___
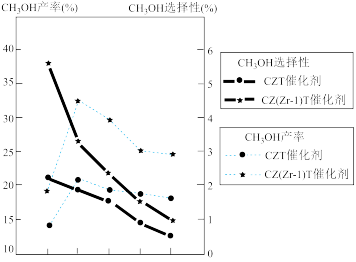
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
其中:CH3OH的选择性=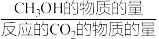 ×100%
×100%
①温度高于230℃,CH3OH产率随温度升高而下降的原因是_________________ 。
②在上述条件下合成甲醇的工业条件是______________________ 。
A.210℃ B. 230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H3
(1)△H3=
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是
A.容器内的混合气体的密度保持不变 B.反应体系总压强保持不变
C.断裂3NA个H-O键同时断裂2NA个C=O键 D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
| 物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
| 浓度/mol∙L-1 | 1.8 | 1.8 | 0.4 |
此时v正
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=


(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
其中:CH3OH的选择性=
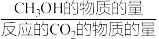 ×100%
×100%①温度高于230℃,CH3OH产率随温度升高而下降的原因是
②在上述条件下合成甲醇的工业条件是
A.210℃ B. 230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
您最近一年使用:0次
名校
9 . 科学家最近研究出一种环保,安全的储氢方法,其原理可表示为NaHCO3+H2 HCOONa+H2O,下列有关说法不正确的是( )
HCOONa+H2O,下列有关说法不正确的是( )
 HCOONa+H2O,下列有关说法不正确的是( )
HCOONa+H2O,下列有关说法不正确的是( )| A.储氢、释氢过程均有能量变化 |
| B.储氢过程中,NaHCO3被还原 |
| C.NaHCO3、HCOONa均含有离子键和共价键 |
| D.释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2 |
您最近一年使用:0次
10 . 某反应在催化剂的作用下按以下两步进行:第一步为X+Y=Z;第二步为Y+Z=M+N+X。此反应的总的化学方程式是___ ,反应的催化剂是___ 。
您最近一年使用:0次



