1 . 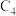 链烷烃来源于天然气、油田伴生气等,价格低廉,合理利用该资源开发化工产品具有十分重要的意义。回答下列问题:
链烷烃来源于天然气、油田伴生气等,价格低廉,合理利用该资源开发化工产品具有十分重要的意义。回答下列问题:
(1)已知;完全燃烧正丁烷生成5mol (l)和完全燃烧异丁烷生成5mol
(l)和完全燃烧异丁烷生成5mol  (l)放出热量分别为2878kJ、2869kJ,则正丁烷转化为异丁烷的热化学方程式为
(l)放出热量分别为2878kJ、2869kJ,则正丁烷转化为异丁烷的热化学方程式为_____________________ 。
(2)控制适当的反应条件,发生反应: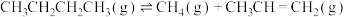 △H>0。实验测得
△H>0。实验测得 ;
;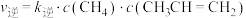 ,其中
,其中 、
、 为速率常数。在两种压强(分别为
为速率常数。在两种压强(分别为 、
、 且
且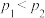 )下,分别测得
)下,分别测得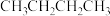 (g)与
(g)与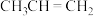 (g)平衡时的体积分数随温度的变化趋势如图所示。
(g)平衡时的体积分数随温度的变化趋势如图所示。__________ (用速率常数表示),速率常数与温度________ (填“有关”或“无关”)。
② 、
、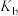 、
、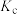 的相对大小关系是
的相对大小关系是______________ (用“>”“<”或“=”连接)。
③线Ⅱ、线Ⅲ的含义分别表示_____________________ 。
(3)若不加控制,通常同时存在反应: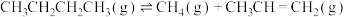 和
和
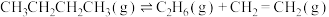 。T℃时,向恒容密闭容器中投入
。T℃时,向恒容密闭容器中投入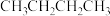 (g)发生前述反应,部分物质的浓度随时间变化如图所示,平衡时压强为17pPa。
(g)发生前述反应,部分物质的浓度随时间变化如图所示,平衡时压强为17pPa。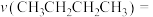
_________  (保留三位有效数字,各组分分压=总压×
(保留三位有效数字,各组分分压=总压×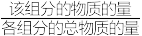 );6min时,增大正丁烷浓度,
);6min时,增大正丁烷浓度,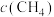 的变化对应图中线
的变化对应图中线___________ (填字母序号)。
②T℃时,反应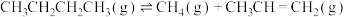 用分压表示的平衡常数
用分压表示的平衡常数
________ Pa。
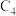 链烷烃来源于天然气、油田伴生气等,价格低廉,合理利用该资源开发化工产品具有十分重要的意义。回答下列问题:
链烷烃来源于天然气、油田伴生气等,价格低廉,合理利用该资源开发化工产品具有十分重要的意义。回答下列问题:(1)已知;完全燃烧正丁烷生成5mol
 (l)和完全燃烧异丁烷生成5mol
(l)和完全燃烧异丁烷生成5mol  (l)放出热量分别为2878kJ、2869kJ,则正丁烷转化为异丁烷的热化学方程式为
(l)放出热量分别为2878kJ、2869kJ,则正丁烷转化为异丁烷的热化学方程式为(2)控制适当的反应条件,发生反应:
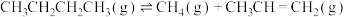 △H>0。实验测得
△H>0。实验测得 ;
;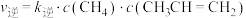 ,其中
,其中 、
、 为速率常数。在两种压强(分别为
为速率常数。在两种压强(分别为 、
、 且
且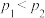 )下,分别测得
)下,分别测得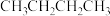 (g)与
(g)与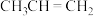 (g)平衡时的体积分数随温度的变化趋势如图所示。
(g)平衡时的体积分数随温度的变化趋势如图所示。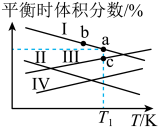
②
 、
、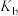 、
、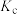 的相对大小关系是
的相对大小关系是③线Ⅱ、线Ⅲ的含义分别表示
(3)若不加控制,通常同时存在反应:
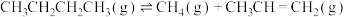 和
和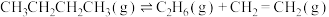 。T℃时,向恒容密闭容器中投入
。T℃时,向恒容密闭容器中投入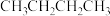 (g)发生前述反应,部分物质的浓度随时间变化如图所示,平衡时压强为17pPa。
(g)发生前述反应,部分物质的浓度随时间变化如图所示,平衡时压强为17pPa。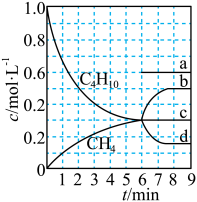
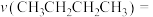
 (保留三位有效数字,各组分分压=总压×
(保留三位有效数字,各组分分压=总压×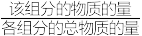 );6min时,增大正丁烷浓度,
);6min时,增大正丁烷浓度,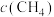 的变化对应图中线
的变化对应图中线②T℃时,反应
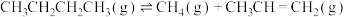 用分压表示的平衡常数
用分压表示的平衡常数
您最近一年使用:0次
2024-06-01更新
|
43次组卷
|
2卷引用:2024届山西省平遥县第二中学校高三下学期冲刺调研押题卷(五)理综试题-高中化学
名校
解题方法
2 .  捕获技术用于去除气流中的
捕获技术用于去除气流中的 或者分离出
或者分离出 作为气体产物,其中
作为气体产物,其中 催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
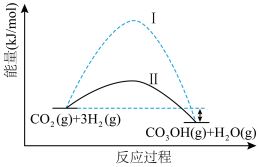
(1)温度为523 K时,测得上述反应中生成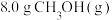 放出的热量为12.3 kJ。反应的热化学方程式为
放出的热量为12.3 kJ。反应的热化学方程式为___________ 。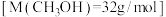
(2)从图可知,有催化剂存在的是过程___________ (填“Ⅰ”或“Ⅱ”)。
(3)一定温度下(各物质均为气态),向体积为2 L的恒容密闭容器中充入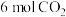 和
和 ,加入合适催化剂进行反应。某时刻测得
,加入合适催化剂进行反应。某时刻测得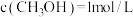 ,此时反应
,此时反应___________ (填“正向移动”、“逆向移动”或“达到平衡)。已知该温度下反应的化学平衡常数值为1/40.
(4)关于 催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。
催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。
(5)制备过程中存在副反应: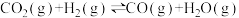
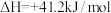 将混合气按进料比
将混合气按进料比 通入反应装置,选择合适催化剂发生反应。不同温度和压强下,
通入反应装置,选择合适催化剂发生反应。不同温度和压强下, 平衡产率和
平衡产率和 平衡转化率分别如图1、图2。
平衡转化率分别如图1、图2。
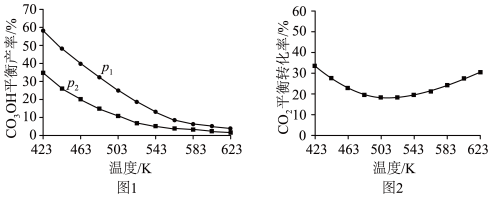
①图1中,压强
___________  (填“>”“=”或“<”),推断的依据是
(填“>”“=”或“<”),推断的依据是___________ 。
②图2中,压强为 ,温度高于503 K后,
,温度高于503 K后, 平衡转化率随温度升高而增大的原因是
平衡转化率随温度升高而增大的原因是___________ 。
 捕获技术用于去除气流中的
捕获技术用于去除气流中的 或者分离出
或者分离出 作为气体产物,其中
作为气体产物,其中 催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
(1)温度为523 K时,测得上述反应中生成
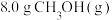 放出的热量为12.3 kJ。反应的热化学方程式为
放出的热量为12.3 kJ。反应的热化学方程式为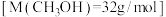
(2)从图可知,有催化剂存在的是过程
(3)一定温度下(各物质均为气态),向体积为2 L的恒容密闭容器中充入
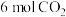 和
和 ,加入合适催化剂进行反应。某时刻测得
,加入合适催化剂进行反应。某时刻测得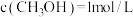 ,此时反应
,此时反应(4)关于
 催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。
催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。| A.该反应原子转化率为100% |
B.该反应可用于 的转化,有助于缓解温室效应 的转化,有助于缓解温室效应 |
C.使用催化剂可以降低该反应的 ,从而使反应放出更多热量 ,从而使反应放出更多热量 |
D.降温分离液态甲醇和水,将剩余气体重新通入反应器,可提高 与 与 的利用率 的利用率 |
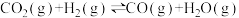
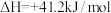 将混合气按进料比
将混合气按进料比 通入反应装置,选择合适催化剂发生反应。不同温度和压强下,
通入反应装置,选择合适催化剂发生反应。不同温度和压强下, 平衡产率和
平衡产率和 平衡转化率分别如图1、图2。
平衡转化率分别如图1、图2。
①图1中,压强

 (填“>”“=”或“<”),推断的依据是
(填“>”“=”或“<”),推断的依据是②图2中,压强为
 ,温度高于503 K后,
,温度高于503 K后, 平衡转化率随温度升高而增大的原因是
平衡转化率随温度升高而增大的原因是
您最近一年使用:0次
2021-11-15更新
|
185次组卷
|
2卷引用:山西省介休市第十中学2022-2023学年高二上学期 期中考试化学试题
解题方法
3 . 尿素 是人体和动物的代谢产物之一,氨基甲酸铵(
是人体和动物的代谢产物之一,氨基甲酸铵(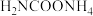 )是以氨气和二氧化碳为原料合成尿素的中间产物。
)是以氨气和二氧化碳为原料合成尿素的中间产物。
(1)合成尿素的总反应可表示为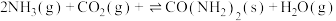 ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:
I.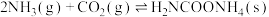
 kJ/mol
kJ/mol
II.
 kJ/mol
kJ/mol
①总反应的
______ 。
②若反应II为慢反应,下列示意图中能体现上述反应能量变化的是______ 。
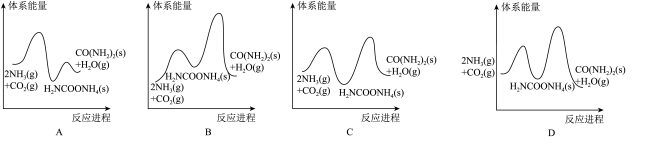
③能定性表示反应I的 随温度变化的曲线是
随温度变化的曲线是______ (填“A”或“B”)。
④尿素中C原子的杂化方式为________________________ 。
(2)尿素废水使水体富营养化,通过电解法处理后可排放,其装置示意图如图所示。
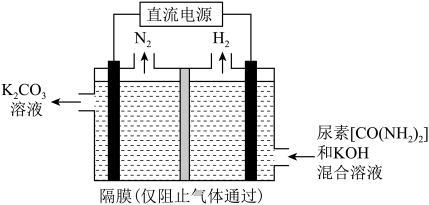
①该装置阳极的电极反应式为__________________ 。
 是人体和动物的代谢产物之一,氨基甲酸铵(
是人体和动物的代谢产物之一,氨基甲酸铵(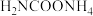 )是以氨气和二氧化碳为原料合成尿素的中间产物。
)是以氨气和二氧化碳为原料合成尿素的中间产物。(1)合成尿素的总反应可表示为
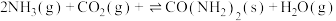 ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:I.
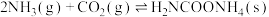
 kJ/mol
kJ/molII.

 kJ/mol
kJ/mol①总反应的

②若反应II为慢反应,下列示意图中能体现上述反应能量变化的是

③能定性表示反应I的
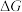 随温度变化的曲线是
随温度变化的曲线是
④尿素中C原子的杂化方式为
(2)尿素废水使水体富营养化,通过电解法处理后可排放,其装置示意图如图所示。

①该装置阳极的电极反应式为
您最近一年使用:0次
名校
解题方法
4 . 科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔHl =-76.0 kJ·mol-1
ⅱ. C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = +113.4 kJ·mol-1
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) ΔH3 =_________ kJ·mol-1。
(2)在反应i中,每放出38.0 kJ热量,有______ g FeO被氧化。
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
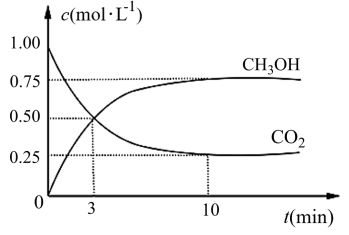
(3)从反应开始到平衡,氢气的平均反应速率v(H2)=________ mol·(L·min) -1。
(4)氢气的转化率=________________________ 。
(5)该反应的平衡常数为__________________________ (保留小数点后2位)。
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
(7)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________ c2的关系(填“>”、“<”或“=”)。
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L-1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)将该吸收液蒸干,灼烧至恒重,所得固体的成分是_________ (填化学式)。
Ⅰ.CO2可用FeO 吸收获得H2。
i. 6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔHl =-76.0 kJ·mol-1
ⅱ. C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = +113.4 kJ·mol-1
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) ΔH3 =
(2)在反应i中,每放出38.0 kJ热量,有
Ⅱ.CO2可用来生产燃料甲醇。
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(3)从反应开始到平衡,氢气的平均反应速率v(H2)=
(4)氢气的转化率=
(5)该反应的平衡常数为
(6)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.再充入1 mol H2 | D.将H2O(g)从体系中分离出去 |
III.CO2可用碱溶液吸收获得相应的原料。
利用100 mL 3 mol·L-1NaOH溶液吸收4.48 LCO2(标准状况),得到吸收液。
(8)将该吸收液蒸干,灼烧至恒重,所得固体的成分是
您最近一年使用:0次
名校
解题方法
5 . 2022年中国航天在诸多领域实现重大突破。空间站一种处理 的重要方法是对
的重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:
进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:_______ 。
(2)Sabatier反应
已知:H2(g)、CH4(g)的燃烧热分别为285.8kJ•mol-1、890.3kJ•mol-1,H2O(l)=H2O(g) ΔH = +44kJ•mol-1。
①则反应Ⅰ:CO2(g) +4H2(g) CH4(g) +2H2O(g) 的ΔH =
CH4(g) +2H2O(g) 的ΔH =_____ kJ•mol-1。
②科学家研究Sabatier反应,部分历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中错误的是_______ 。
B.该转化反应的速率取决于Ts1的能垒
C.·HOCO转化为·CO和·OH的反应ΔH<0
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
③空间站的反应器内,通常采用反应器前段加热,后段冷却的方法以提高CO2的转化效率,原因是_______ 。
④在CO2催化加氢制甲烷过程中存在竞争性的反应Ⅱ:CO2(g)+ H2(g) CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)= ______ mol•L-1•min-1;反应Ⅱ的平衡常数Kp=______ (Kp是用分压表示的平衡常数,用各组分的分压代替浓度)。
 的重要方法是对
的重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为:
进行收集和再生处理,重新生成可供人体呼吸的氧气。部分技术路线可分为: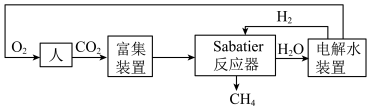
(2)Sabatier反应
已知:H2(g)、CH4(g)的燃烧热分别为285.8kJ•mol-1、890.3kJ•mol-1,H2O(l)=H2O(g) ΔH = +44kJ•mol-1。
①则反应Ⅰ:CO2(g) +4H2(g)
 CH4(g) +2H2O(g) 的ΔH =
CH4(g) +2H2O(g) 的ΔH =②科学家研究Sabatier反应,部分历程如图所示,吸附在催化剂表面上的物种用“·”标注,Ts表示过渡态。下列说法中错误的是

B.该转化反应的速率取决于Ts1的能垒
C.·HOCO转化为·CO和·OH的反应ΔH<0
D.催化剂能降低反应的活化能,提高反应物的平衡转化率
③空间站的反应器内,通常采用反应器前段加热,后段冷却的方法以提高CO2的转化效率,原因是
④在CO2催化加氢制甲烷过程中存在竞争性的反应Ⅱ:CO2(g)+ H2(g)
 CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
CO(g)+ H2O(g),一定温度下,向10L恒容密闭容器中充入1mol CO2和1mol H2,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得CO2的转化率为50%,CH4与CO的分压之比为1∶4,H2O(g)的分压为p0.则0~5min内,平均反应速率v(H2)=
您最近一年使用:0次
2024-01-22更新
|
55次组卷
|
2卷引用:山西省晋中市介休市第十中学2022-2023学年高二上学期期末考试化学试卷
名校
解题方法
6 . 氮、硫的化合物合成、应用以及对环境的影响一直是科学界研究的热点。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g) H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l) H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
请回答:CO(NH2)2 (l)+H2O(l) 2NH3(l)+CO2(g) ΔH3=
2NH3(l)+CO2(g) ΔH3=_____________ ,该反应能自发进行的主要原因是__________________ .
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g) S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
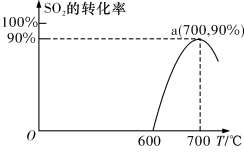
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=_______ mol•L-1•min-1,该温度下的平衡常数为_________ .
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率________ 90%(填“>”、“<”或“=”).
③下列说法一定能说明该反应达到平衡状态的是_______ .
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.
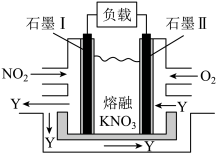
石墨I附近发生的反应为__________________________________ ,当外电路通过1mole-,正极上共消耗_______ mol N2O5。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g)
 H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1反应2:H2NCOONH4(l)
 H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1请回答:CO(NH2)2 (l)+H2O(l)
 2NH3(l)+CO2(g) ΔH3=
2NH3(l)+CO2(g) ΔH3=(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)
 S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率
③下列说法一定能说明该反应达到平衡状态的是
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.

石墨I附近发生的反应为
您最近一年使用:0次
2019-12-04更新
|
249次组卷
|
3卷引用:山西省晋中市平遥县和诚中学2020届高三上学期12月月考化学试题
7 . Ⅰ.在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)一定温度下,将2 mol N2和6 mol H2置于1 L的恒容密闭容器中发生如下反应: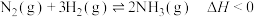 ,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
①上表中T1_______ T2(用含“>”“<”“=”的关系式表示),其中a、b、80%三者的大小关系是_______ (用含“>”“<”“=”的关系式表示)。
②研究表明,合成氨的速率与相关物质的浓度关系为 ,k为速率常数。以下说法正确的是
,k为速率常数。以下说法正确的是_______ (填字母序号)。
A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态
C.一定温度下将原容器中的NH3及时分离出来可使v减小
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大
③已知某温度下该反应达平衡时各物质均为1 mol,容器容积为1 L,保持温度和压强不变,又充入3 mol N2后,平衡_______ (填“向左移动”“向右移动”或“不移动”)。
Ⅱ.甲醚(CH3OCH)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为 。该过程可分为以下两步反应完成:
。该过程可分为以下两步反应完成:
甲醇合成反应:_______。
甲醇脱水反应: 。
。
(2)起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为_______ 。
(3)请写出甲醇合成反应的热化学方程式:_______ 。
(4)在一定条件下,将CO和H2按体积比1:2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是_______ (填字母)。
a.混合气体的总物质的量保持不变
b.混合气体的密度保持不变
c.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
d.每生成1 mol CH3OCH3(g),同时生成2 mol CO
(1)一定温度下,将2 mol N2和6 mol H2置于1 L的恒容密闭容器中发生如下反应:
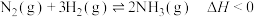 ,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:| 1小时 | 2小时 | 3小时 | 4小时 | |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a | b |
①上表中T1
②研究表明,合成氨的速率与相关物质的浓度关系为
 ,k为速率常数。以下说法正确的是
,k为速率常数。以下说法正确的是A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态
C.一定温度下将原容器中的NH3及时分离出来可使v减小
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大
③已知某温度下该反应达平衡时各物质均为1 mol,容器容积为1 L,保持温度和压强不变,又充入3 mol N2后,平衡
Ⅱ.甲醚(CH3OCH)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为
 。该过程可分为以下两步反应完成:
。该过程可分为以下两步反应完成:甲醇合成反应:_______。
甲醇脱水反应:
 。
。(2)起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为
(3)请写出甲醇合成反应的热化学方程式:
(4)在一定条件下,将CO和H2按体积比1:2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是
a.混合气体的总物质的量保持不变
b.混合气体的密度保持不变
c.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
d.每生成1 mol CH3OCH3(g),同时生成2 mol CO
您最近一年使用:0次
11-12高二上·河南焦作·期中
8 . 丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-c kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-d kJ/mol (a、b、c、d 均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量________ (填“大于 ”、“等于 ” 或“小于 ”)途径Ⅱ放出的热量。
(2)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量_____ (填“大于”、“等 于”或“小于 ”)生成物具有的总能量,那么在化学反应时,反应物就需要_____ (填“放出 ” 或“吸收 ”)能量才能转化为生成物,因此其反应条件是____ ;
(3)b与a、c、d 的数学关系式是_____________________________________ 。
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-c kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-d kJ/mol (a、b、c、d 均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量
(2)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量
(3)b与a、c、d 的数学关系式是
您最近一年使用:0次
2020-04-30更新
|
146次组卷
|
13卷引用:山西省祁县第二中学2019-2020学年高二10月月考化学试题
山西省祁县第二中学2019-2020学年高二10月月考化学试题(已下线)2011-2012学年河南省焦作市修武一中分校高二上学期期中考试化学试卷(已下线)2012-2013学年吉林省松原市扶余县一中高二第一次月考化学试卷(已下线)2014—2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷2015-2016学年四川省新津中学高二10月月考化学试卷西藏日喀则市第二高级中学2017-2018学年高二上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B甘肃省临泽县第一中学2018-2019学年高二上学期期中考试化学试题山东省济宁市第二中学2019-2020学年高二上学期第一次月考化学试题陕西省宝鸡市金台区2019-2020学年高二上学期期中检测化学试题青海省西宁市海湖中学2020-2021学年高二上学期第一阶段测试化学试题福建省莆田第十五中学2018-2019学年高二上学期期中考试化学试题新疆岳普湖县2021-2022学年高二下学期第一次学情调研测试化学试题
9 . 水煤气变换反应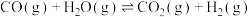
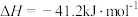 可用于制氢,该反应可分两步完成:
可用于制氢,该反应可分两步完成:
①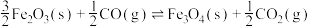
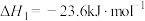
②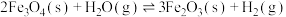
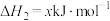
请回答下列问题:
(1)x=___________ 。
(2)下列有利于提高H2的平衡产率的措施是___________(填字母)。
(3)总反应的催化剂是___________ (填化学式),测定其属于晶体的方法是___________ ,在其活性温度范围内,反应历程包含吸附(快速的过程)、反应及脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因与___________ 因素有关(填一条)。
(4)保持压强为1.7MPa,按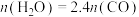 进行投料,曲线a、b分别表示不同条件下反应达到平衡,相应物质的分压[如
进行投料,曲线a、b分别表示不同条件下反应达到平衡,相应物质的分压[如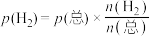 ]如图所示。
]如图所示。___________ ,平衡常数
___________ 。
②根据图中信息,曲线a中H2的产率比曲线b低的主要原因可能是___________ (用化学方程式表示,不考虑 )。
)。
(5)整个反应过程都是“气-固”反应,有利于气固接触的措施是___________ (填一条)。
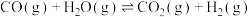
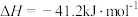 可用于制氢,该反应可分两步完成:
可用于制氢,该反应可分两步完成:①
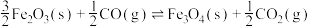
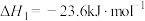
②
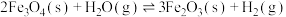
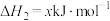
请回答下列问题:
(1)x=
(2)下列有利于提高H2的平衡产率的措施是___________(填字母)。
| A.升高温度 | B.保持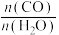 一定,增大体系总压 一定,增大体系总压 |
| C.向体系中投入一定量的纳米CaO | D.增大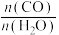 |
(3)总反应的催化剂是
(4)保持压强为1.7MPa,按
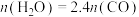 进行投料,曲线a、b分别表示不同条件下反应达到平衡,相应物质的分压[如
进行投料,曲线a、b分别表示不同条件下反应达到平衡,相应物质的分压[如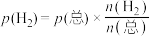 ]如图所示。
]如图所示。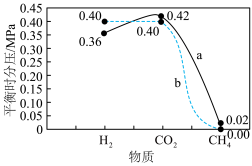

②根据图中信息,曲线a中H2的产率比曲线b低的主要原因可能是
 )。
)。(5)整个反应过程都是“气-固”反应,有利于气固接触的措施是
您最近一年使用:0次
10 . 入冬以来,太原市为减少“雾霾”的发生,开始对机动车限号行驶。“雾霾”中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质。请回答下列问题:
(1)汽车尾气中的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:①2NO(g) N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式__________________ 。
(2)用焦炭还原NO的反应为2NO(g)+C(s) N2(g)+CO2(g),向容积均为2 L的甲、乙两个恒容恒温(反应温度分别为400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间(t)的变化情况如下表所示:
N2(g)+CO2(g),向容积均为2 L的甲、乙两个恒容恒温(反应温度分别为400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间(t)的变化情况如下表所示:
①该反应为________ (填“放热”或“吸热”)反应。
②求400 ℃下该反应的平衡常数__________ 。
(3)在一定条件下,将NO和O3通入绝热恒容密闭容器中发生反应NO(g)+O3(g) NO2(g)+O2(g),正反应速率随时间的变化如图所示。下列说法正确的是
NO2(g)+O2(g),正反应速率随时间的变化如图所示。下列说法正确的是______ 。

A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
(4)园园老师带领研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。
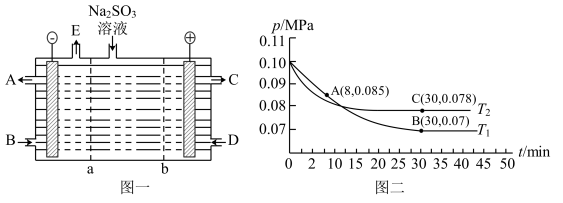
①a表示________ (填“阴”或“阳”)离子交换膜。A~E分别代表生产中的原料或产品,其中C为硫酸,则A表示________ 。
②阳极的电极反应式为______________ 。
(1)汽车尾气中的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:①2NO(g)
 N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1②2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式
(2)用焦炭还原NO的反应为2NO(g)+C(s)
 N2(g)+CO2(g),向容积均为2 L的甲、乙两个恒容恒温(反应温度分别为400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间(t)的变化情况如下表所示:
N2(g)+CO2(g),向容积均为2 L的甲、乙两个恒容恒温(反应温度分别为400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间(t)的变化情况如下表所示:| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为
②求400 ℃下该反应的平衡常数
(3)在一定条件下,将NO和O3通入绝热恒容密闭容器中发生反应NO(g)+O3(g)
 NO2(g)+O2(g),正反应速率随时间的变化如图所示。下列说法正确的是
NO2(g)+O2(g),正反应速率随时间的变化如图所示。下列说法正确的是

A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
(4)园园老师带领研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。

①a表示
②阳极的电极反应式为
您最近一年使用:0次



