名校
解题方法
1 . 过渡金属氧化物离子(以MO+表示)在烃类的选择性氧化等方面应用广泛。MO+与CH4反应的过程如下图所示。不正确 的是
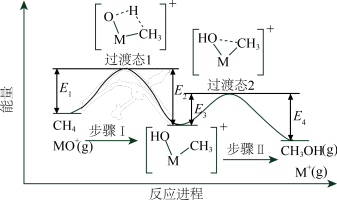
| A.反应速率:步骤I<步骤II |
| B.CH3OH分子中,键角:H—C—H>H—O—C |
| C.若MO+与CH3D反应,生成的氘代甲醇有2种 |
D.CH4(g) + MO+(g)=CH3OH(g) + M+(g)  = E2+E4-E1-E3 = E2+E4-E1-E3 |
您最近一年使用:0次
2024-04-01更新
|
545次组卷
|
5卷引用:江苏省常州市第一中学2023-2024学年高二下学期4月期中考试化学试题
江苏省常州市第一中学2023-2024学年高二下学期4月期中考试化学试题北京市丰台区2023-2024学年高三下学期综合练习(一)化学试题(已下线)通关练08 聚焦反应热、速率及化学平衡-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)化学(天津卷03)-2024年高考化学押题预测卷(已下线)提升练03 反应历程探究与催化原理-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
2 . 利用水煤气(主要成分 、CO)可将
、CO)可将 在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
反应Ⅰ:
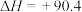 kJ⋅mol
kJ⋅mol
反应Ⅱ: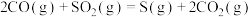
 kJ⋅mol
kJ⋅mol
在恒压条件下用水煤气还原 ,起始时
,起始时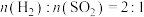 条件下,
条件下, 和
和 的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
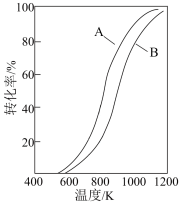
 、CO)可将
、CO)可将 在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:反应Ⅰ:

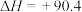 kJ⋅mol
kJ⋅mol
反应Ⅱ:
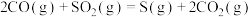
 kJ⋅mol
kJ⋅mol
在恒压条件下用水煤气还原
 ,起始时
,起始时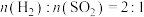 条件下,
条件下, 和
和 的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
A.反应Ⅰ的平衡常数可表示为 |
B.反应Ⅱ的 |
C.曲线B表示 的平衡转化率随温度的变化 的平衡转化率随温度的变化 |
D. 的 的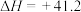 kJ⋅mol kJ⋅mol |
您最近一年使用:0次
名校
解题方法
3 . CO2催化加氢制甲醇有利于减少 CO2的排放,实现“碳达峰”,其反应可表示为:CO2 (g)+3H2 (g) =CH3OH (g)+H2O (g) ΔH=−49 kJ•mol−1。CO2催化加氢制甲醇的反应通过如下步骤来实现:
①CO2(g)+H2(g) =CO(g)+H2O(g) ΔH1=41 kJ•mol−1
②CO(g)+2H2(g) =CH3OH(g) ΔH2
反应过程中各物质的相对能量变化情况如图所示。下列说法不正确的是

①CO2(g)+H2(g) =CO(g)+H2O(g) ΔH1=41 kJ•mol−1
②CO(g)+2H2(g) =CH3OH(g) ΔH2
反应过程中各物质的相对能量变化情况如图所示。下列说法不正确的是

| A.步骤①反应的ΔS>0 |
| B.步骤②反应的ΔH2=−90 kJ•mol−1 |
| C.CO2催化加氢制甲醇的总反应速率由步骤②决定 |
| D.升高温度,各步骤的正、逆反应速率均增大 |
您最近一年使用:0次
2022-05-30更新
|
690次组卷
|
7卷引用:江苏省常州市2022届高三下学期5月模拟化学试题
江苏省常州市2022届高三下学期5月模拟化学试题江苏省扬州中学2022届高三下学期考前模拟(三)化学试题(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点24 化学反应的方向(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省苏州市实验中学2023-2024学年高二上学期10月月考化学试题江苏省苏州震泽中学2023~2024学年高二上学期10月月考化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期第三次月考化学试题
名校
4 . CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应I:CO2(g)+H2(g) =CO(g)+H2O(g) ΔH=+41.2 kJ·mol−1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) ΔH=—122.5 kJ·mol−1
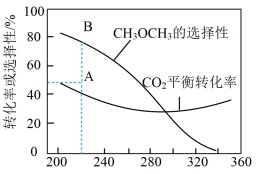
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。 (CH3OCH3的选择性=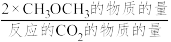 ×100%)
×100%)
下列说法不正确 的是
反应I:CO2(g)+H2(g) =CO(g)+H2O(g) ΔH=+41.2 kJ·mol−1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) ΔH=—122.5 kJ·mol−1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。 (CH3OCH3的选择性=
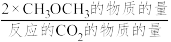 ×100%)
×100%)
下列说法
| A.CO的选择性随温度的升高逐渐增大 |
| B.反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH=—204.9 kJ·mol−1 |
| C.在240~320℃范围内,温度升高,平衡时CH3OCH3的物质的量先增大后减小 |
| D.反应一段时间后,测得CH3OCH3的选择性为48%(图中A点),增大压强可能将CH3OCH3的选择性提升到B点 |
您最近一年使用:0次
2022-05-31更新
|
980次组卷
|
7卷引用:江苏省常州市十校2022-2023学年高三上学期12月联合调研化学试题
江苏省常州市十校2022-2023学年高三上学期12月联合调研化学试题江苏省苏州市2022届高考考前模拟化学试卷题江苏省扬州中学2021-2022学年高二下学期6月月考化学试题(已下线)专题10 化学反应速率与化学平衡-备战2023年高考化学母题题源解密(全国通用)(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)江苏省连云港市灌南二中、南师大灌云附中2022-2023学年高二下学期第二次阶段性检测化学试题(已下线)选择题11-13
名校
5 . 如图所示,E1=393.5kJ⋅mol-1,E2=395.4kJ⋅mol-1,下列说法或热化学方程式正确的是
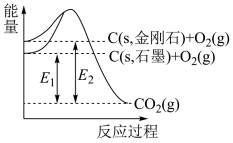

| A.石墨与金刚石之间的转化是物理变化 | B.C(s,石墨)=C(s,金刚石)△H=+1.9kJ⋅mol-1 |
| C.金刚石的稳定性强于石墨 | D.断裂1mol化学键吸收的能量:石墨比金刚石的少 |
您最近一年使用:0次
2021-09-11更新
|
607次组卷
|
7卷引用:江苏省常州市联盟学校2022-2023学年高一下学期5月学情调研化学试题
6 . 肼(分子式为N2H4,其结构简式为H2N-NH2)是一种应用广泛的化工原料。
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16g N2H4(g)在上述反应中放出284kJ的热量,写出该反应的热化学方程式_______ 。
(2)肼能与N2O4发生如下反应: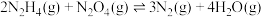 ,在四种不同情况下的反应速率如下:①
,在四种不同情况下的反应速率如下:①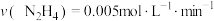 ;②
;②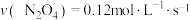 ;③
;③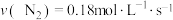 ④
④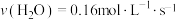 ,则反应速率由快到慢的顺序为
,则反应速率由快到慢的顺序为_______ (用序号表示)。
(3)肼和氧气在不同温度和催化剂的恒容密闭容器中生成不同产物(如下图):
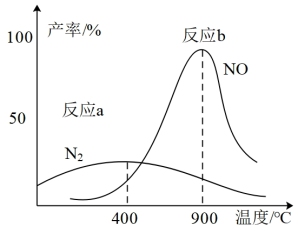
温度较低时主要发生反应a:
温度较高时主要发生反应b: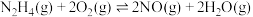
①反应a的化学平衡常数K的表达式为K=_______ 。
②下列有关反应a: 的说法,能说明该反应已达到平衡状态的是
的说法,能说明该反应已达到平衡状态的是_______ 。
a.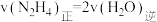
b.容器内压强保持不变
c.混合气体的密度保持不变
d.断裂 的同时,有
的同时,有 断裂
断裂
e.容器内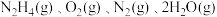 的浓度之比为
的浓度之比为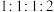
③若反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1_______ K2(填“<”、“>”或“=”)。
④1000℃,反应b达到平衡时,下列措施能使容器中 增大的是
增大的是_______ 。
A.恒容条件下,充入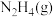 B.恒压条件下,充入
B.恒压条件下,充入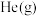
C.缩小容器体积 D.使用催化剂
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16g N2H4(g)在上述反应中放出284kJ的热量,写出该反应的热化学方程式
(2)肼能与N2O4发生如下反应:
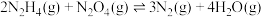 ,在四种不同情况下的反应速率如下:①
,在四种不同情况下的反应速率如下:①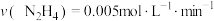 ;②
;②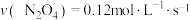 ;③
;③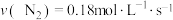 ④
④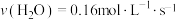 ,则反应速率由快到慢的顺序为
,则反应速率由快到慢的顺序为(3)肼和氧气在不同温度和催化剂的恒容密闭容器中生成不同产物(如下图):

温度较低时主要发生反应a:

温度较高时主要发生反应b:
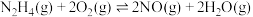
①反应a的化学平衡常数K的表达式为K=
②下列有关反应a:
 的说法,能说明该反应已达到平衡状态的是
的说法,能说明该反应已达到平衡状态的是a.
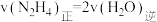
b.容器内压强保持不变
c.混合气体的密度保持不变
d.断裂
 的同时,有
的同时,有 断裂
断裂e.容器内
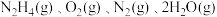 的浓度之比为
的浓度之比为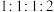
③若反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1
④1000℃,反应b达到平衡时,下列措施能使容器中
 增大的是
增大的是A.恒容条件下,充入
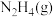 B.恒压条件下,充入
B.恒压条件下,充入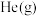
C.缩小容器体积 D.使用催化剂
您最近一年使用:0次
名校
7 . CO2催化加氢合成甲醇是重要的碳捕获利用与封存技术,该过程主要发生下列反应:
反应①:CO2(g)+3H2(g)= CH3OH(g)+H2O(g); ΔH= - 49.5 kJ·mol-1
反应②:CO2(g)+H2(g)=CO(g)+H2O(g);ΔH=41.2 kJ·mol-1
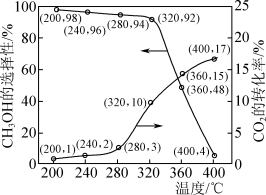
在0.5 MPa条件下,将n(CO2):n(H2)为1:3的混合气体以一定流速通过装有催化剂的反应器,实验测得CO2的转化率、CH3OH的选择性[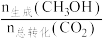 ×100%]与温度的关系如图所示。下列有关说法不正确的是
×100%]与温度的关系如图所示。下列有关说法不正确的是
反应①:CO2(g)+3H2(g)= CH3OH(g)+H2O(g); ΔH= - 49.5 kJ·mol-1
反应②:CO2(g)+H2(g)=CO(g)+H2O(g);ΔH=41.2 kJ·mol-1

在0.5 MPa条件下,将n(CO2):n(H2)为1:3的混合气体以一定流速通过装有催化剂的反应器,实验测得CO2的转化率、CH3OH的选择性[
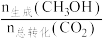 ×100%]与温度的关系如图所示。下列有关说法不正确的是
×100%]与温度的关系如图所示。下列有关说法不正确的是| A.反应②继续加氢生成甲醇的热化学方程式可表示为CO(g)+2H2(g)=CH3OH(g);ΔH=-90.7 kJ·mol -1 |
| B.其他条件不变,增大起始n(CO2):n(H2)的比值,可提高CO2的平衡转化率 |
| C.其他条件不变,在280~400°C间,产物中n(CH3OH)随温度的升高先增大后减小 |
| D.为高效生产CH3OH,需研发低温下CO2转化率高和CH3OH选择性高的催化剂 |
您最近一年使用:0次
2021-12-29更新
|
582次组卷
|
5卷引用:江苏省常州市部分重点中学2021-2022学年高三上学期期中考试化学试题
江苏省常州市部分重点中学2021-2022学年高三上学期期中考试化学试题江苏省泰州中学2021-2022学年高三12月月度质量检测化学试题(已下线)黄金卷10-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题11-13)江苏省盐城市三校(盐城一中、亭湖高中、大丰中学)2022-2023学年高二下学期期中联考化学试题
名校
解题方法
8 . 用H2O2和H2SO4的混合溶液可腐蚀印刷电路板上的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH
已知①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH1=64kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g) ΔH2=-196kJ·mol-1
③H2(g)+ O2(g)=H2O(l) ΔH3=-286kJ·mol-1
O2(g)=H2O(l) ΔH3=-286kJ·mol-1
下列说法不正确的是( )
已知①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH1=64kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g) ΔH2=-196kJ·mol-1
③H2(g)+
 O2(g)=H2O(l) ΔH3=-286kJ·mol-1
O2(g)=H2O(l) ΔH3=-286kJ·mol-1下列说法不正确的是( )
| A.反应①可通过铜作电极电解稀的H2SO4方法实现 |
| B.反应②在任何条件下都能自发进行 |
C.若H2(g)+ O2(g)=H2O(g) ΔH4,则ΔH4<ΔH3 O2(g)=H2O(g) ΔH4,则ΔH4<ΔH3 |
| D.ΔH=-320kJ·mol-1 |
您最近一年使用:0次
2020-03-03更新
|
281次组卷
|
6卷引用:江苏省常州市第一中学2019届高三上学期10月月考化学试题



