10-11高二上·山西临汾·期中
名校
解题方法
1 . 已知热化学反应方程式:Zn(s)+ O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+
O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+ O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
 O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+
O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+ O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为| A.ΔH=+260.66kJ·mol-1 | B.ΔH=+442.34kJ·mol-1 |
| C.ΔH=-442.34kJ·mol-1 | D.ΔH=-260.66kJ·mol-1 |
您最近一年使用:0次
2021-11-08更新
|
147次组卷
|
27卷引用:福建省华安一中、龙海二中2019-2020学年高二上学期第一次联考化学试题
福建省华安一中、龙海二中2019-2020学年高二上学期第一次联考化学试题(已下线)2010年山西省临汾一中高二上学期期中考试化学试题(已下线)2011-2012学年江西省兴国县将军中学高二上学期期中考试化学试卷(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷(已下线)2012-2013学年新疆兵团农二师华山中学高二上学期期末考试化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(理)化学试卷2015-2016北京大学附中宇华教育集团高二12月化学卷2015-2016学年陕西省黄陵中学高二上学期期末考试化学试卷2015-2016学年安徽省安庆市怀宁县高河中学高二上期末化学试卷甘肃省武威第五中学2018-2019学年高二上学期期末考试化学试题宁夏青铜峡市高级中学(吴忠中学分校)2019-2020学年高二上学期第一次月考化学试题甘肃省古浪县第二中学2019-2020学年高二12月基础知识竞赛化学试题甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 黑龙江省绥化地区肇东第四中学2020-2021学年高二上学期期末考试化学试题湖南省常德市石门县第六中学2020-2021学年高二上学期期末考试(合格考)化学试题吉林省大安市第六中学2021-2022学年高二上学期第一次月考化学试题湖南省长沙铁路第一中学2021-2022学年高二上学期第一次阶段性考试化学试题海南省海口嘉勋高级中学2021-2022学年高二上学期10月月考化学试题(已下线)必考点01 化学反应的热效应-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)云南省红河县一中2021-2022学年高二上学期期中考试化学试题黑龙江省鸡西市第四中学2022-2023学年高二上学期第一次月考化学试题安徽省芜湖市无为襄安中学2022-2023高二上学期第一次月考化学试题(已下线)2011-2012学年辽宁省抚顺县高级中学高一下学期期中考试化学试卷(已下线)2014届贵州省六校联盟高三第一次联考化学试卷2015-2016北京大学附中宇华教育集团高一12月化学卷【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】
2 . 已知室温下,将 CuSO4·5H2O(s)溶于水会使溶液温度降低, 将 CuSO4(s)溶于水会使溶液温度升高。则下列能量转化关系的判断不正确的是
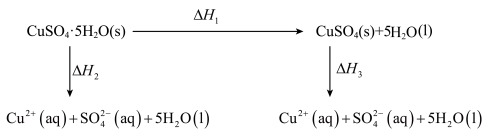

| A.∆H1>0 | B.∆H2>∆H3 | C.∆H3>∆H1 | D.∆H2=∆H1+∆H3 |
您最近一年使用:0次
2021-08-11更新
|
963次组卷
|
28卷引用:【校级联考】福建省平和一中、南靖一中等五校2018-2019学年高二上学期第一次联考化学试题
【校级联考】福建省平和一中、南靖一中等五校2018-2019学年高二上学期第一次联考化学试题(已下线)【新东方】高中化学165浙江省丽水市2017-2018学年高二下学期期末教学质量监控化学试题山东省菏泽市2020-2021学年高二上学期期中考试化学试题(A)安徽省临泉第一中学2020-2021学年高二上学期第三次月考化学试题广西钦州市2020-2021学年高二上学期期末教学质量监测化学试题广西南宁市宾阳县宾阳中学2021-2022学年高二上学期10月月考化学试题福建省福州市第四十中学2021-2022学年高二上学期9月阶段测试化学试题浙江省杭州市富阳区实验中学2021-2022学年高二上学期10月月考化学试题河南省南阳市第六完全学校高级中学2022-2023学年高二上学期9月半月考化学试题浙江省台州市书生中学等三校2022-2023学年高二上学期第一次月考化学试题陕西省汉中市洋县中学2022-2023学年高二上学期期中考试化学试题(已下线)专题02 盖斯定律、反应热的计算【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)浙江省学考选考科目考试绍兴市适应性试卷(2018年3月)化学试题(已下线)2019年9月15日 《每日一题》2020年一轮复习 —— 每周一测(已下线)专题6.1 化学能与热能(讲)——2020年高考化学一轮复习讲练测(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)河北省保定市唐县一中2021-2022学年高三上学期第二次月考化学试题(已下线)专题09 化学反应与能量变化-备战2022年高考化学学霸纠错(全国通用)(已下线)2021年6月浙江高考化学试题变式题21-25广东省广州市广东华侨中学2021-2022学年高一下学期期中考试化学试题(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第25练 反应热的计算-2023年高考化学一轮复习小题多维练(全国通用)陕西省延安市第一中学2021-2022学年高一下学期第二次月考化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期中考试化学(选考)试题(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
2021·北京·模拟预测
3 . Deacon催化氧化法将HCl转化为Cl2的反应为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)ΔH=-116kJ·mol-1
研究发现CuCl2(s)催化反应的过程如下:
反应i:CuCl2(s)=CuCl(s)+ Cl2(g)ΔH1=+83kJ·mol-1
Cl2(g)ΔH1=+83kJ·mol-1
反应ii:CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g)ΔH2=-20kJ·mol-1
Cl2(g)ΔH2=-20kJ·mol-1
反应iii:……
下列表述不正确 的是
研究发现CuCl2(s)催化反应的过程如下:
反应i:CuCl2(s)=CuCl(s)+
 Cl2(g)ΔH1=+83kJ·mol-1
Cl2(g)ΔH1=+83kJ·mol-1反应ii:CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g)ΔH2=-20kJ·mol-1
Cl2(g)ΔH2=-20kJ·mol-1反应iii:……
下列表述
| A.反应i中反应物的总能量小于生成物的总能量 |
| B.反应ii中,1molCuCl(s)反应时转移2mole- |
| C.推断反应iii应为CuO(s)+2HCl(g)=CuCl2(s)+H2O(g)ΔH3=-242kJ·mol-1 |
| D.由反应过程可知催化剂参与反应,通过改变反应路径提高反应速率 |
您最近一年使用:0次
2021-06-22更新
|
464次组卷
|
6卷引用:福建省漳州市华安县正兴学校2022-2023学年高二上学期期中联考化学试题
福建省漳州市华安县正兴学校2022-2023学年高二上学期期中联考化学试题江西省鹰潭市第一中学2021-2022学年高二上学期创新班10月月考化学试题(已下线)2021年高考化学押题预测卷(北京卷)(03)北京一零一中学2021-2022学年高三上学期10月月考化学试题北京市第六十五中学2023-2024学年高三上学期期中达标测试化学试题(已下线)北京市第四中学2023-2024学年高三下学期一模模拟化学试题
4 . 科学家利用Li4SiO4吸附CO2,对于实现废气资源的再利用及碳循环经济技术的发展都具有重要意义。回答下列问题:
(1)可用Li2CO3与SiO2反应制取吸附剂Li4SiO4。
已知:2Li2O(s)+SiO2(s)=Li4SiO4(s) ΔH1=akJ⋅mol-1
Li2CO3(s)+SiO2(s)=Li2SiO3(s)+CO2(g) ΔH2=bkJ⋅mol-1
Li2SiO3(s)=Li2O(s)+SiO2(s) ΔH3=ckJ⋅mol-1
则2Li2CO3(s)+SiO2(s)=Li4SiO4(s)+2CO2(g) ΔH=______ kJ⋅mol−1(用含a、b、c的式子表示)。
(2)CO2的吸附回收及材料再生的原理如下图所示:
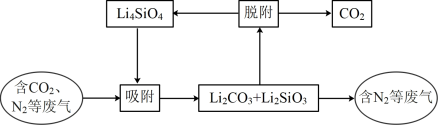
“吸附”过程中主要反应的化学方程式为______ 。
(3)为了探究Li4SiO4的吸附效果,在刚性容器中放入1000g的Li4SiO4吸附剂,通入10.0mol不同比例的N2和CO2混合气体,控制反应时间均为2小时,得到Li4SiO4吸附CO2后固体样品质量百分数与温度的关系如下图所示。
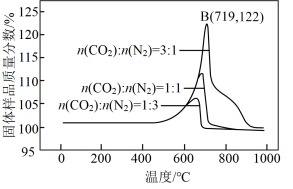
①该反应为______ 反应(填“吸热”或“放热”)。
②A点的v正_____ v逆(填“>”、“<”或“=”),理由是_____ 。
③不同CO2的体积分数对于吸附速率的影响是______ 。
④保持B点的温度不变,若所用刚性容器体积为原来的一半,则平衡时理论上c(CO2)较原平衡______ (填“增大”、“减小”或“不变”)。
⑤B点CO2的吸收率为______ (保留3位有效数字)。
(1)可用Li2CO3与SiO2反应制取吸附剂Li4SiO4。
已知:2Li2O(s)+SiO2(s)=Li4SiO4(s) ΔH1=akJ⋅mol-1
Li2CO3(s)+SiO2(s)=Li2SiO3(s)+CO2(g) ΔH2=bkJ⋅mol-1
Li2SiO3(s)=Li2O(s)+SiO2(s) ΔH3=ckJ⋅mol-1
则2Li2CO3(s)+SiO2(s)=Li4SiO4(s)+2CO2(g) ΔH=
(2)CO2的吸附回收及材料再生的原理如下图所示:

“吸附”过程中主要反应的化学方程式为
(3)为了探究Li4SiO4的吸附效果,在刚性容器中放入1000g的Li4SiO4吸附剂,通入10.0mol不同比例的N2和CO2混合气体,控制反应时间均为2小时,得到Li4SiO4吸附CO2后固体样品质量百分数与温度的关系如下图所示。

①该反应为
②A点的v正
③不同CO2的体积分数对于吸附速率的影响是
④保持B点的温度不变,若所用刚性容器体积为原来的一半,则平衡时理论上c(CO2)较原平衡
⑤B点CO2的吸收率为
您最近一年使用:0次
2021-04-06更新
|
180次组卷
|
2卷引用:福建省漳州市2021届高中毕业班第二次教学质量检测化学试题
5 . 二甲醚(CH3OCH3)是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚。请回答下列问题:
(1)水煤气是水蒸气通过炽热的焦炭而生成的气体,主要成分是CO和H2。已知该反应生成1molCO气体需要吸收131.3kJ的热量,请写出该反应的热化学方程式____ 。
(2)利用水煤气合成二甲醚的三步反应如下:
(1)2H2(g)+CO(g) CH3OH(g) △H1=-90.8kJ•mol-1
CH3OH(g) △H1=-90.8kJ•mol-1
(2)2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ•mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ•mol-1
(3)CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.3kJ•mol-1
CO2(g)+H2(g) △H3=-41.3kJ•mol-1
由此可知总反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的焓变△H=
CH3OCH3(g)+CO2(g)的焓变△H=___ kJ•mol-1。
(3)若总反应达到平衡后,要提高CO的转化率,可以采取的措施是___ (填字母)。
a.增大压强 b.增大CO的浓度 c.加催化剂 d.分离出二甲醚
(4)已知某温度下反应②2CH3OH(g) CH3OCH3(g)+H2O(g)的平衡常数K=400。此温度下,测得某时刻各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数K=400。此温度下,测得某时刻各组分的浓度如下:
①比较此时正、逆反应速率的大小:v(正)___ v(逆)(填“>”、“<”或“=”)。
②若从此刻开始又经过10min达到平衡,则这段时间内反应速率v(CH3OH)=____ 。
(1)水煤气是水蒸气通过炽热的焦炭而生成的气体,主要成分是CO和H2。已知该反应生成1molCO气体需要吸收131.3kJ的热量,请写出该反应的热化学方程式
(2)利用水煤气合成二甲醚的三步反应如下:
(1)2H2(g)+CO(g)
 CH3OH(g) △H1=-90.8kJ•mol-1
CH3OH(g) △H1=-90.8kJ•mol-1(2)2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-23.5kJ•mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ•mol-1(3)CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41.3kJ•mol-1
CO2(g)+H2(g) △H3=-41.3kJ•mol-1由此可知总反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的焓变△H=
CH3OCH3(g)+CO2(g)的焓变△H=(3)若总反应达到平衡后,要提高CO的转化率,可以采取的措施是
a.增大压强 b.增大CO的浓度 c.加催化剂 d.分离出二甲醚
(4)已知某温度下反应②2CH3OH(g)
 CH3OCH3(g)+H2O(g)的平衡常数K=400。此温度下,测得某时刻各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数K=400。此温度下,测得某时刻各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol•L-1 | 0.85 | 0.6 | 0.6 |
②若从此刻开始又经过10min达到平衡,则这段时间内反应速率v(CH3OH)=
您最近一年使用:0次
名校
解题方法
6 . 高炉炼铁是冶铁的主要方法,发生的主要反应为Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=akJ·mol-1。
2Fe(s)+3CO2(g) ΔH=akJ·mol-1。
(1)已知:①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)ΔH1=+489.0kJ·mol-1
②C(石墨,s)+CO2(g)=2CO(g)ΔH2=+172.5kJ·mol-1
则a=__ 。
(2)冶炼铁的反应的平衡常数表达式为K=__ ,温度升高后,K值__ (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按表所示加入物质,反应经过一段时间后达到平衡。
①甲容器中CO的平衡转化率为__ 。
②下列说法正确的是__ (填字母)。
a.若容器内气体密度恒定,表示反应达到平衡状态
b.若容器内气体压强恒定时,标志反应达到平衡状态
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3的量可以提高CO的转化率
 2Fe(s)+3CO2(g) ΔH=akJ·mol-1。
2Fe(s)+3CO2(g) ΔH=akJ·mol-1。(1)已知:①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)ΔH1=+489.0kJ·mol-1
②C(石墨,s)+CO2(g)=2CO(g)ΔH2=+172.5kJ·mol-1
则a=
(2)冶炼铁的反应的平衡常数表达式为K=
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为
②下列说法正确的是
a.若容器内气体密度恒定,表示反应达到平衡状态
b.若容器内气体压强恒定时,标志反应达到平衡状态
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3的量可以提高CO的转化率
您最近一年使用:0次
名校
解题方法
7 . (1)下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):
反应2H2(g)+O2(g)=2H2O(g)是__ (填“吸热”或“放热”)反应,这说明2molH2(g)和1mol O2(g)具有的能量比2mol H2O(g)具有的能量__ (填“高”或“低”)。
(2)氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
已知:N2(g)+O2(g)=2NO(g) △H1 =+180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=﹣393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=﹣221 kJ/mol
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:___ 。
(3)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,已知图中E1=134kJ·mol-1、E2=368kJ·mol-1,若在反应体系中加入催化剂,反应速率增大,E1的变化是__ (填“增大”“减小”或“不变”,下同),ΔH的变化是__ 。请写出NO2和CO反应的热化学方程式:__ 。

(4)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s)ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g)ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式:__ 。
| 物质 | H2(g) | O2(g) | H2O(g) |
| 能量 | 436 | 496 | 926 |
(2)氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
已知:N2(g)+O2(g)=2NO(g) △H1 =+180.5 kJ/mol
C(s)+O2(g)=CO2(g) △H2=﹣393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=﹣221 kJ/mol
若某反应的平衡常数表达式为:K=
 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:(3)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,已知图中E1=134kJ·mol-1、E2=368kJ·mol-1,若在反应体系中加入催化剂,反应速率增大,E1的变化是

(4)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s)ΔH=-159.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g)ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式:
您最近一年使用:0次
8 . 天然气可催化重整制备合成气(CO、H2),其有关反应如下:
①CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH1
②CH4(g)=C(s)+2H2(g)ΔH2=+75kJ·mol-1
③C(s)+ O2(g)=CO(g)ΔH3=-111kJ·mol-1
O2(g)=CO(g)ΔH3=-111kJ·mol-1
④C(s)+O2(g)=CO2(g)ΔH4=-394kJ·mol-1
下列说法正确的是( )
①CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH1
②CH4(g)=C(s)+2H2(g)ΔH2=+75kJ·mol-1
③C(s)+
 O2(g)=CO(g)ΔH3=-111kJ·mol-1
O2(g)=CO(g)ΔH3=-111kJ·mol-1④C(s)+O2(g)=CO2(g)ΔH4=-394kJ·mol-1
下列说法正确的是( )
| A.反应②在较低温度下能自发进行 |
| B.CO的燃烧热为283kJ·mol-1 |
| C.若3molC(s)燃烧生成1molCO(g)和2molCO2(g),则损失的热量为111kJ |
| D.在上述反应①中,ΔH1=-247kJ·mol-1[ |
您最近一年使用:0次
名校
9 . 下列关于如图所示转化关系(X代表卤素 的说法错误的是
的说法错误的是
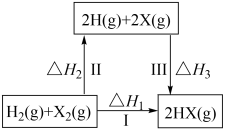
 的说法错误的是
的说法错误的是
| A.∆H3<0 |
| B.∆H1=∆H2+∆H3 |
| C.∆H1越小,HX越稳定 |
| D.按Cl、Br、I的顺序,∆H2依次增大 |
您最近一年使用:0次
10 . 碳是常见的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
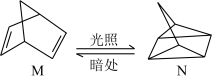 ΔH=+88.6kJ·mol-1。
ΔH=+88.6kJ·mol-1。
则M、N相比,较稳定的是_____ 。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+ O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a
O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a________ 726.5(填“>”“<”或“=”)。
(3)煤气化制合成气(CO和H2)
已知:①C(s)+H2O(g)=CO(g)+H2(g)ΔH1=+131.3kJ·mol-1
②C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH2=+90kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是________ 。
(4)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:


①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________ (填“增大”“减小”或“不变”,下同),ΔH的变化是________ 。NO2和CO反应的热化学方程式为________ 。
②下表所示是部分化学键的键能参数:
已知P4(g)+5O2(g)=P4O10(g) ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________ (用含a、b、c、d的代数式表示)。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6kJ·mol-1。
ΔH=+88.6kJ·mol-1。则M、N相比,较稳定的是
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+
 O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a
O2(g)= CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a(3)煤气化制合成气(CO和H2)
已知:①C(s)+H2O(g)=CO(g)+H2(g)ΔH1=+131.3kJ·mol-1
②C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH2=+90kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是
(4)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:


①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是
②下表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/(kJ·mol-1) | a | b | C | x |
您最近一年使用:0次



