名校
1 . 由 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一,
人工合成淀粉(节选途径见下图)中的重要反应之一,
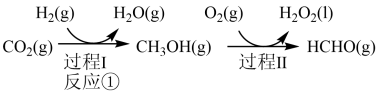
已知:
反应②:
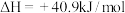
反应③:

(1)反应①的热化学方程式为___________ ;若过程Ⅱ中O得到4mol电子,则理论上可生成___________ molHCHO。
(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。
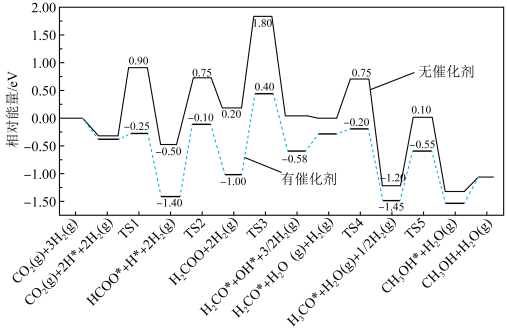
该反应历程中决速步骤的化学方程式为,催化剂使该步骤的活化能降低___________ eV。
(3)某研究小组采用上述催化剂,向密闭容器中通入3mol 和1mol
和1mol ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 (CHOH)随压强p的变化、在p-600kPa下
(CHOH)随压强p的变化、在p-600kPa下 (CHOH)随温度T的变化,如下图所示。
(CHOH)随温度T的变化,如下图所示。
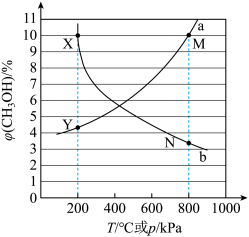
①X点对应的温度和压强为___________ ℃,___________ kPa。
②M点 的分压为
的分压为___________ kPa,此时容器中 为
为 ,CO为
,CO为 ,反应的压强平衡常数
,反应的压强平衡常数
___________  (压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
(压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一,
人工合成淀粉(节选途径见下图)中的重要反应之一,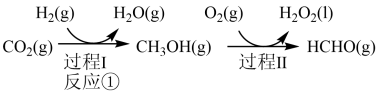
已知:
反应②:

反应③:


(1)反应①的热化学方程式为
(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。

该反应历程中决速步骤的化学方程式为,催化剂使该步骤的活化能降低
(3)某研究小组采用上述催化剂,向密闭容器中通入3mol
 和1mol
和1mol ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 (CHOH)随压强p的变化、在p-600kPa下
(CHOH)随压强p的变化、在p-600kPa下 (CHOH)随温度T的变化,如下图所示。
(CHOH)随温度T的变化,如下图所示。
①X点对应的温度和压强为
②M点
 的分压为
的分压为 为
为 ,CO为
,CO为 ,反应的压强平衡常数
,反应的压强平衡常数
 (压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
(压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
名校
解题方法
2 .  是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
(1)常温下可用空气直接氧化脱除: ;
; 已知
已知 、S的燃烧焓分别为akJ/mol、bkJ/mol,则
、S的燃烧焓分别为akJ/mol、bkJ/mol,则
___________ 。
(2)电化学溶解-沉淀法回收利用 的工艺原理如图所示:
的工艺原理如图所示:
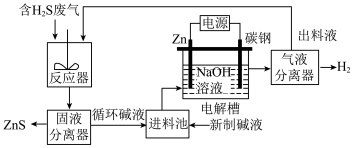
已知:Zn能与强碱溶液反应产生 ;
; 在强碱溶液中以
在强碱溶液中以 形式存在。
形式存在。
①锌棒连接直流电源的___________ (填“正极”或“负极”)。
②“反应器”中反应的离子方程式为___________ 。
③“电解槽”中没接通电源时已经有 产生,用化学用语解释原因
产生,用化学用语解释原因___________ ;
(3)间接电解法脱硫过程的装置图如图所示:
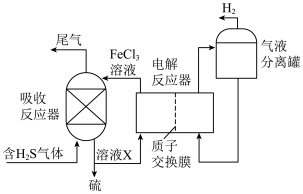
①溶液X的主要溶质是___________ 。
②简述在电解反应器中 溶液再生的原理:
溶液再生的原理:___________ 。
③不考虑其他副反应,理论上5mol 反应能生成
反应能生成___________  。
。
 是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。(1)常温下可用空气直接氧化脱除:
 ;
; 已知
已知 、S的燃烧焓分别为akJ/mol、bkJ/mol,则
、S的燃烧焓分别为akJ/mol、bkJ/mol,则
(2)电化学溶解-沉淀法回收利用
 的工艺原理如图所示:
的工艺原理如图所示:
已知:Zn能与强碱溶液反应产生
 ;
; 在强碱溶液中以
在强碱溶液中以 形式存在。
形式存在。①锌棒连接直流电源的
②“反应器”中反应的离子方程式为
③“电解槽”中没接通电源时已经有
 产生,用化学用语解释原因
产生,用化学用语解释原因(3)间接电解法脱硫过程的装置图如图所示:

①溶液X的主要溶质是
②简述在电解反应器中
 溶液再生的原理:
溶液再生的原理:③不考虑其他副反应,理论上5mol
 反应能生成
反应能生成 。
。
您最近一年使用:0次
3 . 磷酸是重要的化学试剂和工业原料。回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
向NaF溶液中滴加少量 溶液,反应的离子方程式为
溶液,反应的离子方程式为___________ 。
(2)已知:
Ⅰ. CaO(s)+H2SO4(l) CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 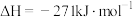
Ⅱ.

①工业上用 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为___________ 。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率___________ (填“增大”“减小”“不变”,下同);HF的平衡浓度___________ 。
(3)工业上用磷尾矿制备 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
___________ ,该反应的平衡常数K=___________ 。
②在压强不变的密闭容器中发生上述反应,设起始的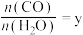 ,CO的平衡体积分数
,CO的平衡体积分数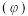 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。

则:该反应的
___________ 0(填“>”“<”或“=”,下同),a___________ 1。
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
| 物质 |  |  |
| 电离常数 |  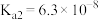 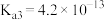 |  |
 溶液,反应的离子方程式为
溶液,反应的离子方程式为(2)已知:
Ⅰ. CaO(s)+H2SO4(l)
 CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 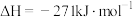
Ⅱ.


①工业上用
 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率
(3)工业上用磷尾矿制备
 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和
 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
②在压强不变的密闭容器中发生上述反应,设起始的
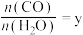 ,CO的平衡体积分数
,CO的平衡体积分数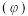 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。
则:该反应的

您最近一年使用:0次
解题方法
4 . 空间站内搭载萨巴蒂尔装置将 转化为
转化为 ,再通过电解水装置回收氧元素.其系统原理如图:
,再通过电解水装置回收氧元素.其系统原理如图:
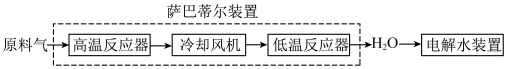
萨巴蒂尔装置内发生反应为
反应Ⅰ: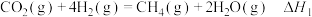
反应Ⅱ: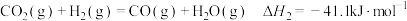
(1)已知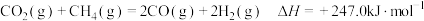 ,则
,则
_________ .
(2)在“高温反应器”中以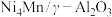 为催化剂,一段时间内不同温度
为催化剂,一段时间内不同温度 转化率如图.已知反应Ⅰ的速率方程:
转化率如图.已知反应Ⅰ的速率方程: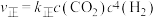 ,
, .
.
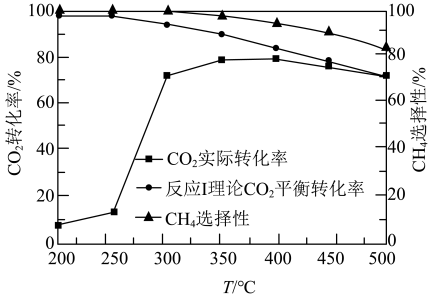
①250℃前, 实际转化率随温度变化不大的主要原因是
实际转化率随温度变化不大的主要原因是___________ .
②300℃时
__________ 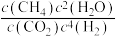 (填“>”“<”或“=”).
(填“>”“<”或“=”).
③达到平衡后,升高温度, 增大的倍数
增大的倍数_________  增大的倍数(填“>”“<”或“=”).
增大的倍数(填“>”“<”或“=”).
(3)在“低温反应器”中达平衡时,各组分物质的量分数随温度变化如图.已知原料气中含有 及
及 .
.
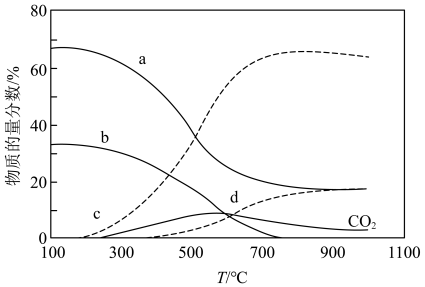
① 物质的量分数随温度变化的曲线为
物质的量分数随温度变化的曲线为____________ (填标号).
②300~500℃, 物质的量分数随温度升高而上升的原因是
物质的量分数随温度升高而上升的原因是___________ .
③某温度下达平衡时,总压为 ,剩余
,剩余 和
和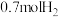 ,则反应Ⅰ的
,则反应Ⅰ的 为
为___________ (列出计算式, 为以分压表示的平衡常数,分压=总压×物质的量分数);
为以分压表示的平衡常数,分压=总压×物质的量分数);
此时氧元素的回收率为____________ [回收率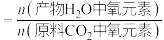 ].
].
(4)从平衡与速率角度分析萨巴蒂尔装置采用高温和低温反应器串联的优点是___________ .
 转化为
转化为 ,再通过电解水装置回收氧元素.其系统原理如图:
,再通过电解水装置回收氧元素.其系统原理如图:
萨巴蒂尔装置内发生反应为
反应Ⅰ:
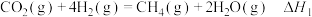
反应Ⅱ:
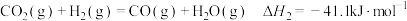
(1)已知
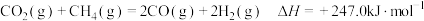 ,则
,则
(2)在“高温反应器”中以
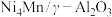 为催化剂,一段时间内不同温度
为催化剂,一段时间内不同温度 转化率如图.已知反应Ⅰ的速率方程:
转化率如图.已知反应Ⅰ的速率方程: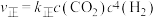 ,
, .
.
①250℃前,
 实际转化率随温度变化不大的主要原因是
实际转化率随温度变化不大的主要原因是②300℃时

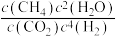 (填“>”“<”或“=”).
(填“>”“<”或“=”).③达到平衡后,升高温度,
 增大的倍数
增大的倍数 增大的倍数(填“>”“<”或“=”).
增大的倍数(填“>”“<”或“=”).(3)在“低温反应器”中达平衡时,各组分物质的量分数随温度变化如图.已知原料气中含有
 及
及 .
.
①
 物质的量分数随温度变化的曲线为
物质的量分数随温度变化的曲线为②300~500℃,
 物质的量分数随温度升高而上升的原因是
物质的量分数随温度升高而上升的原因是③某温度下达平衡时,总压为
 ,剩余
,剩余 和
和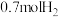 ,则反应Ⅰ的
,则反应Ⅰ的 为
为 为以分压表示的平衡常数,分压=总压×物质的量分数);
为以分压表示的平衡常数,分压=总压×物质的量分数);此时氧元素的回收率为
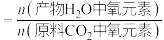 ].
].(4)从平衡与速率角度分析萨巴蒂尔装置采用高温和低温反应器串联的优点是
您最近一年使用:0次
解题方法
5 . 下列物质摩尔燃烧焓数据如下表:
下列表述正确的是
物质 | C(s,石墨) | C(s,金刚石) |
|
|
|
| -393.5 | -395.4 | -285.8 | -283.0 | -890.3 |
A.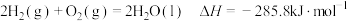 |
B.C(s,石墨)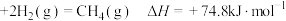 |
C.C(s,石墨)=C(s,金刚石)  |
D.C(s,石墨)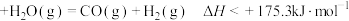 |
您最近一年使用:0次
6 . 实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点,有效方式之一就是二氧化碳直接加氢合成高附加值产品。
(1)一定条件下,可用二氧化碳加氢合成甲醇。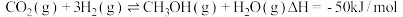 ,该反应经过以下步骤实现:
,该反应经过以下步骤实现:
Ⅰ.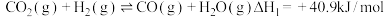
Ⅱ.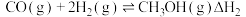
①求
②已知反应Ⅰ是整个反应的决速步,下列示意图中能体现上述反应能量变化的是___________ (填标号)。
A.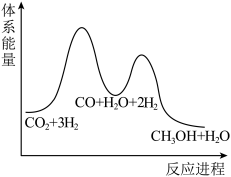
B.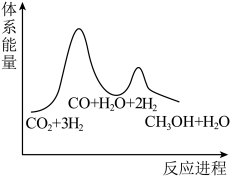
C.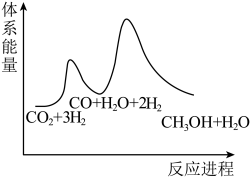
D.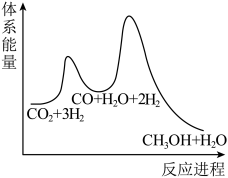
(2)一定条件下也可用二氧化碳加氢合成甲烷: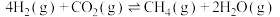 。
。
①在绝热恒容密闭容器中,一定能说明该反应达到平衡状态的是___________ (填字母)。
A.
B.相同时间内断裂 的数目与断裂
的数目与断裂 数目相等
数目相等
C.容器温度保持不变
D.当 与
与 物质的量之比保持
物质的量之比保持 不变
不变
一定温度下在 恒温恒容密闭容器中初始加入
恒温恒容密闭容器中初始加入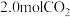 和一定量
和一定量 ,发生上述反应数据如下:
,发生上述反应数据如下:
②该温度下反应的化学平衡常数 为
为___________ 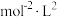
(3)一定条件下也可用二氧化碳加氢合成甲酸
①温度为 时,等物质的量的
时,等物质的量的 和
和 充入体积为
充入体积为 的恒容密闭容器中发生反应:
的恒容密闭容器中发生反应: 。实验测得:
。实验测得: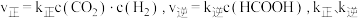 为速率常数。
为速率常数。 时,
时, 。
。
②温度从 到
到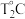 时,
时, ,则
,则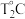 时平衡压强
时平衡压强___________ (填“ "“
"“ ”或“
”或“ ")
") 时平衡压强,理由是
时平衡压强,理由是___________ 。
(4)一定条件下可用二氧化碳提供电能,“溶解”水中的二氧化碳发生电化学反应,产生电能和氢气,其工作原理如图所示。
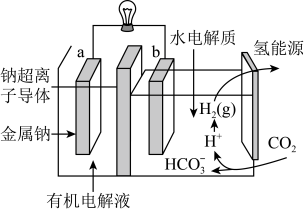
①左室有机电解液是有机溶剂加特定的盐加热制成,该装置的有机电解液___________ (填“能”或“不能”)用乙醇做溶剂。
②写出二氧化碳生成氢气的电极反应式:___________ 。
(1)一定条件下,可用二氧化碳加氢合成甲醇。
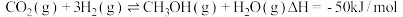 ,该反应经过以下步骤实现:
,该反应经过以下步骤实现:Ⅰ.
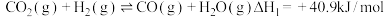
Ⅱ.
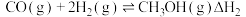
①求

②已知反应Ⅰ是整个反应的决速步,下列示意图中能体现上述反应能量变化的是
A.

B.

C.

D.

(2)一定条件下也可用二氧化碳加氢合成甲烷:
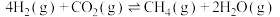 。
。①在绝热恒容密闭容器中,一定能说明该反应达到平衡状态的是
A.

B.相同时间内断裂
 的数目与断裂
的数目与断裂 数目相等
数目相等C.容器温度保持不变
D.当
 与
与 物质的量之比保持
物质的量之比保持 不变
不变一定温度下在
 恒温恒容密闭容器中初始加入
恒温恒容密闭容器中初始加入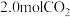 和一定量
和一定量 ,发生上述反应数据如下:
,发生上述反应数据如下: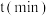 | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
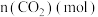 | 2.0 | 1.5 | 1.1 | 0.8 | 0.6 | 0.5 | 0.5 |
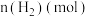 | 3.2 |
 为
为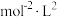
(3)一定条件下也可用二氧化碳加氢合成甲酸
①温度为
 时,等物质的量的
时,等物质的量的 和
和 充入体积为
充入体积为 的恒容密闭容器中发生反应:
的恒容密闭容器中发生反应: 。实验测得:
。实验测得: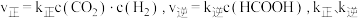 为速率常数。
为速率常数。 时,
时, 。
。②温度从
 到
到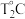 时,
时, ,则
,则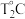 时平衡压强
时平衡压强 "“
"“ ”或“
”或“ ")
") 时平衡压强,理由是
时平衡压强,理由是(4)一定条件下可用二氧化碳提供电能,“溶解”水中的二氧化碳发生电化学反应,产生电能和氢气,其工作原理如图所示。

①左室有机电解液是有机溶剂加特定的盐加热制成,该装置的有机电解液
②写出二氧化碳生成氢气的电极反应式:
您最近一年使用:0次
名校
解题方法
7 . 研发二氧化碳的碳捕集和碳利用技术及合成氨是科学研究热点问题,回答下列问题:
Ⅰ.CO2催化加氢制取甲醇,反应如下:
主反应: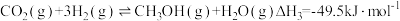
副反应: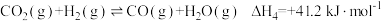
(1)则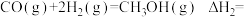
___________ kJ∙mol-1,该反应在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
(2)在一定条件下,向某1L恒容密闭容器中充入1mol CO2和amol H2发生反应,起始总压强为21.2MPa.实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度变化如图所示: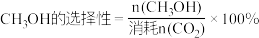 。
。
图中表示平衡时CH3OH的选择性的曲线为___________ (填“X”或“Y”),温度高于 280℃时,曲线 Y 随温度升高而升高的原因是___________ 。240℃时,反应20 min容器内达到平衡状态,副反应的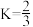 ,初始充入H2的物质的量a =
,初始充入H2的物质的量a = ___________ mol。
(3)工业利用N2 、H2催化合成氨实现了人类“向空气中要面包”的梦想。原料气(含N2 、H2 、CO)中的 CO 能被催化剂吸附,需经过铜氨液处理除去,反应为: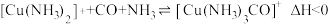 。
。
①除去原料气中 CO 的理由是___________ 。
②研究发现铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的物种用*标注。该反应历程中最大活化能对应步骤的化学方程式为___________ 。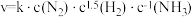 (k 为速率常数)。c (NH3 )的指数为负数的原因是
(k 为速率常数)。c (NH3 )的指数为负数的原因是___________ 。
Ⅰ.CO2催化加氢制取甲醇,反应如下:
主反应:
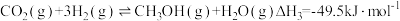
副反应:
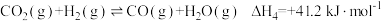
(1)则
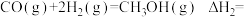
(2)在一定条件下,向某1L恒容密闭容器中充入1mol CO2和amol H2发生反应,起始总压强为21.2MPa.实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度变化如图所示:
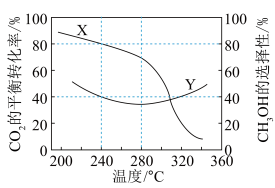
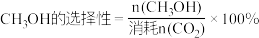 。
。图中表示平衡时CH3OH的选择性的曲线为
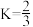 ,初始充入H2的物质的量a =
,初始充入H2的物质的量a = (3)工业利用N2 、H2催化合成氨实现了人类“向空气中要面包”的梦想。原料气(含N2 、H2 、CO)中的 CO 能被催化剂吸附,需经过铜氨液处理除去,反应为:
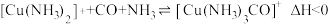 。
。①除去原料气中 CO 的理由是
②研究发现铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的物种用*标注。该反应历程中最大活化能对应步骤的化学方程式为
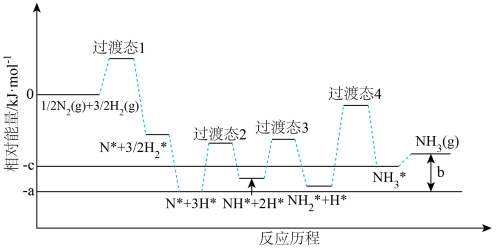
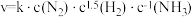 (k 为速率常数)。c (NH3 )的指数为负数的原因是
(k 为速率常数)。c (NH3 )的指数为负数的原因是
您最近一年使用:0次
2024-01-21更新
|
161次组卷
|
2卷引用:福建省厦门外国语学校2023-2024学年高二上学期期末模拟考试化学试题
名校
解题方法
8 . 按照要求写出下列热化学方程式。
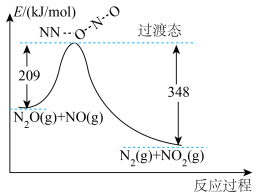
(1)由 和NO反应生成
和NO反应生成 和
和 的能量变化如图所示。写出该反应的热化学方程式
的能量变化如图所示。写出该反应的热化学方程式____________ 。
(2)已知稀溶液中,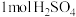 与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示
与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示 与NaOH反应的中和热的热化学方程式
与NaOH反应的中和热的热化学方程式____________ 。
(3)将 转化为
转化为 是工业冶炼金属钛的主要反应之一。已知:
是工业冶炼金属钛的主要反应之一。已知:

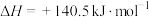
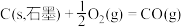
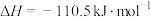
则反应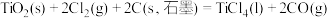 的
的 是
是______ 。
(1)由
 和NO反应生成
和NO反应生成 和
和 的能量变化如图所示。写出该反应的热化学方程式
的能量变化如图所示。写出该反应的热化学方程式
(2)已知稀溶液中,
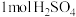 与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示
与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示 与NaOH反应的中和热的热化学方程式
与NaOH反应的中和热的热化学方程式(3)将
 转化为
转化为 是工业冶炼金属钛的主要反应之一。已知:
是工业冶炼金属钛的主要反应之一。已知:
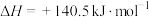
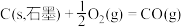
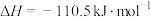
则反应
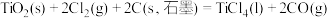 的
的 是
是
您最近一年使用:0次
9 . 页岩气中含有 、
、 、
、 等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。
(1)去除废气中 的相关热化学方程式如下:
的相关热化学方程式如下:
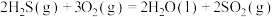
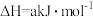
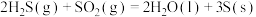

反应 的
的
______ 
(2)金属硫化物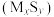 催化反应
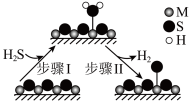
催化反应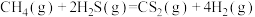 ,既可以除去天然气中的
,既可以除去天然气中的 ,又可以获得
,又可以获得 ,下列说法正确的是______。
,下列说法正确的是______。
(3)通过电化学循环法可将 转化为
转化为 和
和 (如图所示),其中氧化过程发生如下两步反应:
(如图所示),其中氧化过程发生如下两步反应: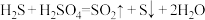 、
、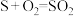 。
。
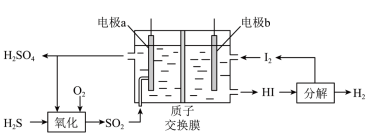
①电极a上发生反应的电极反应式为__________________ 。
②理论上1mol 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为__________________ 。
(4)我国科学家设计了一种 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,装置如下图所示,电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。
的高效去除,装置如下图所示,电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。
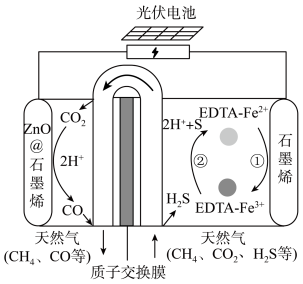
①Zno@石墨烯是______ 极(填“阳”或“阴”)。
②石墨烯电极区发生反应为:
ⅰ.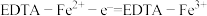
ⅱ.__________________ 。
 、
、 、
、 等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。(1)去除废气中
 的相关热化学方程式如下:
的相关热化学方程式如下: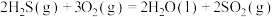
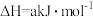
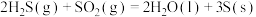

反应
 的
的

(2)金属硫化物
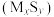 催化反应
催化反应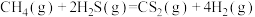 ,既可以除去天然气中的
,既可以除去天然气中的 ,又可以获得
,又可以获得 ,下列说法正确的是______。
,下列说法正确的是______。
A.该反应的 |
B.该反应的平衡常数 |
C.题图所示的反应机理中,步骤Ⅰ可理解为 中带部分负电荷的S与催化剂中的M之间发生作用 中带部分负电荷的S与催化剂中的M之间发生作用 |
D.该反应中每消耗1mol ,转移电子的数目约为 ,转移电子的数目约为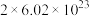 |
(3)通过电化学循环法可将
 转化为
转化为 和
和 (如图所示),其中氧化过程发生如下两步反应:
(如图所示),其中氧化过程发生如下两步反应: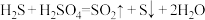 、
、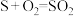 。
。
①电极a上发生反应的电极反应式为
②理论上1mol
 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为(4)我国科学家设计了一种
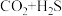 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,装置如下图所示,电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。
的高效去除,装置如下图所示,电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。
①Zno@石墨烯是
②石墨烯电极区发生反应为:
ⅰ.
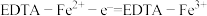
ⅱ.
您最近一年使用:0次
名校
解题方法
10 . 乙烯产量是衡量一个国家石油化工发展水平的重要标志,羟基氮化硼可高效催化乙烷氧化脱氢制乙烯。
主反应: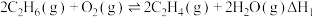
副反应: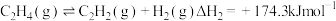
(1) 的燃烧热
的燃烧热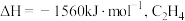 的燃烧热
的燃烧热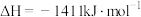 ,
,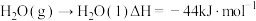 ,则
,则
___________ 。
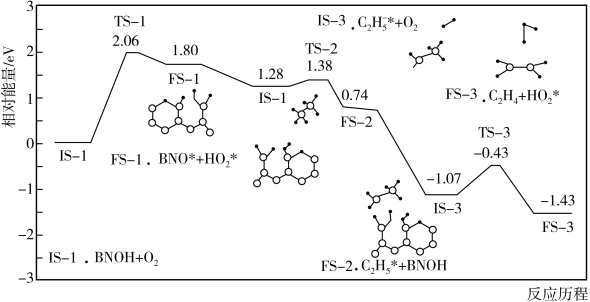
(2)主反应的部分反应历程如下图所示(图中IS表示起始态,TS表示过渡态,FS表示终态)。这一部分反应中慢反应的活化能
___________  。
。
(3)提高乙烯平衡产率的方法是___________ (任写两条),提高乙烯单位时间产量的关键因素是___________ 。
(4)工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的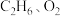 和
和 混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
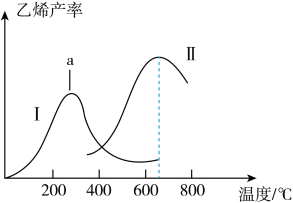
①曲线1中,a点右侧乙烯产量随温度升高而降低的原因是___________ 。
②两种催化剂比较,催化剂Ⅱ的优点与不足是___________ 。
(5)一定温度下,维持压强始终为p,向反应装置中通入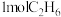 、
、 和
和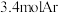 的混合气体,经过
的混合气体,经过 后,反应达到平衡,此时乙烷的转化率为
后,反应达到平衡,此时乙烷的转化率为 ,乙烯选择性为
,乙烯选择性为 ,(乙烯选择性
,(乙烯选择性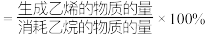 )。
)。
①反应速率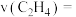
___________ 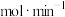 。
。
②已知:气体分压 气体总压
气体总压 气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则主反应在该温度下的
,则主反应在该温度下的
___________ (列出计算式即可,不必化简)。
主反应:
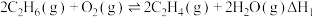
副反应:
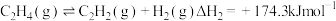
(1)
 的燃烧热
的燃烧热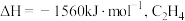 的燃烧热
的燃烧热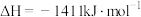 ,
,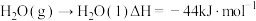 ,则
,则
(2)主反应的部分反应历程如下图所示(图中IS表示起始态,TS表示过渡态,FS表示终态)。这一部分反应中慢反应的活化能

 。
。
(3)提高乙烯平衡产率的方法是
(4)工业上催化氧化制乙烯时,通常在乙烷和氧气的混合气体中掺入惰性气体,即将一定比例的
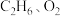 和
和 混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
混合气体以一定的流速通过两种不同的催化剂进行反应,相同时间内测得乙烯的产率如下图所示。
①曲线1中,a点右侧乙烯产量随温度升高而降低的原因是
②两种催化剂比较,催化剂Ⅱ的优点与不足是
(5)一定温度下,维持压强始终为p,向反应装置中通入
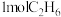 、
、 和
和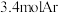 的混合气体,经过
的混合气体,经过 后,反应达到平衡,此时乙烷的转化率为
后,反应达到平衡,此时乙烷的转化率为 ,乙烯选择性为
,乙烯选择性为 ,(乙烯选择性
,(乙烯选择性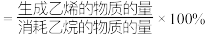 )。
)。①反应速率
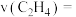
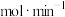 。
。②已知:气体分压
 气体总压
气体总压 气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则主反应在该温度下的
,则主反应在该温度下的
您最近一年使用:0次