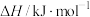1 . 丙烷的价格低廉且产量大,丙烷脱氢制丙烯是获取丙烯及其衍生物的重要途径。
反应ⅰ(直接脱氢):

反应ⅱ:

(1)已知下列键能数据,结合反应ⅰ数据,计算 的键能是
的键能是________  。
。
(2)计算反应ⅲ( 氧化丙烷脱氢):
氧化丙烷脱氢): 的
的
________  。
。
(3) 催化丙烷直接脱氢的主要副反应为
催化丙烷直接脱氢的主要副反应为 。
。
①一定温度下,向恒容容器中充入一定量丙烷,在 催化作用下脱氢制丙烯,下列情况表明反应达到平衡状态的是
催化作用下脱氢制丙烯,下列情况表明反应达到平衡状态的是________________ (填标号)。
A.气体密度不再改变
B.气体平均摩尔质量不再改变
C.体系压强不再改变
D.单位时间内消耗 的物质的量与生成
的物质的量与生成 的物质的量相等
的物质的量相等
② 下,在
下,在 容器中充入
容器中充入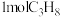 ,
,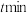 后达到平衡状态时,
后达到平衡状态时, 转化率为
转化率为 ,
, 选择性为
选择性为 ,则
,则 的消耗速率
的消耗速率
________  ,丙烷脱氢反应的平衡常数
,丙烷脱氢反应的平衡常数
________ 。(已知 选择性
选择性 )
)
(4)以 作催化剂,对反应ⅲ的机理展开研究.以
作催化剂,对反应ⅲ的机理展开研究.以 和
和 为原料,初期产物中没有检测到
为原料,初期产物中没有检测到 ;以含有
;以含有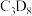 的
的 和
和 为原料,反应过程中没有检测到
为原料,反应过程中没有检测到 。下列推断合理的是
。下列推断合理的是________ (填标号)
A. 先吸附氧气,吸附的氧气直接与吸附的丙烷反应
先吸附氧气,吸附的氧气直接与吸附的丙烷反应
B. 直接氧化吸附的丙烷,吸附的氧气补充
直接氧化吸附的丙烷,吸附的氧气补充 中反应掉的氧
中反应掉的氧
C. 催化丙烷脱氢过程中,碳氢键的断裂是可逆的
催化丙烷脱氢过程中,碳氢键的断裂是可逆的
(5)用 替换
替换 ,进行氧化丙烷脱氢,可避免丙烷深度氧化、
,进行氧化丙烷脱氢,可避免丙烷深度氧化、 资源化利用等优势。
资源化利用等优势。
①结合键能数据分析 氧化丙烷脱氢反应的挑战和难点
氧化丙烷脱氢反应的挑战和难点________________ 。
② 也可以进行氧化乙苯脱氢制取苯乙烯,
也可以进行氧化乙苯脱氢制取苯乙烯, 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( ,
, 表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,
表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷, 、
、 位点带部分负电荷)。
位点带部分负电荷)。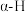 带部分正电荷,被带部分负电荷的
带部分正电荷,被带部分负电荷的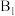 位点吸引,随后解离出
位点吸引,随后解离出 并吸附在
并吸附在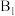 位点上;步骤Ⅱ可描述为:
位点上;步骤Ⅱ可描述为:________________ 。
反应ⅰ(直接脱氢):


反应ⅱ:


(1)已知下列键能数据,结合反应ⅰ数据,计算
 的键能是
的键能是 。
。化学键 |
|
|
|
|
键能( | 347.7 | 413.4 | 436.0 | 745 |
(2)计算反应ⅲ(
 氧化丙烷脱氢):
氧化丙烷脱氢): 的
的
 。
。(3)
 催化丙烷直接脱氢的主要副反应为
催化丙烷直接脱氢的主要副反应为 。
。①一定温度下,向恒容容器中充入一定量丙烷,在
 催化作用下脱氢制丙烯,下列情况表明反应达到平衡状态的是
催化作用下脱氢制丙烯,下列情况表明反应达到平衡状态的是A.气体密度不再改变
B.气体平均摩尔质量不再改变
C.体系压强不再改变
D.单位时间内消耗
 的物质的量与生成
的物质的量与生成 的物质的量相等
的物质的量相等②
 下,在
下,在 容器中充入
容器中充入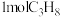 ,
,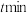 后达到平衡状态时,
后达到平衡状态时, 转化率为
转化率为 ,
, 选择性为
选择性为 ,则
,则 的消耗速率
的消耗速率
 ,丙烷脱氢反应的平衡常数
,丙烷脱氢反应的平衡常数
 选择性
选择性 )
)(4)以
 作催化剂,对反应ⅲ的机理展开研究.以
作催化剂,对反应ⅲ的机理展开研究.以 和
和 为原料,初期产物中没有检测到
为原料,初期产物中没有检测到 ;以含有
;以含有 的
的 和
和 为原料,反应过程中没有检测到
为原料,反应过程中没有检测到 。下列推断合理的是
。下列推断合理的是A.
 先吸附氧气,吸附的氧气直接与吸附的丙烷反应
先吸附氧气,吸附的氧气直接与吸附的丙烷反应B.
 直接氧化吸附的丙烷,吸附的氧气补充
直接氧化吸附的丙烷,吸附的氧气补充 中反应掉的氧
中反应掉的氧C.
 催化丙烷脱氢过程中,碳氢键的断裂是可逆的
催化丙烷脱氢过程中,碳氢键的断裂是可逆的(5)用
 替换
替换 ,进行氧化丙烷脱氢,可避免丙烷深度氧化、
,进行氧化丙烷脱氢,可避免丙烷深度氧化、 资源化利用等优势。
资源化利用等优势。①结合键能数据分析
 氧化丙烷脱氢反应的挑战和难点
氧化丙烷脱氢反应的挑战和难点②
 也可以进行氧化乙苯脱氢制取苯乙烯,
也可以进行氧化乙苯脱氢制取苯乙烯, 参与的乙苯脱氢机理如图所示(
参与的乙苯脱氢机理如图所示( ,
, 表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,
表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷, 、
、 位点带部分负电荷)。
位点带部分负电荷)。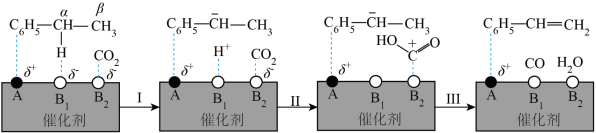
 带部分正电荷,被带部分负电荷的
带部分正电荷,被带部分负电荷的 位点吸引,随后解离出
位点吸引,随后解离出 并吸附在
并吸附在 位点上;步骤Ⅱ可描述为:
位点上;步骤Ⅱ可描述为:
您最近一年使用:0次
2 . 可利用干法热分解法和湿法催化氧化法高效脱除沼气中的 。
。
(1)已知:部分键能数据为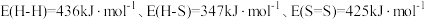 。
。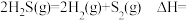
___________  。
。
(2)干法热分解法原理为 。向体积为
。向体积为 恒容容器中充入
恒容容器中充入 ,初始压强为
,初始压强为 ,平衡时体系中各物质
,平衡时体系中各物质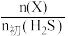 随温度t的变化如图。
随温度t的变化如图。 对应图中的曲线是
对应图中的曲线是___________ (填字母),结合平衡移动原理说明理由。___________
②t1℃时, 的平衡转化率为
的平衡转化率为___________ ,分压平衡常数
___________ (以分压表示,分压=总压×物质的量分数,列计算式即可)。
(3)湿法催化氧化法高效脱除 的过程如下。
的过程如下。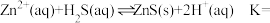
___________ 。(已知:25℃时, 的
的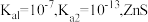 的
的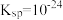 )
)
②“氧化沉硫”中发生反应的离子方程式有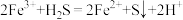 、
、___________ 。
③ 对脱硫效率影响如图。随着
对脱硫效率影响如图。随着 增大,脱硫效率趋于平缓的原因是
增大,脱硫效率趋于平缓的原因是___________ 。___________ (填化学式)。
(4)相比湿法催化氧化法,干法热分解法的优点是___________ ,缺点是___________ 。
 。
。(1)已知:部分键能数据为
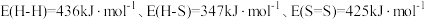 。
。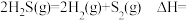
 。
。(2)干法热分解法原理为
 。向体积为
。向体积为 恒容容器中充入
恒容容器中充入 ,初始压强为
,初始压强为 ,平衡时体系中各物质
,平衡时体系中各物质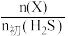 随温度t的变化如图。
随温度t的变化如图。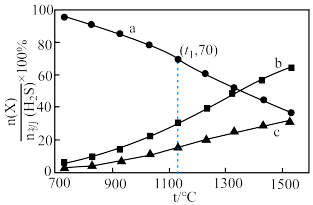
 对应图中的曲线是
对应图中的曲线是②t1℃时,
 的平衡转化率为
的平衡转化率为
(3)湿法催化氧化法高效脱除
 的过程如下。
的过程如下。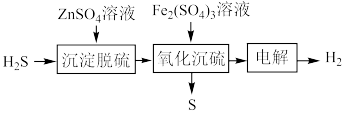
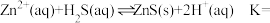
 的
的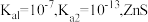 的
的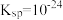 )
)②“氧化沉硫”中发生反应的离子方程式有
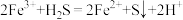 、
、③
 对脱硫效率影响如图。随着
对脱硫效率影响如图。随着 增大,脱硫效率趋于平缓的原因是
增大,脱硫效率趋于平缓的原因是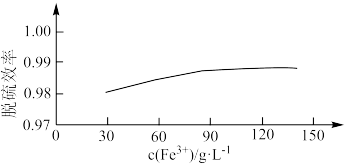
(4)相比湿法催化氧化法,干法热分解法的优点是
您最近一年使用:0次
3 . 甲硫醇(CH3SH)是重要的有机化工中间体,可用于合成维生素。通过CH3OH和H2S合成CH3SH的主要反应为:
Ⅰ.
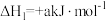
Ⅱ.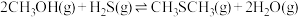
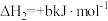
回答下列问题:
(1)计算反应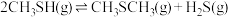 的△H=
的△H=________ kJ/mol。
(2)T1℃时,向恒容密闭容器中充入一定量CH3OH(g)和H2S(g)发生反应,下列事实能说明反应达到平衡状态的是________ (填选项字母);若按相同比例再充入一定量CH3OH(g)和H2S(g),CH3OH(g)的平衡转化率将________ (填“变大”“变小”或“不变”)。
A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C.H2S(g)的体积分数不再发生变化 D.CH3SCH3(g)和H2O(g)的物质的量之比不再变化
(3)T2℃时,向压强为P0的恒压密闭容器中按物质的量之比为1:2充入CH3OH(g)和H2S(g)发生反应,达到平衡时,CH3OH(g)的转化率为80%,CH3SCH3(g)的体积分数为5%。
①计算H2S(g)的选择性为________ (CH3SH的选择性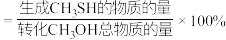 )。
)。
②反应Ⅰ的平衡常数Kp=________ (Kp是用分压表示的平衡常数,结果保留两位小数)。
(4)在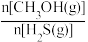 =1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。
=1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。________ Mpa/min(结果保留两位有效数字)。
②当温度高于370℃时,CH3OH(g)转化率随温度升高而降低的原因可能为________ 。
③从电负性的角度描述ⅲ→ⅰ中脱水的过程:________ 。
Ⅰ.

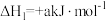
Ⅱ.
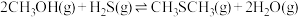
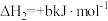
回答下列问题:
(1)计算反应
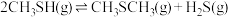 的△H=
的△H=(2)T1℃时,向恒容密闭容器中充入一定量CH3OH(g)和H2S(g)发生反应,下列事实能说明反应达到平衡状态的是
A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C.H2S(g)的体积分数不再发生变化 D.CH3SCH3(g)和H2O(g)的物质的量之比不再变化
(3)T2℃时,向压强为P0的恒压密闭容器中按物质的量之比为1:2充入CH3OH(g)和H2S(g)发生反应,达到平衡时,CH3OH(g)的转化率为80%,CH3SCH3(g)的体积分数为5%。
①计算H2S(g)的选择性为
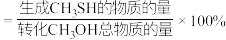 )。
)。②反应Ⅰ的平衡常数Kp=
(4)在
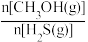 =1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。
=1:2、反应压力为0.7Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中CH3OH(g)转化率、CH3SH(g)选择性随温度的变化如图甲所示,催化机理如图乙所示。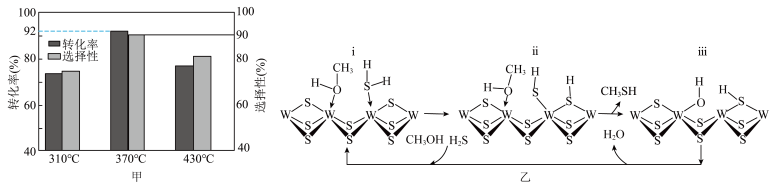
②当温度高于370℃时,CH3OH(g)转化率随温度升高而降低的原因可能为
③从电负性的角度描述ⅲ→ⅰ中脱水的过程:
您最近一年使用:0次
名校
4 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。我国科学家研究 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
反应Ⅰ.
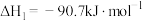
反应Ⅱ.

反应Ⅲ.
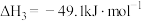
(1)反应Ⅱ的
___________ 
(2)下列措施有利于提高甲醇平衡产率的是___________(填字母)。
(3)反应III的平衡常数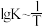 ,的变化关系应为下图的曲线
,的变化关系应为下图的曲线___________ (填“①”或“②”) 时,往某密闭容器中按投料比
时,往某密闭容器中按投料比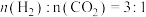 充入
充入 和
和 ,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。___________ (填化学式)。
②体系中 的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的
的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的___________ 反应和反应Ⅲ的___________ 反应(填“正向”或“逆向”)。
(5)T℃时,将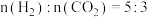 的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知:
的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。)
为用气体分压表示的平衡常数,分压=物质的量分数×总压。)
反应Ⅱ:
反应Ⅲ:
反应达到平衡状态时, 和
和 的分压相等,甲醇的选择性(产率)是CO的2倍,则
的分压相等,甲醇的选择性(产率)是CO的2倍,则 的平衡转化率为
的平衡转化率为___________ ,反应Ⅲ的
___________ 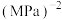 (列出计算式即可)。
(列出计算式即可)。
 加氢制备甲醇方面取得一定进展。在一定温度和压强下,
加氢制备甲醇方面取得一定进展。在一定温度和压强下, 加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:
加氢制备甲醇的过程中主要发生如下三个反应,请回答以下问题:反应Ⅰ.

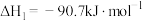
反应Ⅱ.


反应Ⅲ.

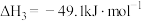
(1)反应Ⅱ的


(2)下列措施有利于提高甲醇平衡产率的是___________(填字母)。
| A.加入适量CO | B.使用催化剂 |
| C.循环利用原料气 | D.升高温度 |
(3)反应III的平衡常数
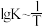 ,的变化关系应为下图的曲线
,的变化关系应为下图的曲线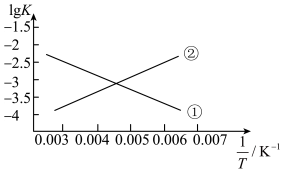
 时,往某密闭容器中按投料比
时,往某密闭容器中按投料比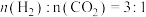 充入
充入 和
和 ,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
②体系中
 的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的
的物质的量分数受温度的影响变化不大,说明升高温度有利于反应Ⅱ的(5)T℃时,将
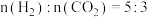 的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知:
的混合气体充入压强为6MPa的恒压密闭容器中,在催化剂的作用下发生反应Ⅱ和反应Ⅲ:(已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。)
为用气体分压表示的平衡常数,分压=物质的量分数×总压。)反应Ⅱ:

反应Ⅲ:

反应达到平衡状态时,
 和
和 的分压相等,甲醇的选择性(产率)是CO的2倍,则
的分压相等,甲醇的选择性(产率)是CO的2倍,则 的平衡转化率为
的平衡转化率为
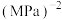 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2024-05-03更新
|
138次组卷
|
3卷引用:福建省厦门市国祺中学2023-2024学年高三上学期第三次月考化学试题
名校
5 . 由 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一,
人工合成淀粉(节选途径见下图)中的重要反应之一,
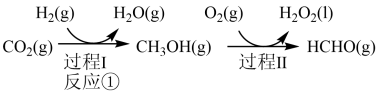
已知:
反应②:
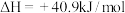
反应③:

(1)反应①的热化学方程式为___________ ;若过程Ⅱ中O得到4mol电子,则理论上可生成___________ molHCHO。
(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。
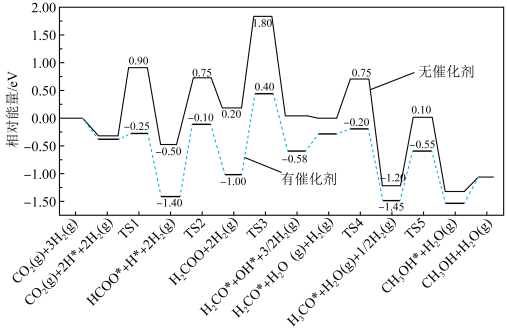
该反应历程中决速步骤的化学方程式为,催化剂使该步骤的活化能降低___________ eV。
(3)某研究小组采用上述催化剂,向密闭容器中通入3mol 和1mol
和1mol ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 (CHOH)随压强p的变化、在p-600kPa下
(CHOH)随压强p的变化、在p-600kPa下 (CHOH)随温度T的变化,如下图所示。
(CHOH)随温度T的变化,如下图所示。
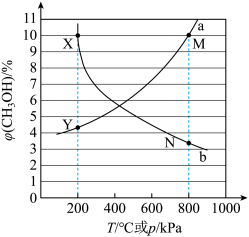
①X点对应的温度和压强为___________ ℃,___________ kPa。
②M点 的分压为
的分压为___________ kPa,此时容器中 为
为 ,CO为
,CO为 ,反应的压强平衡常数
,反应的压强平衡常数
___________  (压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
(压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见下图)中的重要反应之一,
人工合成淀粉(节选途径见下图)中的重要反应之一,
已知:
反应②:

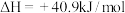
反应③:


(1)反应①的热化学方程式为
(2)反应①在有、无催化剂条件下的反应历程如下图所示,其中吸附在催化剂表面上的物种用*标注,TS为过渡态。

该反应历程中决速步骤的化学方程式为,催化剂使该步骤的活化能降低
(3)某研究小组采用上述催化剂,向密闭容器中通入3mol
 和1mol
和1mol ,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数
,只发生反应①和反应②,在不同条件下达到平衡,在T=300℃下甲醇的体积分数 (CHOH)随压强p的变化、在p-600kPa下
(CHOH)随压强p的变化、在p-600kPa下 (CHOH)随温度T的变化,如下图所示。
(CHOH)随温度T的变化,如下图所示。
①X点对应的温度和压强为
②M点
 的分压为
的分压为 为
为 ,CO为
,CO为 ,反应的压强平衡常数
,反应的压强平衡常数
 (压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
(压强平衡常数K是以分压代替浓度表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
名校
解题方法
6 .  是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
(1)常温下可用空气直接氧化脱除: ;
; 已知
已知 、S的燃烧焓分别为akJ/mol、bkJ/mol,则
、S的燃烧焓分别为akJ/mol、bkJ/mol,则
___________ 。
(2)电化学溶解-沉淀法回收利用 的工艺原理如图所示:
的工艺原理如图所示:
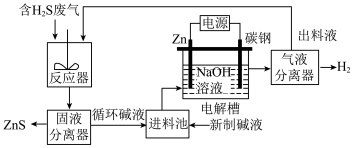
已知:Zn能与强碱溶液反应产生 ;
; 在强碱溶液中以
在强碱溶液中以 形式存在。
形式存在。
①锌棒连接直流电源的___________ (填“正极”或“负极”)。
②“反应器”中反应的离子方程式为___________ 。
③“电解槽”中没接通电源时已经有 产生,用化学用语解释原因
产生,用化学用语解释原因___________ ;
(3)间接电解法脱硫过程的装置图如图所示:
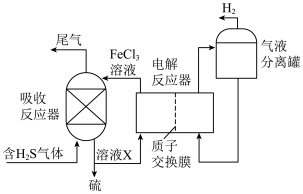
①溶液X的主要溶质是___________ 。
②简述在电解反应器中 溶液再生的原理:
溶液再生的原理:___________ 。
③不考虑其他副反应,理论上5mol 反应能生成
反应能生成___________  。
。
 是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。(1)常温下可用空气直接氧化脱除:
 ;
; 已知
已知 、S的燃烧焓分别为akJ/mol、bkJ/mol,则
、S的燃烧焓分别为akJ/mol、bkJ/mol,则
(2)电化学溶解-沉淀法回收利用
 的工艺原理如图所示:
的工艺原理如图所示:
已知:Zn能与强碱溶液反应产生
 ;
; 在强碱溶液中以
在强碱溶液中以 形式存在。
形式存在。①锌棒连接直流电源的
②“反应器”中反应的离子方程式为
③“电解槽”中没接通电源时已经有
 产生,用化学用语解释原因
产生,用化学用语解释原因(3)间接电解法脱硫过程的装置图如图所示:

①溶液X的主要溶质是
②简述在电解反应器中
 溶液再生的原理:
溶液再生的原理:③不考虑其他副反应,理论上5mol
 反应能生成
反应能生成 。
。
您最近一年使用:0次
7 . 磷酸是重要的化学试剂和工业原料。回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
向NaF溶液中滴加少量 溶液,反应的离子方程式为
溶液,反应的离子方程式为___________ 。
(2)已知:
Ⅰ. CaO(s)+H2SO4(l) CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 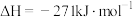
Ⅱ.

①工业上用 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为___________ 。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率___________ (填“增大”“减小”“不变”,下同);HF的平衡浓度___________ 。
(3)工业上用磷尾矿制备 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
___________ ,该反应的平衡常数K=___________ 。
②在压强不变的密闭容器中发生上述反应,设起始的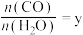 ,CO的平衡体积分数
,CO的平衡体积分数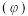 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。

则:该反应的
___________ 0(填“>”“<”或“=”,下同),a___________ 1。
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
| 物质 |  |  |
| 电离常数 |  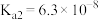 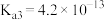 |  |
 溶液,反应的离子方程式为
溶液,反应的离子方程式为(2)已知:
Ⅰ. CaO(s)+H2SO4(l)
 CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 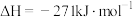
Ⅱ.


①工业上用
 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率
(3)工业上用磷尾矿制备
 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和
 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
②在压强不变的密闭容器中发生上述反应,设起始的
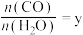 ,CO的平衡体积分数
,CO的平衡体积分数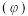 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。
则:该反应的

您最近一年使用:0次
8 . 利用热分解法可回收炼油厂酸渣(含硫酸,沥青质等)中的硫酸,并结合络合滴定法测定硫酸回收率。
(1)沥青质随温度升高反应产物如图(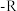 为烷烃基)。
为烷烃基)。__________ (填标号)。
②“阶段2”中发生的主要反应类型为__________ (填标号)。
A.裂化 B.裂解 C.精馏 D.干馏
(2)利用热分解法测定硫酸回收量(以 、
、 的硫元素含量计)。有关热化学方程式为:
的硫元素含量计)。有关热化学方程式为:
反应I: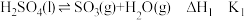
反应Ⅱ: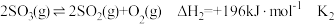
①已知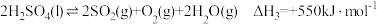 ,则
,则
_________  。
。
②下列能说明在密闭容器中反应Ⅱ达到平衡状态的有__________ (填标号)。
A.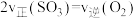 B.
B.
C.混合气体平均相对分子质量不再改变 D. 的体积分数保持不变
的体积分数保持不变
③在压强为p的反应体系中对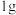 酸渣进行热分解,平衡时体系中
酸渣进行热分解,平衡时体系中 、
、 的气体体积分数和热解气体总体积(已折算为标准状况)随温度变化如图。
的气体体积分数和热解气体总体积(已折算为标准状况)随温度变化如图。
_________  (选填“>”或“<”),依据是
(选填“>”或“<”),依据是____________________ 。
ⅱ.结合平衡移动原理分析, 气体体积分数随温度变化的原因可能为
气体体积分数随温度变化的原因可能为____________________ 。
(3)利用络合滴定法测定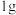 酸渣中硫酸总含量,进行如下实验。
酸渣中硫酸总含量,进行如下实验。
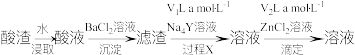
已知:i. 时,
时,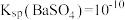 ;
;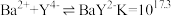 。
。
ii.滴定过程中发生反应为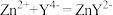 。
。
①“过程X”发生反应的离子方程式为______________________________ ,其平衡常数K为__________ 。
②为了使“过程X”转化完全,可采取的措施为__________ (填1条即可)。
(4) 时,热分解法中硫酸回收率为
时,热分解法中硫酸回收率为__________ (回收率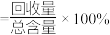 ,列计算式即可)。
,列计算式即可)。
(1)沥青质随温度升高反应产物如图(
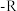 为烷烃基)。
为烷烃基)。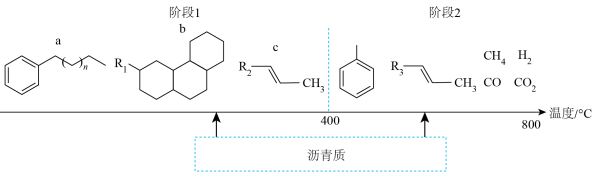
②“阶段2”中发生的主要反应类型为
A.裂化 B.裂解 C.精馏 D.干馏
(2)利用热分解法测定硫酸回收量(以
 、
、 的硫元素含量计)。有关热化学方程式为:
的硫元素含量计)。有关热化学方程式为:反应I:
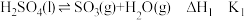
反应Ⅱ:
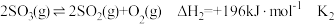
①已知
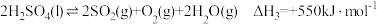 ,则
,则
 。
。②下列能说明在密闭容器中反应Ⅱ达到平衡状态的有
A.
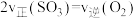 B.
B.
C.混合气体平均相对分子质量不再改变 D.
 的体积分数保持不变
的体积分数保持不变③在压强为p的反应体系中对
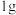 酸渣进行热分解,平衡时体系中
酸渣进行热分解,平衡时体系中 、
、 的气体体积分数和热解气体总体积(已折算为标准状况)随温度变化如图。
的气体体积分数和热解气体总体积(已折算为标准状况)随温度变化如图。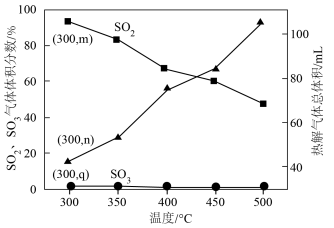

 (选填“>”或“<”),依据是
(选填“>”或“<”),依据是ⅱ.结合平衡移动原理分析,
 气体体积分数随温度变化的原因可能为
气体体积分数随温度变化的原因可能为(3)利用络合滴定法测定
 酸渣中硫酸总含量,进行如下实验。
酸渣中硫酸总含量,进行如下实验。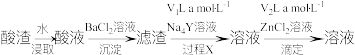
已知:i.
 时,
时,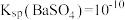 ;
;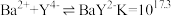 。
。ii.滴定过程中发生反应为
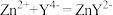 。
。①“过程X”发生反应的离子方程式为
②为了使“过程X”转化完全,可采取的措施为
(4)
 时,热分解法中硫酸回收率为
时,热分解法中硫酸回收率为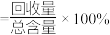 ,列计算式即可)。
,列计算式即可)。
您最近一年使用:0次
解题方法
9 . 空间站内搭载萨巴蒂尔装置将 转化为
转化为 ,再通过电解水装置回收氧元素.其系统原理如图:
,再通过电解水装置回收氧元素.其系统原理如图:
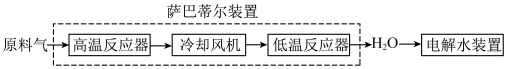
萨巴蒂尔装置内发生反应为
反应Ⅰ: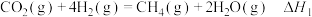
反应Ⅱ: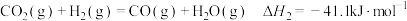
(1)已知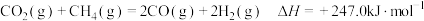 ,则
,则
_________ .
(2)在“高温反应器”中以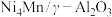 为催化剂,一段时间内不同温度
为催化剂,一段时间内不同温度 转化率如图.已知反应Ⅰ的速率方程:
转化率如图.已知反应Ⅰ的速率方程: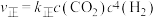 ,
, .
.
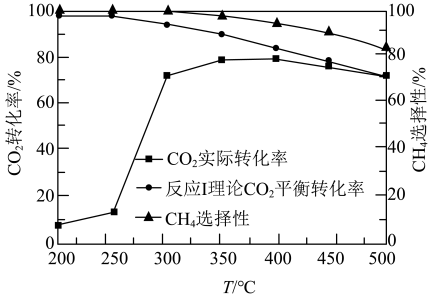
①250℃前, 实际转化率随温度变化不大的主要原因是
实际转化率随温度变化不大的主要原因是___________ .
②300℃时
__________ 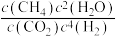 (填“>”“<”或“=”).
(填“>”“<”或“=”).
③达到平衡后,升高温度, 增大的倍数
增大的倍数_________  增大的倍数(填“>”“<”或“=”).
增大的倍数(填“>”“<”或“=”).
(3)在“低温反应器”中达平衡时,各组分物质的量分数随温度变化如图.已知原料气中含有 及
及 .
.
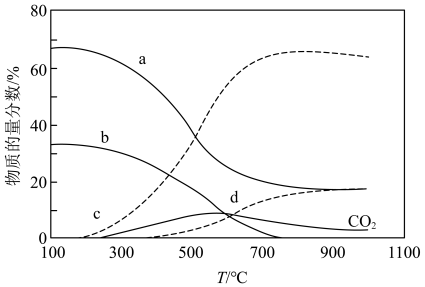
① 物质的量分数随温度变化的曲线为
物质的量分数随温度变化的曲线为____________ (填标号).
②300~500℃, 物质的量分数随温度升高而上升的原因是
物质的量分数随温度升高而上升的原因是___________ .
③某温度下达平衡时,总压为 ,剩余
,剩余 和
和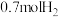 ,则反应Ⅰ的
,则反应Ⅰ的 为
为___________ (列出计算式, 为以分压表示的平衡常数,分压=总压×物质的量分数);
为以分压表示的平衡常数,分压=总压×物质的量分数);
此时氧元素的回收率为____________ [回收率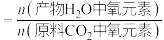 ].
].
(4)从平衡与速率角度分析萨巴蒂尔装置采用高温和低温反应器串联的优点是___________ .
 转化为
转化为 ,再通过电解水装置回收氧元素.其系统原理如图:
,再通过电解水装置回收氧元素.其系统原理如图:
萨巴蒂尔装置内发生反应为
反应Ⅰ:
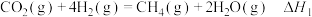
反应Ⅱ:
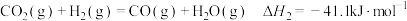
(1)已知
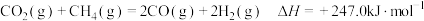 ,则
,则
(2)在“高温反应器”中以
 为催化剂,一段时间内不同温度
为催化剂,一段时间内不同温度 转化率如图.已知反应Ⅰ的速率方程:
转化率如图.已知反应Ⅰ的速率方程: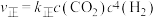 ,
, .
.
①250℃前,
 实际转化率随温度变化不大的主要原因是
实际转化率随温度变化不大的主要原因是②300℃时

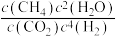 (填“>”“<”或“=”).
(填“>”“<”或“=”).③达到平衡后,升高温度,
 增大的倍数
增大的倍数 增大的倍数(填“>”“<”或“=”).
增大的倍数(填“>”“<”或“=”).(3)在“低温反应器”中达平衡时,各组分物质的量分数随温度变化如图.已知原料气中含有
 及
及 .
.
①
 物质的量分数随温度变化的曲线为
物质的量分数随温度变化的曲线为②300~500℃,
 物质的量分数随温度升高而上升的原因是
物质的量分数随温度升高而上升的原因是③某温度下达平衡时,总压为
 ,剩余
,剩余 和
和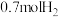 ,则反应Ⅰ的
,则反应Ⅰ的 为
为 为以分压表示的平衡常数,分压=总压×物质的量分数);
为以分压表示的平衡常数,分压=总压×物质的量分数);此时氧元素的回收率为
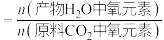 ].
].(4)从平衡与速率角度分析萨巴蒂尔装置采用高温和低温反应器串联的优点是
您最近一年使用:0次
解题方法
10 . 下列物质摩尔燃烧焓数据如下表:
下列表述正确的是
物质 | C(s,石墨) | C(s,金刚石) |
|
|
|
| -393.5 | -395.4 | -285.8 | -283.0 | -890.3 |
A.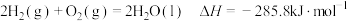 |
B.C(s,石墨)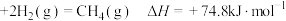 |
C.C(s,石墨)=C(s,金刚石)  |
D.C(s,石墨)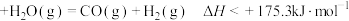 |
您最近一年使用:0次

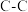



 )
)