1 . 已知:①
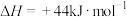
②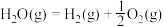
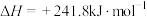
③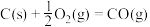
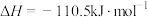
④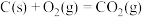
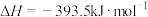
回答下列问题:
(1)上述变化中属于吸热反应的是___________ (填序号)。
(2)写出 燃烧的热化学方程式:
燃烧的热化学方程式:___________ 。
(3)反应 的
的
___________  。
。
(4)相同压强下,质量相等且起始温度相同的两份 与足量的
与足量的 充分反应,分别生成液态水(反应I)和水蒸气(反应Ⅱ),反应I放出的热量
充分反应,分别生成液态水(反应I)和水蒸气(反应Ⅱ),反应I放出的热量___________ (填“>”“<”或“=”)反应Ⅱ放出的热量。
(5)在一定条件下,将 和
和 充入
充入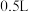 密闭容器中发生反应生成氨气:
密闭容器中发生反应生成氨气: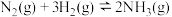 ,达到平衡时
,达到平衡时 的转化率为
的转化率为 ,放出
,放出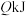 的热量,该反应的平衡常数
的热量,该反应的平衡常数
___________  。写出
。写出 与
与 反应的热化学方程式:
反应的热化学方程式:___________ 。
(6)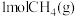 完全燃烧生成气态水的能量变化和
完全燃烧生成气态水的能量变化和 燃烧的能量变化如图所示。在催化剂作用下,
燃烧的能量变化如图所示。在催化剂作用下, 可以还原
可以还原 生成单质
生成单质 、
、 和
和 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:________ 。


②
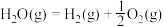
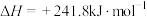
③
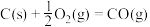
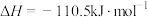
④
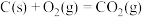
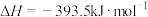
回答下列问题:
(1)上述变化中属于吸热反应的是
(2)写出
 燃烧的热化学方程式:
燃烧的热化学方程式:(3)反应
 的
的
 。
。(4)相同压强下,质量相等且起始温度相同的两份
 与足量的
与足量的 充分反应,分别生成液态水(反应I)和水蒸气(反应Ⅱ),反应I放出的热量
充分反应,分别生成液态水(反应I)和水蒸气(反应Ⅱ),反应I放出的热量(5)在一定条件下,将
 和
和 充入
充入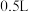 密闭容器中发生反应生成氨气:
密闭容器中发生反应生成氨气: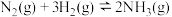 ,达到平衡时
,达到平衡时 的转化率为
的转化率为 ,放出
,放出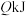 的热量,该反应的平衡常数
的热量,该反应的平衡常数
 。写出
。写出 与
与 反应的热化学方程式:
反应的热化学方程式:(6)
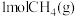 完全燃烧生成气态水的能量变化和
完全燃烧生成气态水的能量变化和 燃烧的能量变化如图所示。在催化剂作用下,
燃烧的能量变化如图所示。在催化剂作用下, 可以还原
可以还原 生成单质
生成单质 、
、 和
和 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:
您最近一年使用:0次
2 .  催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: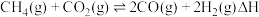 。回答下列问题:
。回答下列问题:
(1)已知相关物质的燃烧热(
 ):
):
则 催化重整反应的
催化重整反应的
_______  。
。
(2)将原料按初始组成
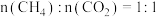 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为
 发生反应。达到平衡时,
发生反应。达到平衡时,
 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
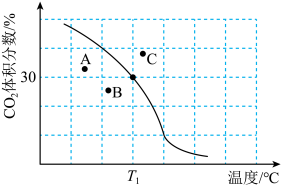
①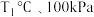 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=_______ 。该温度下,此反应的平衡常数
_______ 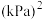 (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
②若A、B、C三点表示不同温度和压强下达到平衡时 的体积分数,则
的体积分数,则_______ 点对应的平衡常数最小,理由是_______ 。
(3)其他条件相同,在不同催化剂(A、B)作用下,反应
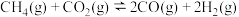 进行相同时间后,
进行相同时间后,
 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。

①在催化剂A、B作用下,它们正、逆反应活化能差值分别用 表示,则
表示,则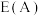
_______ 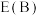 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②y点对应的
_______ z点对应的 。
。
(4) 和
和
 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
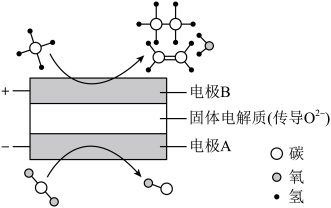
①阴极的电极反应式为_______ 。
②若生成的乙烯和乙烷的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为_______ 。
 催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: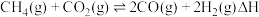 。回答下列问题:
。回答下列问题:(1)已知相关物质的燃烧热(
 ):
):| 物质 | 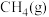 | 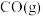 |  |
燃烧热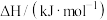 |  |  |  |
 催化重整反应的
催化重整反应的
 。
。(2)将原料按初始组成
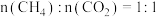 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应。达到平衡时,
发生反应。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
①
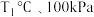 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=
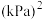 (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。②若A、B、C三点表示不同温度和压强下达到平衡时
 的体积分数,则
的体积分数,则(3)其他条件相同,在不同催化剂(A、B)作用下,反应
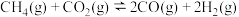 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。
①在催化剂A、B作用下,它们正、逆反应活化能差值分别用
 表示,则
表示,则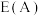
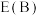 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②y点对应的

 。
。(4)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
①阴极的电极反应式为
②若生成的乙烯和乙烷的体积比为
 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为
您最近一年使用:0次
2023-10-29更新
|
678次组卷
|
4卷引用:广西北海市2024届高三一模考试化学试题
解题方法
3 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
(1)已知: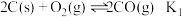

 (其中
(其中 、
、 、
、 为对应化学反应的平衡常数)
为对应化学反应的平衡常数)
①则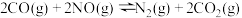 的平衡常数为K,则
的平衡常数为K,则
_______ (用 、
、 、
、 表示)。
表示)。
②在一个恒温恒容的密闭容器中发生反应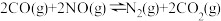 。能表明反应已达到平衡状态的标志有
。能表明反应已达到平衡状态的标志有_______ (填字母)。
A.混合气体的压强保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D.气体的总质量保持不变
E.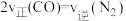 F.
F. 内生成
内生成 同时消耗
同时消耗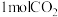
(2)向容积为 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应 ,
, 和
和 的物质的量变化如表所示。
的物质的量变化如表所示。
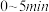 内,以
内,以 表示的平均反应速率
表示的平均反应速率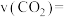
_______ ,最终达平衡时 的浓度
的浓度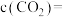
_______ ,平衡时 的转化率
的转化率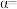
_______ ,写出该反应平衡常数的表达式
_______ ,并求该温度 下的平衡常数
下的平衡常数
_______ 。
(1)已知:
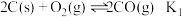

 (其中
(其中 、
、 、
、 为对应化学反应的平衡常数)
为对应化学反应的平衡常数)①则
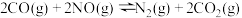 的平衡常数为K,则
的平衡常数为K,则
 、
、 、
、 表示)。
表示)。②在一个恒温恒容的密闭容器中发生反应
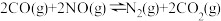 。能表明反应已达到平衡状态的标志有
。能表明反应已达到平衡状态的标志有A.混合气体的压强保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D.气体的总质量保持不变
E.
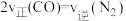 F.
F. 内生成
内生成 同时消耗
同时消耗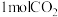
(2)向容积为
 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应 ,
, 和
和 的物质的量变化如表所示。
的物质的量变化如表所示。| 条件 | 保持温度为 | ||||||
时间/ | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
物质的量/ | 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
物质的量/ | 0 | 0.30 | 0.50 | 0.65 | 0.75 | 0.80 | 0.80 |
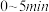 内,以
内,以 表示的平均反应速率
表示的平均反应速率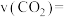
 的浓度
的浓度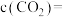
 的转化率
的转化率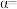

 下的平衡常数
下的平衡常数
您最近一年使用:0次
2023-02-18更新
|
135次组卷
|
3卷引用:广西北海市2022-2023学年高二上学期期末考试化学试题
广西北海市2022-2023学年高二上学期期末考试化学试题福建省福州市三校2022-2023学年高二上学期期中联考化学试题(已下线)专题04 可逆反应、化学平衡状态、化学平衡常数【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
4 . 根据要求,回答下列问题:
(1)已知甲烷的燃烧热为 ,
,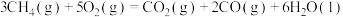
 。写出CO燃烧的热化学方程式:
。写出CO燃烧的热化学方程式:_______ ,若 、
、 键的键能分别为
键的键能分别为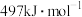 、
、 ,则使1molCO转化为相应的原子时需要的能量是
,则使1molCO转化为相应的原子时需要的能量是_______ ;1mol 按上述方式燃烧时损失的热能是
按上述方式燃烧时损失的热能是_______ (保留1位小数)。
(2)煤的气化反应之一为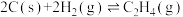

已知:①

②
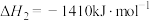
③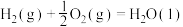

则上述煤的生成 的气化反应的
的气化反应的
_______ 。实际生产中该气化反应需要加入催化剂,其主要原因是_______ (填“速率问题”或“平衡问题”)。
(1)已知甲烷的燃烧热为
 ,
,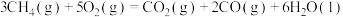
 。写出CO燃烧的热化学方程式:
。写出CO燃烧的热化学方程式: 、
、 键的键能分别为
键的键能分别为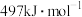 、
、 ,则使1molCO转化为相应的原子时需要的能量是
,则使1molCO转化为相应的原子时需要的能量是 按上述方式燃烧时损失的热能是
按上述方式燃烧时损失的热能是(2)煤的气化反应之一为
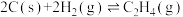

已知:①


②

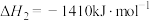
③
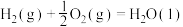

则上述煤的生成
 的气化反应的
的气化反应的
您最近一年使用:0次
2022-12-13更新
|
210次组卷
|
2卷引用:广西北海市2022-2023学年高二上学期期末考试化学试题
5 . 在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:
(1)已知:
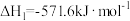

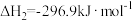
则H2(g)还原烟气中的SO2(g)的热化学方程式为___________ 。
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应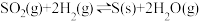
 。
。
①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=___________ mol/(L·s),平衡时,c(SO2)=___________ mol/L;若平衡后升高温度,SO2的转化率将___________ (填“增 大”“减小”或“不变”)。
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=___________ L/mol;平衡状态由A变到B,平衡常数K(A) ___________ (填“>”“<”或“=”)K(B)。
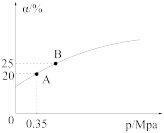
③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是___________ (填标号)。
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
(1)已知:

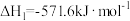

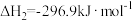
则H2(g)还原烟气中的SO2(g)的热化学方程式为
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应
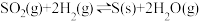
 。
。①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=

③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
您最近一年使用:0次
2021-11-02更新
|
551次组卷
|
4卷引用:广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题
名校
解题方法
6 . 二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)利用水煤气合成二甲醚的总反应为:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH=-246.4kJ·mol-1
CH3OCH3(g)+CO2(g);ΔH=-246.4kJ·mol-1
它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g),ΔH1=-205.1kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g);ΔH2=__ 。
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO转化率的是__ (填字母代号)。
a.降低温度 B.加入催化剂 c.缩小容器体积 D.增加H2的浓度 e.增加CO的浓度
(3)在一体积可变的密闭容器中充入3molH2、3molCO、1molCH3OCH3、1molCO2,在一定温度和压强下发生反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
问:①反应开始时正、逆反应速率的大小:v(正)__ (填“>”、“<”或“=”)v(逆)。
②平衡时n(CH3OCH3)=__ ,平衡时CO的转化率=__ 。
(1)利用水煤气合成二甲醚的总反应为:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g);ΔH=-246.4kJ·mol-1
CH3OCH3(g)+CO2(g);ΔH=-246.4kJ·mol-1它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g),ΔH1=-205.1kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g);ΔH2=
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO转化率的是
a.降低温度 B.加入催化剂 c.缩小容器体积 D.增加H2的浓度 e.增加CO的浓度
(3)在一体积可变的密闭容器中充入3molH2、3molCO、1molCH3OCH3、1molCO2,在一定温度和压强下发生反应:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:①反应开始时正、逆反应速率的大小:v(正)
②平衡时n(CH3OCH3)=
您最近一年使用:0次
2020-10-29更新
|
636次组卷
|
3卷引用:广西北海市北海中学2019-2020学年高二上学期期中考试化学试题
名校
7 . 钛被称为“第三金属”,其制取原料为金红石( ),制取步骤如下:
),制取步骤如下:
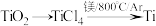
已知:①
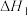
②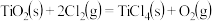
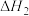
则反应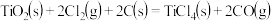 的ΔH为
的ΔH为
 ),制取步骤如下:
),制取步骤如下: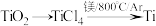
已知:①

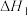
②
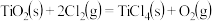
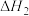
则反应
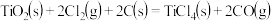 的ΔH为
的ΔH为| A.2ΔH1+2ΔH2 | B.2ΔH1+ΔH2 |
| C.2ΔH1-ΔH2 | D.2ΔH1-2ΔH2 |
您最近一年使用:0次
2020-09-21更新
|
590次组卷
|
5卷引用:广西壮族自治区北海市2019-2020学年高二下学期期末教学质量检测化学试题
名校
解题方法
8 . 碳是形成化合物种类最多的元素,其单质和化合物是人类生活的主要能源物质。
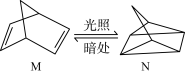
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH =+88.6 kJ·mol-1,则M、N相比,较稳定的是__________
(2)根据下列热化学方程式分析,C(s)的燃烧热△H等于_____________ (用△H1 、△H2、△H3表示)
C(s)+H2O(l)=CO(g)+H2(g); △H1
2CO(g)+O2(g)=2CO2(g); △H2
2H2(g)+O2(g)=2H2O(l); △H3
(3)根据键能数据估算CH4(g)+4F2(g)= CF4(g)+4HF(g)的反应热ΔH=________
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH =+88.6 kJ·mol-1,则M、N相比,较稳定的是

(2)根据下列热化学方程式分析,C(s)的燃烧热△H等于
C(s)+H2O(l)=CO(g)+H2(g); △H1
2CO(g)+O2(g)=2CO2(g); △H2
2H2(g)+O2(g)=2H2O(l); △H3
(3)根据键能数据估算CH4(g)+4F2(g)= CF4(g)+4HF(g)的反应热ΔH=
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:
您最近一年使用:0次



