名校
1 . 完成下列问题
(1)已知:①

②

则

___________ 。
(2)已知:①

②

则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(3)已知几种化学键的键能和热化学方程式如下:

 ,则a=
,则a=___________ 。
(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷( )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是___________ ;反应 (l)=
(l)= (l)的
(l)的
___________ 。

(1)已知:①


②


则


(2)已知:①


②


则表示氨气燃烧热的热化学方程式为
(3)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能/( ) ) | 391 | 193 | 243 | a | 432 |

 ,则a=
,则a=(4)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是
)的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是 (l)=
(l)= (l)的
(l)的

您最近一年使用:0次
名校
解题方法
2 . 载人飞船中通过如下过程实现 再生:
再生:
①
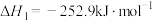
②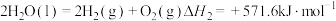
下列说法错误的是
 再生:
再生:①

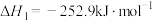
②
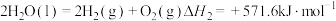
下列说法错误的是
A. 的燃烧热 的燃烧热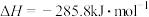 |
B.反应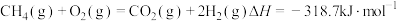 |
C.反应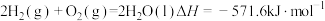 |
D.反应 |
您最近一年使用:0次
3 . 甲醇和水蒸气催化重整制取氢气的原理为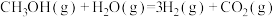 .重整过程中的主要反应为:
.重整过程中的主要反应为:
反应1: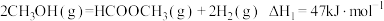
反应2: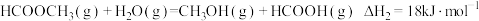
反应3: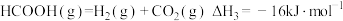
(1)反应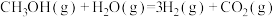 的
的
______________ .
(2)在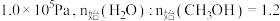 时,密闭容器中发生反应1、2、3.随温度的升高,平衡时容器中
时,密闭容器中发生反应1、2、3.随温度的升高,平衡时容器中 的浓度先增大后减小.过程中
的浓度先增大后减小.过程中 浓度减小的原因是
浓度减小的原因是______________ .
(3)选择膜反应器可提高重整效率.膜反应器中金属膜允许 通过,而
通过,而 气体等不能通过.膜反应器的作用是
气体等不能通过.膜反应器的作用是______________ .
(4)在 催化剂表面上甲醇与水蒸气重整的机理如图所示.
催化剂表面上甲醇与水蒸气重整的机理如图所示.
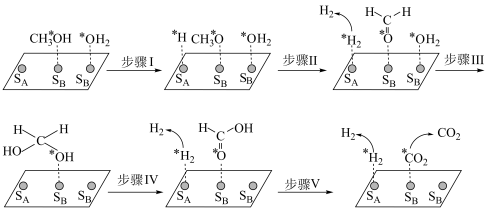
其中“*”表示该微粒吸附在催化剂表面, 为带有一定电性的吸附位点.
为带有一定电性的吸附位点. 表示微粒从催化剂表面脱附.
表示微粒从催化剂表面脱附.
①用 替换
替换 ,生成氢气的化学式是
,生成氢气的化学式是______________ .
②从电负性的角度分析,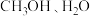 均通过
均通过 原子吸附在催化剂
原子吸附在催化剂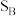 位点上的原因是
位点上的原因是______________ .
③从化学键断裂和形成以及微粒吸附与脱附的角度,步骤Ⅳ的反应过程可描述为______________ .
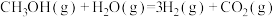 .重整过程中的主要反应为:
.重整过程中的主要反应为:反应1:
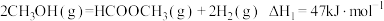
反应2:
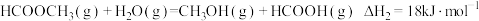
反应3:
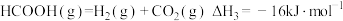
(1)反应
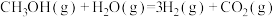 的
的
(2)在
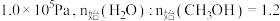 时,密闭容器中发生反应1、2、3.随温度的升高,平衡时容器中
时,密闭容器中发生反应1、2、3.随温度的升高,平衡时容器中 的浓度先增大后减小.过程中
的浓度先增大后减小.过程中 浓度减小的原因是
浓度减小的原因是(3)选择膜反应器可提高重整效率.膜反应器中金属膜允许
 通过,而
通过,而 气体等不能通过.膜反应器的作用是
气体等不能通过.膜反应器的作用是(4)在
 催化剂表面上甲醇与水蒸气重整的机理如图所示.
催化剂表面上甲醇与水蒸气重整的机理如图所示.
其中“*”表示该微粒吸附在催化剂表面,
 为带有一定电性的吸附位点.
为带有一定电性的吸附位点. 表示微粒从催化剂表面脱附.
表示微粒从催化剂表面脱附. ①用
 替换
替换 ,生成氢气的化学式是
,生成氢气的化学式是②从电负性的角度分析,
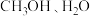 均通过
均通过 原子吸附在催化剂
原子吸附在催化剂 位点上的原因是
位点上的原因是③从化学键断裂和形成以及微粒吸附与脱附的角度,步骤Ⅳ的反应过程可描述为
您最近一年使用:0次
4 . 捕集并转化CO2可以有效实现碳达峰、碳中和。
Ⅰ.工业上利用两种温室气体CH4和CO2催化重整制取H2和CO,主要反应为:
反应①:
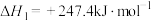
过程中还发生三个副反应:
反应②:

反应③: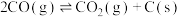
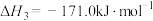
反应④: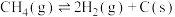 △H4
△H4
将CH4与CO2(体积比为1∶1)的混合气体以一定流速通过催化剂,产物中H2与CO的物质的量之比、CO2的转化率与温度的关系如图所示:
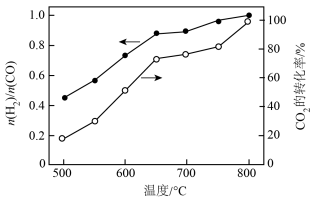
(1)△H4=___________ kJ·mol-1。
(2)500℃时, 比较小,此时发生的副反应以
比较小,此时发生的副反应以___________ (选填②、③、④中一种)为主。升高温度,产物中H2与CO的物质的量之比增大的原因是___________ 。
Ⅱ.光催化CH4和CO2生成CO和H2催化反应机理如图所示:
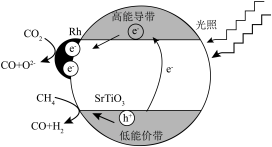
(3)上述反应机理中表现出氧化性的粒子有___________ 。
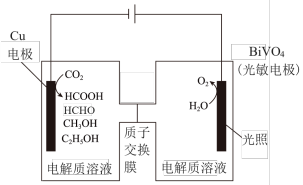
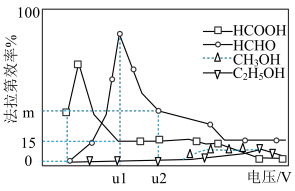
Ⅲ.用光电化学法将CO2还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如右图所示:
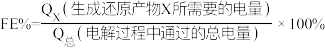 ,其中,Qx=nF,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
,其中,Qx=nF,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
(4)当电解电压为u1V时,阴极生成HCHO的电极反应式为___________ 。
(5)当电解电压为u2V时,电解生成的HCOOH和HCHO的物质的量之比为5:6,生成HCHO的法拉第效率m为___________ 。
Ⅰ.工业上利用两种温室气体CH4和CO2催化重整制取H2和CO,主要反应为:
反应①:

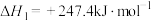
过程中还发生三个副反应:
反应②:


反应③:
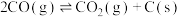
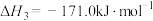
反应④:
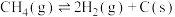 △H4
△H4将CH4与CO2(体积比为1∶1)的混合气体以一定流速通过催化剂,产物中H2与CO的物质的量之比、CO2的转化率与温度的关系如图所示:

(1)△H4=
(2)500℃时,
 比较小,此时发生的副反应以
比较小,此时发生的副反应以Ⅱ.光催化CH4和CO2生成CO和H2催化反应机理如图所示:

(3)上述反应机理中表现出氧化性的粒子有
Ⅲ.用光电化学法将CO2还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如右图所示:


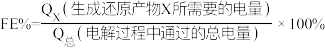 ,其中,Qx=nF,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
,其中,Qx=nF,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。(4)当电解电压为u1V时,阴极生成HCHO的电极反应式为
(5)当电解电压为u2V时,电解生成的HCOOH和HCHO的物质的量之比为5:6,生成HCHO的法拉第效率m为
您最近一年使用:0次
解题方法
5 . 碳中和作为一种新型环保形式,目前已经被越来越多的大型活动和会议采用。回答下列有关问题:
(1)利用 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。
工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:
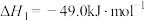
Ⅱ.逆水汽变换:
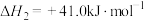
Ⅲ.甲醇脱水:

工艺2:利用 直接加氢合成
直接加氢合成 (反应Ⅳ)
(反应Ⅳ)
①据上述信息可知反应Ⅳ的热化学方程式为___________ ,反应Ⅰ低温___________ 自发进行(填“能”、“不能”)。
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是___________ 。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内 浓度保持不变
浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)工艺1需先合成甲醇。在不同压强下,按照 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图甲、乙所示。
的平衡产率随温度的变化关系如下图甲、乙所示。
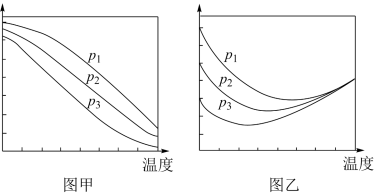
①下列说法正确的是___________ 。
A.图甲纵坐标表示 的平衡产率
的平衡产率
B.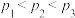
C.为了同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件
D.一定温度压强下,提高 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是___________ 。
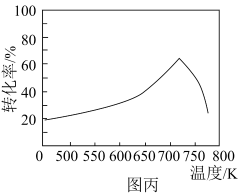
(3)对于合成甲醇的反应:
 ,一定条件下,单位时间内不同温度下测定的
,一定条件下,单位时间内不同温度下测定的 转化率如图丙所示。温度高于
转化率如图丙所示。温度高于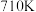 时,随温度的升高
时,随温度的升高 转化率降低的原因可能是
转化率降低的原因可能是___________ 。
(4) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
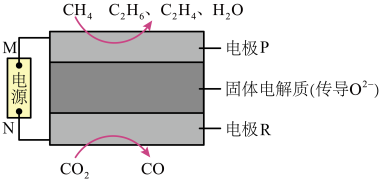
图丁
①电极M为电源的___________ 极;
②电极R上发生的电极反应为___________ 。
(1)利用
 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:

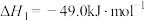
Ⅱ.逆水汽变换:

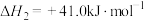
Ⅲ.甲醇脱水:


工艺2:利用
 直接加氢合成
直接加氢合成 (反应Ⅳ)
(反应Ⅳ)①据上述信息可知反应Ⅳ的热化学方程式为
②恒温恒容情况下,下列说法能判断反应Ⅳ达到平衡的是
A.气体物质中碳元素与氧元素的质量比不变
B.容器内
 浓度保持不变
浓度保持不变C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)工艺1需先合成甲醇。在不同压强下,按照
 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图甲、乙所示。
的平衡产率随温度的变化关系如下图甲、乙所示。
①下列说法正确的是
A.图甲纵坐标表示
 的平衡产率
的平衡产率B.
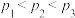
C.为了同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件D.一定温度压强下,提高
 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂②图乙中,某温度时,三条曲线几乎交于一点的原因是
(3)对于合成甲醇的反应:

 ,一定条件下,单位时间内不同温度下测定的
,一定条件下,单位时间内不同温度下测定的 转化率如图丙所示。温度高于
转化率如图丙所示。温度高于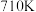 时,随温度的升高
时,随温度的升高 转化率降低的原因可能是
转化率降低的原因可能是
(4)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
图丁
①电极M为电源的
②电极R上发生的电极反应为
您最近一年使用:0次
名校
6 . NO催化 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:
第1步:
 ;
;
第2步: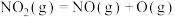
 ;
;
第3步:

 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:第1步:

 ;
;第2步:
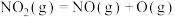
 ;
;第3步:


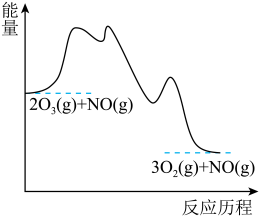
| A.第2步是总反应的决速步 |
| B.三步基元反应都是放热反应 |
| C.该过程共有两种中间产物 |
D.总反应 的焓变为 的焓变为 |
您最近一年使用:0次
2023-07-31更新
|
473次组卷
|
7卷引用:江苏省淮安市2022-2023学年高二上学期期末考试化学试题
江苏省淮安市2022-2023学年高二上学期期末考试化学试题(已下线)专题07 化学能与热能、电能-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)江苏省苏州震泽中学2023~2024学年高二上学期10月月考化学试题江苏省苏州市吴江市高级中学2023-2024学年高二上学期10月月考化学试题福建省莆田第七中学、第十一中学、第十五中学等校2023-2024学年高二上学期期末联考化学试题福建省福州高新区第一中学(闽侯县第三中学)2023-2024学年高二上学期12月月考化学试题福建省福州市闽 闽侯县第一中学2023-2024学年高二上学期12月月考化学试题
7 . CO2循环再利用制备甲烷、甲醇等有机燃料,变废为宝历来是化学重要的研究领域。为了减少CO2的排放,可用下列方法把CO2转化成燃料,试回答下列问题:
反应I:

反应II:
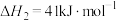
反应III:

(1)计算可知
___________  。
。
(2)某温度下,在固定容积为2.0L的密闭容器中充入0.8mol的CO2和2.4mol的H2,按反应I进行反应,测得CO2和CH3OH的物质的量随时间变化如图1:

①0~2min内,用CH3OH表示的反应速率为___________ ,该反应达到最大限度时H2的转化率为___________ ,此时CH3OH在平衡混合物中的体积分数为___________ 。
②下列措施可以提高该化学反应速率的是___________ (填选项序号)。
A.升高温度 B.容器体积不变,充入He
C.增大容器的体积 D.容器体积不变,充入更多的H2(g)
③下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO2与CH3OH的物质的量之比为1:1
B.
C.混合气体的压强不随时间的变化而变化
D.混合气体的密度不再改变
(3)H2还原CO电化学法制备甲醇(见反应III)的工作原理如图2所示:电池工作过程中H+通过质子膜向___________ (填“左”或者“右”)移动,通入CO的一端发生的电极反应式为___________ 。

反应I:


反应II:

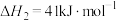
反应III:


(1)计算可知

 。
。(2)某温度下,在固定容积为2.0L的密闭容器中充入0.8mol的CO2和2.4mol的H2,按反应I进行反应,测得CO2和CH3OH的物质的量随时间变化如图1:

①0~2min内,用CH3OH表示的反应速率为
②下列措施可以提高该化学反应速率的是
A.升高温度 B.容器体积不变,充入He
C.增大容器的体积 D.容器体积不变,充入更多的H2(g)
③下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量之比为1:1
B.

C.混合气体的压强不随时间的变化而变化
D.混合气体的密度不再改变
(3)H2还原CO电化学法制备甲醇(见反应III)的工作原理如图2所示:电池工作过程中H+通过质子膜向

您最近一年使用:0次
8 . 氢能是一种绿色能源,目前有多种方法可以制氢或储氢。
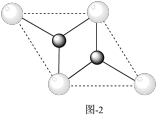
(1) 基催化剂可用于甲烷水蒸气重整制氢,反应过程如图1。
基催化剂可用于甲烷水蒸气重整制氢,反应过程如图1。
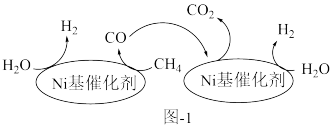
①由如图1可知,该制氢的过程用文字描述为___________ 。
②Pistonesi等对反应过程提出了以下反应机理,写出Ⅱ的转化过程。
I. Ⅱ.
Ⅱ.___________
Ⅲ.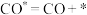 Ⅳ.
Ⅳ.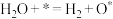
V. Ⅵ.
Ⅵ.
注:*表示催化剂或者微粒吸附在催化剂上。
(2)镁铝合金 是一种潜在的贮氢材料。
是一种潜在的贮氢材料。
①该合金在一定条件下完全吸氢生成 中
中 的化合价为
的化合价为___________ 。
② 是一种单层的二维材料,二维晶胞如图2所示,虚线之间夹角为
是一种单层的二维材料,二维晶胞如图2所示,虚线之间夹角为 或
或 ,距离每个○距离最近的
,距离每个○距离最近的 有
有___________ 个。
(3)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: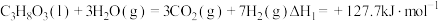
反应Ⅱ: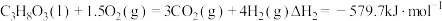
①
___________ 。
②反应I、Ⅱ消耗的 总量一定时,反应Ⅱ的比例过多、过少都不利于制氢,原因是
总量一定时,反应Ⅱ的比例过多、过少都不利于制氢,原因是___________ 。
③除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最要抑制
等副产物,为了提高原子利用率,最要抑制 的生成,原因是
的生成,原因是___________ 。
(1)
 基催化剂可用于甲烷水蒸气重整制氢,反应过程如图1。
基催化剂可用于甲烷水蒸气重整制氢,反应过程如图1。
①由如图1可知,该制氢的过程用文字描述为
②Pistonesi等对反应过程提出了以下反应机理,写出Ⅱ的转化过程。
I.
 Ⅱ.
Ⅱ.Ⅲ.
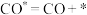 Ⅳ.
Ⅳ.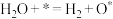
V.
 Ⅵ.
Ⅵ.
注:*表示催化剂或者微粒吸附在催化剂上。
(2)镁铝合金
 是一种潜在的贮氢材料。
是一种潜在的贮氢材料。①该合金在一定条件下完全吸氢生成
 中
中 的化合价为
的化合价为②
 是一种单层的二维材料,二维晶胞如图2所示,虚线之间夹角为
是一种单层的二维材料,二维晶胞如图2所示,虚线之间夹角为 或
或 ,距离每个○距离最近的
,距离每个○距离最近的 有
有
(3)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
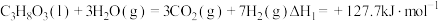
反应Ⅱ:
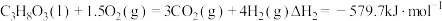
①

②反应I、Ⅱ消耗的
 总量一定时,反应Ⅱ的比例过多、过少都不利于制氢,原因是
总量一定时,反应Ⅱ的比例过多、过少都不利于制氢,原因是③除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最要抑制
等副产物,为了提高原子利用率,最要抑制 的生成,原因是
的生成,原因是
您最近一年使用:0次
解题方法
9 . 回收利用含硫烟气有利于节约资源、保护环境。
Ⅰ.含 的烟气回收
的烟气回收
(1)将一部分含 的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(
的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺( )。该工艺中涉及反应如下:
)。该工艺中涉及反应如下:
反应1: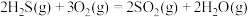 ;
;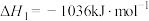
反应2: ;
;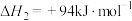
反应3: ;
;
①反应 的
的
_______  。
。
②相同条件下需控制反应1与反应2中的烟气体积比为 的原因是
的原因是_______ 。
Ⅱ.含 的烟气回收
的烟气回收
(2)以 为催化剂,用
为催化剂,用 还原
还原 制S。其他条件一定,改变起始时
制S。其他条件一定,改变起始时 与
与 的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃,
的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃, 时硫的产率比
时硫的产率比 时小的原因可能是
时小的原因可能是_______ 。

(3)以 炭基材料为催化剂,
炭基材料为催化剂, 在炭表面被氧气催化氧化为
在炭表面被氧气催化氧化为 ,
, 再转化为硫酸盐等。
再转化为硫酸盐等。
① 炭基材料脱硫涉及反应:
炭基材料脱硫涉及反应: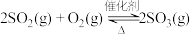 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是_______ (填字母序号)
a.通入过量空气,可提高 的平衡转化率
的平衡转化率
b.当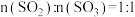 时,可判断反应达到平衡
时,可判断反应达到平衡
c.使 液化从平衡体系中分离,能加快正反应速率,增大
液化从平衡体系中分离,能加快正反应速率,增大 转化率
转化率
②450℃、在 催化下,
催化下, 和
和 的反应过程是按照如下两步完成的:
的反应过程是按照如下两步完成的:
反应Ⅰ:_______(快反应)
反应Ⅱ: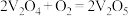 (慢反应)
(慢反应)
请补充上述反应Ⅰ的化学方程式_______ ,决定总反应速率快慢的是反应_______ (填“Ⅰ”或“Ⅱ”)。
Ⅰ.含
 的烟气回收
的烟气回收(1)将一部分含
 的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(
的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺( )。该工艺中涉及反应如下:
)。该工艺中涉及反应如下:反应1:
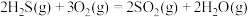 ;
;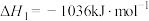
反应2:
 ;
;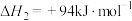
反应3:
 ;
;
①反应
 的
的
 。
。②相同条件下需控制反应1与反应2中的烟气体积比为
 的原因是
的原因是Ⅱ.含
 的烟气回收
的烟气回收(2)以
 为催化剂,用
为催化剂,用 还原
还原 制S。其他条件一定,改变起始时
制S。其他条件一定,改变起始时 与
与 的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃,
的比例,反应相同时间,测得S的产率随温度的变化关系如图所示。500℃, 时硫的产率比
时硫的产率比 时小的原因可能是
时小的原因可能是
(3)以
 炭基材料为催化剂,
炭基材料为催化剂, 在炭表面被氧气催化氧化为
在炭表面被氧气催化氧化为 ,
, 再转化为硫酸盐等。
再转化为硫酸盐等。①
 炭基材料脱硫涉及反应:
炭基材料脱硫涉及反应: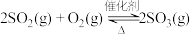 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是a.通入过量空气,可提高
 的平衡转化率
的平衡转化率b.当
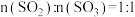 时,可判断反应达到平衡
时,可判断反应达到平衡c.使
 液化从平衡体系中分离,能加快正反应速率,增大
液化从平衡体系中分离,能加快正反应速率,增大 转化率
转化率②450℃、在
 催化下,
催化下, 和
和 的反应过程是按照如下两步完成的:
的反应过程是按照如下两步完成的:反应Ⅰ:_______(快反应)
反应Ⅱ:
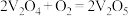 (慢反应)
(慢反应)请补充上述反应Ⅰ的化学方程式
您最近一年使用:0次
解题方法
10 . 通过反应Ⅰ:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g),可将有机氯化工业的副产品HCl转化为Cl2。在0.2MPa、反应物起始物质的量比 =2条件下,不同温度时HCl转化率如图所示(图中虚线表示相同条件下HCl的平衡转化率随温度的变化)。向反应体系中加入CuCl2,能加快反应速率。
=2条件下,不同温度时HCl转化率如图所示(图中虚线表示相同条件下HCl的平衡转化率随温度的变化)。向反应体系中加入CuCl2,能加快反应速率。
反应Ⅱ:2CuCl2(s)+O2(g)=2CuO(s)+2Cl2(g) △H=125.6kJ•mol-1
反应Ⅲ:CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H=-120.0kJ•mol-1

下列说法正确的是
 =2条件下,不同温度时HCl转化率如图所示(图中虚线表示相同条件下HCl的平衡转化率随温度的变化)。向反应体系中加入CuCl2,能加快反应速率。
=2条件下,不同温度时HCl转化率如图所示(图中虚线表示相同条件下HCl的平衡转化率随温度的变化)。向反应体系中加入CuCl2,能加快反应速率。反应Ⅱ:2CuCl2(s)+O2(g)=2CuO(s)+2Cl2(g) △H=125.6kJ•mol-1
反应Ⅲ:CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H=-120.0kJ•mol-1

下列说法正确的是
| A.反应Ⅰ的△H=5.6kJ•mol-1 |
| B.230至300℃时,HCl转化率降低是因为温度升高,平衡向逆反应方向移动 |
| C.保持其他条件不变,400℃时,使用CuCl2,能使HCl转化率从X点的值升至Y点的值 |
D.在0.2MPa、400℃条件下,若起始 <2条件下,HCl的转化率可能达到Y点的值 <2条件下,HCl的转化率可能达到Y点的值 |
您最近一年使用:0次



