1 . 二氧化碳加氢制甲烷过程中的主要反应为

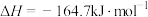

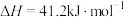
在密闭容器中, 、
、 时,
时, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率随温度的变化如题图所示。
实际转化率随温度的变化如题图所示。 的选择性可表示为
的选择性可表示为 。下列说法正确的是
。下列说法正确的是

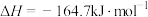

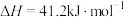
在密闭容器中,
 、
、 时,
时, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率随温度的变化如题图所示。
实际转化率随温度的变化如题图所示。 的选择性可表示为
的选择性可表示为 。下列说法正确的是
。下列说法正确的是
A.反应 的焓变 的焓变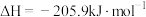 |
B. 的平衡选择性随着温度的升高而增加 的平衡选择性随着温度的升高而增加 |
| C.用该催化剂催化二氧化碳反应的最佳温度范围约为480~530℃ |
D.450℃时,提高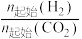 的值或增大压强,均能使 的值或增大压强,均能使 平衡转化率达到X点的值 平衡转化率达到X点的值 |
您最近一年使用:0次
2023-08-07更新
|
6836次组卷
|
13卷引用:2023年高考江苏卷化学真题
2023年高考江苏卷化学真题(已下线)选择题11-13江苏省扬州大学附属中学2023-2024学年高二上学期12月月考化学试题江苏省南通市海安市实验中学2023-2024学年高二上学期12月月考化学试题(已下线)江苏省南京师范大学附属中学2024届高三下学期三模考试化学试题(已下线)第28讲化化学平衡的移动及反应进行的方向河南省宜阳县第一高级中学2023-2024学年高二上学期能力达标测试化学试题北京市首都师范大学附属中学2023-2024学年高三上学期12月阶段练习化学试题安徽省淮南第二中学2024届高三上学期第四次段考化学试题(已下线)专题01 化学反应的热效应-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题03 化学平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)FHgkyldyjhx08
2 . 通过以下反应可获得新型能源二甲醚( )。下列说法不正确的是
)。下列说法不正确的是
①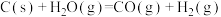
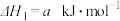
②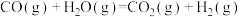
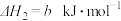
③
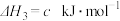
④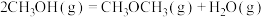
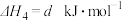
 )。下列说法不正确的是
)。下列说法不正确的是①
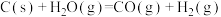
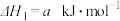
②
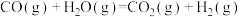
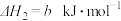
③

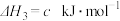
④
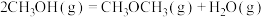
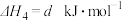
| A.反应①②为反应③提供原料气 |
B.反应③也是 资源化利用的方法之一 资源化利用的方法之一 |
C.反应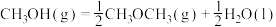 的 的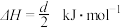 |
D.反应 的 的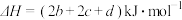 |
您最近一年使用:0次
2021-08-07更新
|
4465次组卷
|
90卷引用:2017年全国普通高等学校招生统一考试化学(江苏卷精编版)
2017年全国普通高等学校招生统一考试化学(江苏卷精编版)江苏省海安高级中学2018届高三1月月考化学试题江苏省泰州中学2018届高三3月月度检测(二模模拟)化学试题江苏省苏北县2019-2020学年高二上学期学情调研化学(选择考)试题江苏省南通市海安县2020-2021学年高二上学期第一次月考化学试题江苏省泰州中学2020-2021学年高二上学期第一次月度质量检测化学试题江苏省华东师范大学盐城实验中学2021-2022学年高二上学期第一次月考化学试题 江苏省扬州中学2021-2022学年高二上学期10月阶段检测化学试题江苏省连云港市厉庄高级中学2022-2023学年高三上学期第一次质量检测化学试题江苏省苏州市工业园区三校20232024学年高二上学期10月联考化学试题河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题山东省济宁市2016-2017学年高二下学期期末考试化学试题湖南省长郡中学2017-2018学年高二上学期第一次模块检测化学试题1安徽师范大学附属中学2017-2018学年高二上学期10月月考化学试题河南省郑州市第一中学2017-2018学年高二上学期期中考试化学试题(已下线)二轮复习测试专项 专题07 化学反应与能量变化(已下线)【中等生百日捷进提升系列-技能方法】专题13 化学反应与能量类选择题解题方法和策略(已下线)《考前20天终极攻略》-5月24日 盖斯定律及反应热的有关计算(已下线)解密08 化学反应与热能(教师版)——备战2018年高考化学之高频考点解密四川省遂宁市射洪县2017-2018学年高二上学期期末统考实验小班加试化学试题辽宁省实验中学2017-2018学年高二上学期期中考试化学试题河南省周口市中英文学校2018-2019学年高二上学期第一次月考化学试题(已下线)2018年10月21日 《每日一题》人教选修4-每周一测【全国百强校】四川省彭州中学2018-2019学年高二上学期10月月考化学试题【全国百强校】吉林省实验中学2018-2019学年高二上学期期中考试化学试题【全国百强校】陕西省西安市长安区第一中学2018-2019学年高二(实验班)上学期期中考试化学试题【全国百强校】陕西省宝鸡中学2019届高三上学期11月模拟考试(二)化学试题【全国百强校】湖南省衡阳市第八中学2018-2019学年高二上学期六科联赛试题(12月)化学试题安徽省新城高升学校2018-2019学年高二上学期期中考试化学试题福建省泉州市泉港区第一中学2019届高三上学期第二次月考化学试题(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点(已下线)2019年高考总复习巅峰冲刺-专题05 化学反应中的能量变化应试策略广东省-北京师范大学东莞石竹附属学校2019-2020学年高二10月月考化学试题江西省南昌市八一中学、洪都中学、十七中三校2019-2020学年高二10月联考化学试题浙江省嘉兴市第一中学2020届高三上学期期中考试化学试题河南省南阳市南阳一中2019-2020学年高二上期第三次月考化学试题北京市2019—2020学年高二上学期期末考试模拟试题(选修4人教版 )福建省莆田九中2019-2020学年高二上学期期中考试化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)专题九 化学能与热能(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训北京市顺义牛栏山第一中学2020届高三下学期模拟考试化学试题河北省衡水中学2020届高三四月份质量监测理综化学试题湖南省长沙市礼雅中学2020届高三下学期三月份网络教学质量监测理科综合化学试题北京市顺义牛栏山第一中学2020届高三3月高考适应性测试化学试题北京市中国人民大学附属中学2020届高三教学质量监测理科综合化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分云南省昆明市寻甸县民族中学2019-2020学年高二下学期第一次月考化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测高中必刷题高二选择性必修1第一章 化学反应的热效应 第一章素养检测(已下线)1.3.1+盖斯定律-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)1.3.2+反应热的计算-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)浙江省富阳中学2020-2021学年高二上学期第一次月考化学试题河南省周口市中英文学校2020-2021学年高二上学期第一次月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 过高考 3年真题强化闯关(已下线)【浙江新东方】42.浙江省杭州学军中学2021届高三上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高三上】【期中】【HD-LP423】【化学】陕西省西安市长安区第一中学2020-2021学年高二上学期第一次教学质量检测化学试题(已下线)【浙江新东方】120(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)山西省实验中学2019届高三上学期第四次月考化学试题高中化学苏教2019版必修第二册-专题6 第二单元综合拔高练湖南省邵阳市邵东创新实验学校2020-2021学年高二上学期期末考试化学(选考)试题(已下线)【浙江新东方】高中化学20210513-015【2021】【高三下】(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)选择性必修1 专题1 素养检测(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)安徽省蚌埠第三中学2021-2022学年高二上学期10月教学质量检测化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题辽宁省沈阳市东北育才双语学校2021-2022学年高二上学期期中考试化学试题(已下线)专题7 盖斯定律专练(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第03讲 盖斯定律(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)第04讲 第一章《化学反应的热效应》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)黑龙江省伊春市伊美区第二中学2022-2023学年高二上学期开学考试化学试题 江西省丰城市第九中学2021-2022学年高二上学期第二次月考(日新班)化学试题陕西省延安市第一中学2021-2022学年高一下学期期中考试化学试题(已下线)热点情景汇编-专题六 化学反应中的热能福建省泉州第一中学2022-2023学年高三上学期12月月考化学试题湖南省临湘市第五中学2021-2022学年高二上学期第三次月考化学试题广东省广州市第八十九中学2022-2023学年高二上学期期末考试化学试题河南省南阳市2023-2024学年高二上学期10月月考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期第一次半月考化学试题四川省内江市第六中学20223-2024学年高二上学期第一次月考化学试题 广西钦州市第四中学2023-2024学年高二上学期9月考试化学试卷陕西省西安市蓝田县乡镇学校联考2023-2024学年高二上学期1月期末化学试题
3 . 通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g)=CO(g)+ H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g)=CO(g)+ H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
| A.反应①中电能转化为化学能 |
| B.反应②为放热反应 |
| C.反应③使用催化剂,ΔH3减小 |
| D.反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8 kJ·mol-1 |
您最近一年使用:0次
2020-09-02更新
|
3815次组卷
|
106卷引用:2016年全国普通高等学校招生统一考试化学(江苏卷精编版)
2016年全国普通高等学校招生统一考试化学(江苏卷精编版)2016年全国普通高等学校招生统一考试化学(江苏卷参考版)2016-2017学年江苏省扬州中学高二12月月考化学卷江苏省徐州市2016-2017学年高二下学期期中考试化学试题2018版化学(苏教版)高考总复习专题六对接高考精练--化学反应的热效应江苏省扬州市江都区大桥高级中学2019-2020学年高二下学期期中考试化学试题江苏省启东中学2020-2021学年高二上学期期初考试化学试题(已下线)江苏省扬州中学2018-2019学年高二上学期12月月考试题 化学 Word版江苏省徐州市沛县2020-2021学年高二上学期第一次学情调研化学(选修)试题江苏省盐城市阜宁中学2020-2021学年高二上学期期末考试化学试题江苏省吴江汾湖高级中学2020-2021学年高二下学期阶段性教学质量检测化学试题江苏省宜兴市张渚高级中学2020-2021学年高二下学期第一学段质量检测化学试题江苏省盐城市第一中学、阜宁中学2021-2022学年高二上学期期中考试化学试题江苏省南菁高级中学2023-2024学年高二上学期9月调研化学试题2015-2016学年吉林省松原市油田高中高一下期末化学试卷2017届河北沧州市第一中学高三上学期第一次月考化学试题2017届河北省沧州市第一中学高三上周测化学试卷2016-2017学年湖北省咸宁市高二上学期第一次月考化学试卷2017届河北省石家庄二中高三上第二期联考化学试卷2016-2017学年山东省枣庄二中高二第二次月考化学试卷2017届河南省开封市高三上学期10月定位考试化学试卷2017届广西桂林十八中高三上10月月考化学试卷2017届河南省郑州一中高三上期中化学试卷2017届辽宁省沈阳二中高三上期中化学试卷2016-2017学年江西省樟树中学高二上第二次月考化学试卷2017届宁夏银川一中高三上月考四化学试卷2016-2017学年云南省曲靖一中高二上期中化学试卷2016-2017学年江西省樟树中学高二上月考二化学试卷2016-2017学年山东省济宁市历城区高二上期中化学试卷2016-2017学年辽宁东北育才学校高二上阶段考二化学卷2017届宁夏六盘山高级中学高三上月考二化学卷2016-2017学年广东省仲元中学高二上学期期末考试化学(理)试卷辽宁省鞍山市第一中学2016-2017学年高一下学期期中考试化学试题辽宁省辽源市金鼎高级中学2016-2017学年高二上学期期末考试化学试卷苏教版2017届高三单元精练检测六化学试题吉林省延边安图第一中学2016-2017学年高二练习化学试题山东省济南市外国语学校2017-2018学年高二10月月考(理)化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期中考试(理)化学试题黑龙江省大庆实验中学2018届高三上学期期中考试理科综合化学试题福建省南安第一中学2017-2018学年高二上学期期中考试化学试题山东省枣庄市薛城区2017-2018学年高二上学期期末化学试题(已下线)《考前20天终极攻略》-5月24日 盖斯定律及反应热的有关计算(已下线)解密08 化学反应与热能(教师版)——备战2018年高考化学之高频考点解密人教版2017届高三单元精练检测六化学试题湖南省醴陵市第一中学2018-2019学年高二上学期入学考试化学试题2018-2019学年人教版高中化学选修四模块综合测评题广东省蓝精灵中学2018-2019学年高二上学期联考化学试题【全国百强校】陕西省西安市第一中学2018-2019学年高二上学期10月月考化学试题甘肃省兰州第一中学2018-2019学年高二(理)上学期期中考试化学试题【校级联考】浙江省温州市“十五校联合体”2018-2019学年高二上学期期中联考化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题福建省惠安惠南中学2018-2019学年高二上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点(已下线)2019年4月8日 《每日一题》三轮复习——反应热的计算与盖斯定律云南省建水县第二中学2020届高三上学期开学考试化学试题安徽省青阳县第一中学2019-2020学年高二10月月考化学试题安徽省亳州市第十八中学2019-2020学年高二上学期第一次月考化学试题湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题贵州省麻江县第一中学2019-2020学年高二上学期期末考试化学试题2020届高三化学二轮冲刺新题专练——盖斯定律的应用2海南省海南中学2019-2020学年高二上学期期末考试化学试题福建省厦门市思明区厦门外国语学校2019-2020学年高三上学期周末练习12——化学试题云南省昭通市绥江县二中2019-2020学年高三上学期期末考试理综化学试题贵州省镇远县二中2019-2020学年高二上学期期末考试化学试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题2020届四川省成都市第七中学高三二月份网络教学质量监测卷化学试题安徽省合肥市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题湖北省武汉市华中师范大学第一附属中学2020届高三下学期四月份网络教学质量监测理科综合化学试题湖南省长沙市第一中学2019-2020学年高一下学期第三次月考化学试题吉林省白城市洮南市第一中学2019-2020学年高一下学期第三次月考化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期期中考试化学试题河南省安阳市林州市第一中学2020-2021学年高二上学期开学考试(实验班)化学试题(已下线)1.3.2 反应热的计算(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)1.3.1 盖斯定律(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)黑龙江省哈尔滨市第一中学校2021届高三上学期开学测试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测河北省唐山市第十一中学2021届高三9月入学检测化学试题高中必刷题高二选择性必修1第一章 化学反应的热效应 第一章素养检测(已下线)1.3.2+反应热的计算-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)福建省福州市福清西山学校高中部2019-2020学年高二上学期期中考试化学试题(已下线)【南昌新东方】9.湾里一中 梁莎陕西省西安市第八十九中学2018-2019学年高二上学期期中考试化学试题江西省九江市浔阳区九江市第七中学2020-2021学年高二上学期期中考试化学试题(已下线)练习2 盖斯定律与化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题重庆市南开中学2020-2021学年二上学期期末考试化学试题(已下线)第15讲 化学反应的热效应(练) — 2022年高考化学一轮复习讲练测(新教材新高考)山东省曲阜市第一中学2017-2018学年高二上学期第一次月考化学试题北京市昌平区新学道临川学校2021-2022学年高二上学期第一次月考化学试题湖北省武汉市华中师范大学第一附属中学2020届高三3月份网络教学质量监测卷理综化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第一次月考化学试题湖南省长沙市第一中学、广东省深圳实验学校2021-2022学年高三上学期联考化学试题 (已下线)第14周 晚练题-备战2022年高考化学周测与晚练(新高考专用)湖北省十堰市2016-2017学年高一下学期期末调研考试化学试题河北省保定市徐水综合高级中学2021-2022学年高二上学期第二次月考化学试题湖南省常德市第一中学 2023届高三7月摸底考试化学试题河南省南阳市第六完全学校高级中学2022-2023学年高二上学期9月考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题福建省莆田第七中学2021-2022学年高二上学期期末考试化学试题河南省安阳市第三十九中学2022-2023学年高二上学期第二次考试化学试题海南省三亚华侨学校(南新校区)2021-2022学年高二上学期期中考试化学试题天津市河东区 2022-2023 学年高二上学期期末质量检测化学试题广东省江门市第一中学2023-2024学年高二上学期第一次段考化学试题
真题
解题方法
4 . 下表列出了3种燃煤烟气脱硫方法的原理。
(1) 方法Ⅰ中氨水吸收燃煤烟气中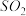 的化学反应为:
的化学反应为:

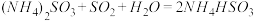
能提高燃煤烟气中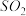 去除率的措施有
去除率的措施有__________ (填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D. 通入空气使HSO3-转化为SO42-
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的 ,原因是
,原因是________ (用离子方程式表示)。
(2)方法Ⅱ重要发生了下列反应:
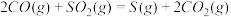 ∆H=8.0kJ/mol
∆H=8.0kJ/mol
 ∆H=90.4kJ/mol
∆H=90.4kJ/mol
 ∆H=-566.0kJ/mol
∆H=-566.0kJ/mol
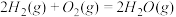 ∆H=-483.6kJ/mol
∆H=-483.6kJ/mol
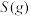 与
与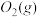 反应生成
反应生成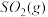 的热化学方程式为
的热化学方程式为_____________ 。
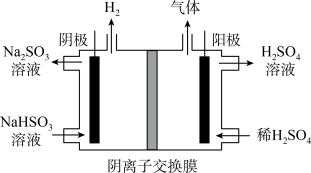
(3) 方法Ⅲ中用惰性电极电解 溶液的装置如上图所示。阳极区放出气体的成分为
溶液的装置如上图所示。阳极区放出气体的成分为______________ 。(填化学式)
| 方法I | 用氨水将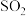 转化为 转化为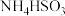 ,再氧化成( ,再氧化成(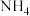 ) )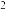 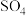 |
| 方法II | 用生物质热解气(主要成分CO、 、 、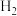 )将 )将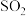 在高温下还原成单质硫 在高温下还原成单质硫 |
| 方法III | 用 溶液吸收 溶液吸收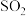 ,再经电解转化为 ,再经电解转化为 |
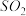 的化学反应为:
的化学反应为:
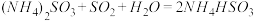
能提高燃煤烟气中
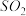 去除率的措施有
去除率的措施有A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D. 通入空气使HSO3-转化为SO42-
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的
 ,原因是
,原因是(2)方法Ⅱ重要发生了下列反应:
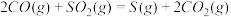 ∆H=8.0kJ/mol
∆H=8.0kJ/mol ∆H=90.4kJ/mol
∆H=90.4kJ/mol ∆H=-566.0kJ/mol
∆H=-566.0kJ/mol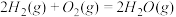 ∆H=-483.6kJ/mol
∆H=-483.6kJ/mol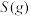 与
与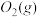 反应生成
反应生成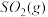 的热化学方程式为
的热化学方程式为
(3) 方法Ⅲ中用惰性电极电解
 溶液的装置如上图所示。阳极区放出气体的成分为
溶液的装置如上图所示。阳极区放出气体的成分为
您最近一年使用:0次
2019-01-30更新
|
202次组卷
|
4卷引用:2010年普通高等学校招生统一考试理综试题化学部分(江苏卷)
真题
名校
5 . 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200·9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241·6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______ mol·L-1。
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见下图。
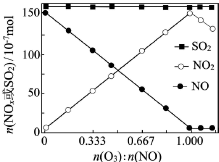
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是__________ 。
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是_________ 。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:___________ 。
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=________ [用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是_________ 。
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200·9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241·6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见下图。

①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=
您最近一年使用:0次
2019-01-30更新
|
1318次组卷
|
5卷引用:2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)
2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)2015-2016学年湖南师大附属中学高二上二次阶段测化学卷(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)湖南省常德市第二中学2021届高三上学期开学考试化学试题内蒙古阿拉善盟第一中学2020-2021学年高二上学期第一次段考化学试题
6 . 工业上制备BaCl2的工艺流程图如下:
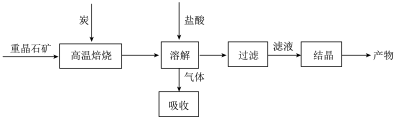
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①
4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②
2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为____________ 。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,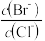 =
=__________ 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的 △H=
2CO(g)的 △H=________ kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是_______________________________________ ,_____________________________________________ 。

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)
 4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①
4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①BaSO4(s) + 2C(s)
 2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②
2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
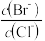 =
=[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g)
 2CO(g)的 △H=
2CO(g)的 △H=(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
您最近一年使用:0次
2019-01-30更新
|
957次组卷
|
7卷引用:2008年普通高等学校招生统一考试化学试题(江苏卷)
2008年普通高等学校招生统一考试化学试题(江苏卷)(已下线)2013-2014学年吉林省白山市第一中学高二上学期期末考试化学试卷(已下线)2014届海南省海南中学高二下学期期中考试化学试题试卷2016-2017学年河北省涿鹿县涿鹿中学高二上调研三化学卷湖南省长沙市第一中学2017-2018学年高二上学期期中考试化学试题内蒙古阿拉善盟第一中学2020-2021学年高二上学期第一次段考化学试题福建省莆田第七中学2021-2022学年高二下学期期中考试化学试题
7 . 铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g) △H=b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________ kJ·mol-1(用含a、b 的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为____________________________________________ 。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_______________________ 。
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为____________ 。
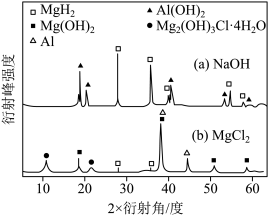
③在0.5 mol·L-1 NaOH和1.0 mol·L-1MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是_______________________ (填化学式)。
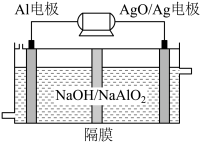
(3)铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为_________________________________ 。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g) △H=b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为
③在0.5 mol·L-1 NaOH和1.0 mol·L-1MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是

(3)铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为

您最近一年使用:0次
2019-01-30更新
|
1586次组卷
|
8卷引用:2012年普通高等学校招生全国统一考试化学(江苏卷)
真题
名校
8 . NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=___________ kJ·mol−1。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________ 。
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:____________________________________ 。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为__________ mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。

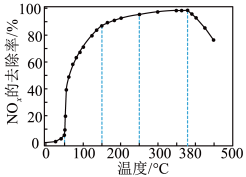
反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____________________________ ;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________ 。
 。
。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。

反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是
 。
。
您最近一年使用:0次
2018-06-10更新
|
4885次组卷
|
8卷引用:2018年全国普通高等学校招生统一考试化学(江苏卷)
真题
解题方法
9 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:① (g)+
(g)+ (g)=
(g)= (g)+
(g)+ (g)
(g) =
=

② (g)+
(g)+ (g)=
(g)= (g)+
(g)+ (g)
(g) =
=

③ (g)=
(g)= (g)+
(g)+ (g)
(g) =
=

(1)以甲烷为原料制取氢气是工业上常用的制氢方法。 (g)与
(g)与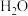 (g)反应生成
(g)反应生成 (g)和
(g)和 (g)的热化学方程式为
(g)的热化学方程式为______ 。
(2)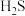 热分解制氢时,常向反应器中通入一定比例空气,使部分
热分解制氢时,常向反应器中通入一定比例空气,使部分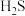 燃烧,其目的是
燃烧,其目的是_____ ;燃烧生成的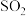 与
与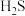 进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:
进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:_______ 。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中A、B表示的物质依次是_______ 。

(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_______ 。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为_______ 。
已知:①
 (g)+
(g)+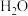 (g)=
(g)= (g)+
(g)+ (g)
(g) =
=

②
 (g)+
(g)+ (g)=
(g)= (g)+
(g)+ (g)
(g) =
=

③
 (g)=
(g)= (g)+
(g)+ (g)
(g) =
=

(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
 (g)与
(g)与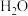 (g)反应生成
(g)反应生成 (g)和
(g)和 (g)的热化学方程式为
(g)的热化学方程式为(2)
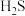 热分解制氢时,常向反应器中通入一定比例空气,使部分
热分解制氢时,常向反应器中通入一定比例空气,使部分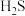 燃烧,其目的是
燃烧,其目的是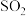 与
与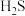 进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:
进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图11所示。图中A、B表示的物质依次是

(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图12(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为

(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为
您最近一年使用:0次
真题
10 . 废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是___ (填字母)
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中Cu 与H2O2反应生成Cu2+和H2O的热化学方程式为:__________ 。
(3)控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1
H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,
其主要原因是_________________________________________ 。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl 溶液,加热,生成
CuCl 的离子方程式是___________________________________ 。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中Cu 与H2O2反应生成Cu2+和H2O的热化学方程式为:
(3)控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1
H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol·L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,
其主要原因是
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl 溶液,加热,生成
CuCl 的离子方程式是
您最近一年使用:0次
2016-12-09更新
|
1513次组卷
|
3卷引用:2009年普通高等学校招生统一考试化学试题(江苏卷)



