解题方法
1 . 硫、氮和磷是生物必须的营养元素,含硫、氮和磷的化合物在自然界中广泛存在。
(1)火山喷发产生H2S在大气中发生如下反应:
①
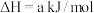
②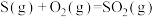
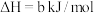
写出H2S(g)完全燃烧的热化学方程式_______ 。
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是_______ 。_______ ;
②若无能量损失,相同条件下,SO2和NO的体积比为_______ 时,两种气体都能被完全处理。
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。_______ 7(填“<”或“>”或“=”)。
②Na2HPO3其水解平衡常数
_______ (填数值)。
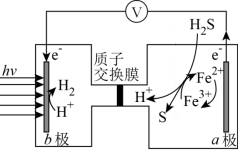
(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为_______ 。
(1)火山喷发产生H2S在大气中发生如下反应:
①

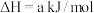
②
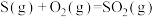
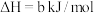
写出H2S(g)完全燃烧的热化学方程式
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是


②若无能量损失,相同条件下,SO2和NO的体积比为
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数(
 )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
②Na2HPO3其水解平衡常数

(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为
您最近一年使用:0次
名校
解题方法
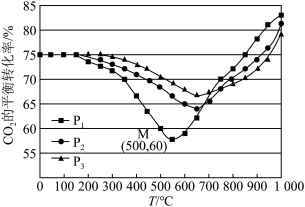
2 . 处理、回收和利用CO和CO2既能实现资源的综合利用,也是环境科学研究的热点课题。请回答下列问题:
(1)CO处理大气污染物 的相关原理为
的相关原理为 ,
,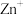 为该反应的催化剂,过程如下:
为该反应的催化剂,过程如下:



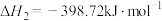
若反应 的正反应的活化能为
的正反应的活化能为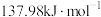 ,则逆反应的活化能为
,则逆反应的活化能为_______  。
。
(2)在容积相同的密闭容器A(起始温度为450℃,恒温)、B(起始温度为450℃,绝热)中分别加入等量的 、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。
、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。_______ (填“m”或“n”)曲线。
(3)已知反应 的速率方程为
的速率方程为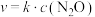 ,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。
,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。
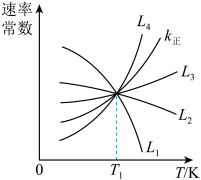
(4)根据阿伦尼乌斯经验公式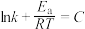 (其中k为速率常数,R、C均为常数,
(其中k为速率常数,R、C均为常数, 为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是
为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是_______ (填“x”或“y”),原因是_______ 。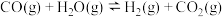 中CO的平衡转化率随
中CO的平衡转化率随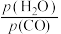 及温度变化关系如下图所示:
及温度变化关系如下图所示: )代替物质的量浓度(
)代替物质的量浓度(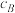 )也可以表示平衡常数(记作
)也可以表示平衡常数(记作 ),则该反应的
),则该反应的
_______ (填表达式,不必代数计算);如果提高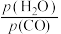 ,则
,则
_______ (填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400℃左右、 ,采用此条件的原因可能是
,采用此条件的原因可能是_______ 。
(1)CO处理大气污染物
 的相关原理为
的相关原理为 ,
,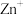 为该反应的催化剂,过程如下:
为该反应的催化剂,过程如下:


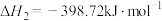
若反应
 的正反应的活化能为
的正反应的活化能为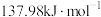 ,则逆反应的活化能为
,则逆反应的活化能为 。
。(2)在容积相同的密闭容器A(起始温度为450℃,恒温)、B(起始温度为450℃,绝热)中分别加入等量的
 、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。
、CO和相同催化剂。实验测得容器A、B中CO转化率随时间的变化关系如图所示。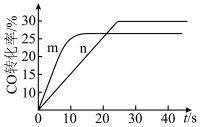
(3)已知反应
 的速率方程为
的速率方程为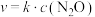 ,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。
,其中k为速率常数,只和温度有关。为了提高反应速率,可采取的措施有_______。A.恒压条件下,通入 | B.恒容条件下,通入CO |
| C.降温 | D.缩小容器体积 |
(4)根据阿伦尼乌斯经验公式
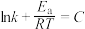 (其中k为速率常数,R、C均为常数,
(其中k为速率常数,R、C均为常数, 为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是
为活化能,T为绝对温度),使用x和y两种不同的催化剂得到相关图像,如图所示。在外界因素相同的条件下使用x和y两种催化剂,活化分子百分数最高的是
 中CO的平衡转化率随
中CO的平衡转化率随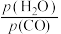 及温度变化关系如下图所示:
及温度变化关系如下图所示: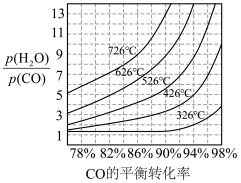
 )代替物质的量浓度(
)代替物质的量浓度(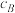 )也可以表示平衡常数(记作
)也可以表示平衡常数(记作 ),则该反应的
),则该反应的
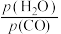 ,则
,则
 ,采用此条件的原因可能是
,采用此条件的原因可能是
您最近一年使用:0次
名校
解题方法
3 . 化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。
(1)汽车排气管内的催化转化器可实现尾气无毒处理。
已知:


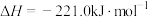
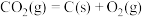
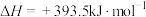 ,则:
,则:
①反应 的
的
________  。
。
②在600K时,将3.0molNO、3.6molCO通入固定容积3L的密闭容器中,20min后,反应达平衡,测得 的浓度为
的浓度为 ,则NO的转化率α=
,则NO的转化率α=________ 。
③若改变下列条件之一,达新平衡时NO的体积分数一定减小的是________ (填序号)。
a.增加CO的量 b.加入催化剂 c.降低温度 d.扩大容器体积
(2)某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
①探究浓度对平衡的影响
已知四氯合钴(Ⅱ)离子(蓝色)与六水合钴(Ⅱ)离子(粉红色)之间存在如下平衡: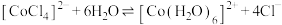 。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为
。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为________ 色;乙同学向溶液中加水,平衡移动方向为________ (填“向右”、“向左”或“不移动”),说明原因________ 。
②运用数字化实验探究压强对平衡的影响
将一收集满干燥 的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。________ 。
(1)汽车排气管内的催化转化器可实现尾气无毒处理。
已知:



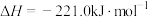
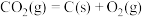
 ,则:
,则:①反应
 的
的
 。
。②在600K时,将3.0molNO、3.6molCO通入固定容积3L的密闭容器中,20min后,反应达平衡,测得
 的浓度为
的浓度为 ,则NO的转化率α=
,则NO的转化率α=③若改变下列条件之一,达新平衡时NO的体积分数一定减小的是
a.增加CO的量 b.加入催化剂 c.降低温度 d.扩大容器体积
(2)某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
①探究浓度对平衡的影响
已知四氯合钴(Ⅱ)离子(蓝色)与六水合钴(Ⅱ)离子(粉红色)之间存在如下平衡:
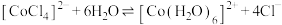 。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为
。甲同学向某已呈现紫色的氯化钴溶液中通入HCl,发现溶液变为②运用数字化实验探究压强对平衡的影响
将一收集满干燥
 的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
您最近一年使用:0次
名校
4 . 完成下列填空:
(1) 气态高能燃料乙硼烷
气态高能燃料乙硼烷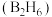 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:___________ ;
(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应:
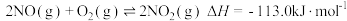 ①
①
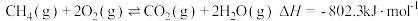 ②
②
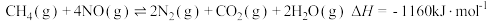 ③
③
则反应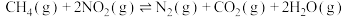 的
的
___________ 。
(3)天然气的一个重要用途是制取 ,其原理为:
,其原理为: 。
。
①该反应的平衡常数表达式为___________ 。
②在密闭容器中通入物质的量浓度均为 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1_______ P2(填"大于”或“小于”);压强为 时,在
时,在 点:v(正)
点:v(正)______ v(逆)(填“大于”、“小于”或“等于”)。 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明, 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是___________ 。240℃以后,随着温度的升高, 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是___________ 。 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:
Ⅰ:
Ⅱ:
当 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是___________ 。
(1)
 气态高能燃料乙硼烷
气态高能燃料乙硼烷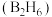 在氧气中燃烧,生成固态三氧化二硼和液态水放出
在氧气中燃烧,生成固态三氧化二硼和液态水放出 热量,其热化学方程式为:
热量,其热化学方程式为:(2)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为
 和
和 )污染,
)污染, 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应: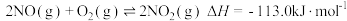 ①
①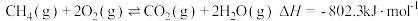 ②
②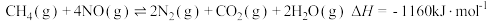 ③
③则反应
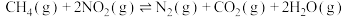 的
的
(3)天然气的一个重要用途是制取
 ,其原理为:
,其原理为: 。
。①该反应的平衡常数表达式为
②在密闭容器中通入物质的量浓度均为
 的
的 与
与 ,在一定条件下发生反应,测得
,在一定条件下发生反应,测得 的平衡转化率与温度及压强的关系如下图所示,则压强P1
的平衡转化率与温度及压强的关系如下图所示,则压强P1 时,在
时,在 点:v(正)
点:v(正)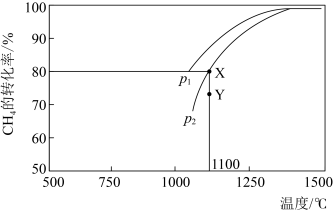
 可以去除烟气中的
可以去除烟气中的 ,其反应原理如下:
,其反应原理如下: ;其他条件相同,以
;其他条件相同,以 (一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,
(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明, 在240℃以上发挥催化作用。反应相同的时间,
在240℃以上发挥催化作用。反应相同的时间, 的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高,
的去除率随反应温度的变化如下图所示。240℃以前,随着温度的升高, 去除率降低的原因是
去除率降低的原因是 去除率迅速增大的主要原因是
去除率迅速增大的主要原因是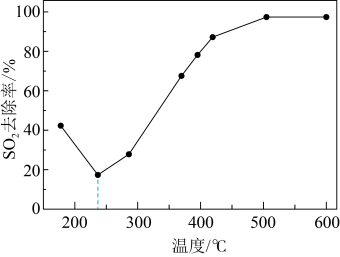
 的资源化利用能有效减少
的资源化利用能有效减少 排放,实现自然界中的碳循环。
排放,实现自然界中的碳循环。 催化加氢合成甲烷过程中发生下列反应:
催化加氢合成甲烷过程中发生下列反应:Ⅰ:

Ⅱ:

当
 时,
时, 平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的
平衡转化率与温度和压强的关系如图所示。800℃时,不同压强下的 平衡转化率趋向于相等的原因是
平衡转化率趋向于相等的原因是
您最近一年使用:0次
5 . 合成是转化的一种应用,甲醇作为一种可再生能源,工业上一般采用下列两种反应合成甲醇:
反应一:CO(g)+2H2(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
反应二:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
(1)相同条件下,反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH3,则ΔH3=
CO(g)+H2O(g) ΔH3,则ΔH3=___________ (用ΔH1和ΔH2表示)。
(2)下表所列数据是反应CO(g)+2H2(g) CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
①此反应的ΔH1___________ 0,ΔS___________ 0.(填“>”“=”或“<”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率是___________ ,此时的温度是___________ 。
③要提高CO的转化率,可以采取的措施是___________ 。
A.升温 B.恒容充入CO C.恒容充入H2 D.恒压充入惰性气体 E.分离出甲醇
(3)在水溶液中电解CO2生成甲醇的原理如图所示。___________ 。
②A极生成1mol甲醇时,B极生成气体在标准状况下的体积是___________ 。
反应一:CO(g)+2H2(g)
 CH3OH(g)ΔH1
CH3OH(g)ΔH1反应二:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2(1)相同条件下,反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3,则ΔH3=
CO(g)+H2O(g) ΔH3,则ΔH3=(2)下表所列数据是反应CO(g)+2H2(g)
 CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH1在不同温度下的化学平衡常数(K)。| 温度/℃ | 250 | 300 | 350 |
| 平衡常数(K) | 2.04 | 0.27 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率是
③要提高CO的转化率,可以采取的措施是
A.升温 B.恒容充入CO C.恒容充入H2 D.恒压充入惰性气体 E.分离出甲醇
(3)在水溶液中电解CO2生成甲醇的原理如图所示。

②A极生成1mol甲醇时,B极生成气体在标准状况下的体积是
您最近一年使用:0次
名校
6 . 乙苯被吸附在催化剂表面发生脱氢可生成苯乙烯、苯甲醛等,生成苯乙烯的相关反应如下。
反应1: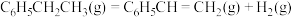
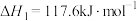
反应2:

反应3:
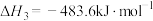
(1)反应4:
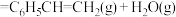

___________  。
。
(2)较低温度下,向乙苯脱氢的反应体系中加入少量 ,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是
,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是___________ 。
(3)向乙苯脱氢反应体系中加入 ,乙苯转化率与体系中
,乙苯转化率与体系中 分压强的关系如图1所示。随
分压强的关系如图1所示。随 的增加,乙苯转化率先增大后减小的可能原因为
的增加,乙苯转化率先增大后减小的可能原因为___________ 。 ,MgO催化剂表面进行
,MgO催化剂表面进行 的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。
的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。___________ ,反应一段时间后,催化剂活性有所下降,原因可能有反应过程产生的积碳覆盖在活性中心表面和___________ 。
②简述转化II的作用___________ 。
反应1:
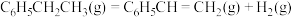
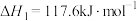
反应2:


反应3:

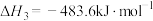
(1)反应4:

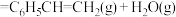

 。
。(2)较低温度下,向乙苯脱氢的反应体系中加入少量
 ,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是
,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是(3)向乙苯脱氢反应体系中加入
 ,乙苯转化率与体系中
,乙苯转化率与体系中 分压强的关系如图1所示。随
分压强的关系如图1所示。随 的增加,乙苯转化率先增大后减小的可能原因为
的增加,乙苯转化率先增大后减小的可能原因为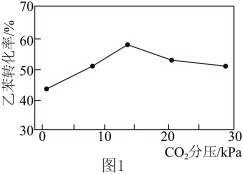
 ,MgO催化剂表面进行
,MgO催化剂表面进行 的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。
的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。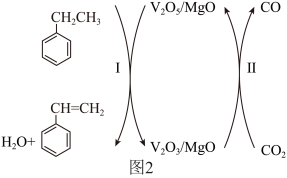
②简述转化II的作用
您最近一年使用:0次
解题方法
7 .  是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
(1)实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为:
,其实验过程可表示为:

在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成
气体,生成 ,反应为
,反应为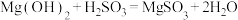 ,其平衡常数K与
,其平衡常数K与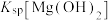 、
、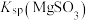 、
、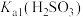 、
、 的代数关系式为
的代数关系式为
______ ;下列实验操作一定能提高氧化镁浆料吸收 效率的有
效率的有______ (填序号)。
A.水浴加热氧化镁浆料 B.加快搅拌速率
C.降低通入 气体的速率 D.通过多孔球泡向氧化镁浆料中通
气体的速率 D.通过多孔球泡向氧化镁浆料中通
(2)烟气中 可以用“亚硫酸铵吸收法”处理。
可以用“亚硫酸铵吸收法”处理。
①吸收时发生反应的化学方程式为______ 。
②测得25℃时溶液pH与各组份物质的量分数的变化关系如下左图所示,b点时溶液pH=7,则
______ 。

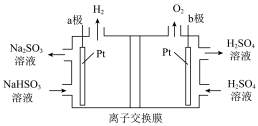
(3)电解法脱硫:用 溶液吸收
溶液吸收 气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂
气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂_______ 的循环利用。
(4)①图中a由极要连接电源的填______ (“正”或“负”)极。
②电解装置中使用______ (阳离子或阴离子)交换膜。
 是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。
是燃煤烟气中的主要污染物之一,可通过如下多种方法治理。(1)实验室模拟“镁法工业烟气脱硫”并制备
 ,其实验过程可表示为:
,其实验过程可表示为:
在搅拌下向氧化镁浆料中匀速缓慢通入
 气体,生成
气体,生成 ,反应为
,反应为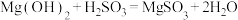 ,其平衡常数K与
,其平衡常数K与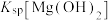 、
、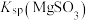 、
、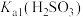 、
、 的代数关系式为
的代数关系式为
 效率的有
效率的有A.水浴加热氧化镁浆料 B.加快搅拌速率
C.降低通入
 气体的速率 D.通过多孔球泡向氧化镁浆料中通
气体的速率 D.通过多孔球泡向氧化镁浆料中通
(2)烟气中
 可以用“亚硫酸铵吸收法”处理。
可以用“亚硫酸铵吸收法”处理。①吸收时发生反应的化学方程式为
②测得25℃时溶液pH与各组份物质的量分数的变化关系如下左图所示,b点时溶液pH=7,则



(3)电解法脱硫:用
 溶液吸收
溶液吸收 气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂
气体,所得混合液用上右图所示的装置进行电解,可实现吸收剂(4)①图中a由极要连接电源的填
②电解装置中使用
您最近一年使用:0次
名校
8 . 我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。因此将 转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用
转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用 发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
Ⅰ.

Ⅱ.

回答下列问题:
(1)已知:
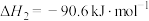 ,则
,则 为
为_________ 。
(2)向密闭容器中加入 (g)和
(g)和 (g)合成
(g)合成 (g)。已知反应Ⅰ的正反应速率可表示为
(g)。已知反应Ⅰ的正反应速率可表示为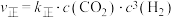 ,逆反应速率可表示为
,逆反应速率可表示为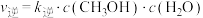 ,其中
,其中 、
、 为速率常数。
为速率常数。
①如图中能够代表 的曲线为
的曲线为_________ 。(填“ ”、“
”、“ ”、“
”、“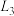 ”或“
”或“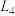 ”)。
”)。
②温度为 时,反应Ⅰ的化学平衡常数K=
时,反应Ⅰ的化学平衡常数K=_________ 。
③对于上述反应体系,下列说法正确的是_________ 。
A.增大 的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
B.加入催化剂, 的平衡转化率不变
的平衡转化率不变
C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
D.将水液化分离出来,既可以加快反应速率,又能提高 的转化率
的转化率
(3)不同条件下,按照 投料,
投料, 的平衡转化率如下图所示。
的平衡转化率如下图所示。
①压强 、
、 、
、 由大到小的顺序是
由大到小的顺序是_________ ,在 压强下,200℃~550℃时反应以
压强下,200℃~550℃时反应以_________ (填“Ⅰ”或“Ⅱ”)为主。
②压强为 时,温度高于660℃之后,随着温度升高
时,温度高于660℃之后,随着温度升高 平衡转化率增大的原因
平衡转化率增大的原因_____________ 。
 转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用
转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用 发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。Ⅰ.


Ⅱ.


回答下列问题:
(1)已知:

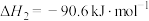 ,则
,则 为
为(2)向密闭容器中加入
 (g)和
(g)和 (g)合成
(g)合成 (g)。已知反应Ⅰ的正反应速率可表示为
(g)。已知反应Ⅰ的正反应速率可表示为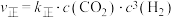 ,逆反应速率可表示为
,逆反应速率可表示为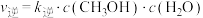 ,其中
,其中 、
、 为速率常数。
为速率常数。①如图中能够代表
 的曲线为
的曲线为 ”、“
”、“ ”、“
”、“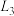 ”或“
”或“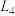 ”)。
”)。
②温度为
 时,反应Ⅰ的化学平衡常数K=
时,反应Ⅰ的化学平衡常数K=③对于上述反应体系,下列说法正确的是
A.增大
 的浓度,反应Ⅰ、Ⅱ的正反应速率均增加
的浓度,反应Ⅰ、Ⅱ的正反应速率均增加B.加入催化剂,
 的平衡转化率不变
的平衡转化率不变C.恒容密闭容器中当气体密度不变时,反应达到平衡状态
D.将水液化分离出来,既可以加快反应速率,又能提高
 的转化率
的转化率(3)不同条件下,按照
 投料,
投料, 的平衡转化率如下图所示。
的平衡转化率如下图所示。
①压强
 、
、 、
、 由大到小的顺序是
由大到小的顺序是 压强下,200℃~550℃时反应以
压强下,200℃~550℃时反应以②压强为
 时,温度高于660℃之后,随着温度升高
时,温度高于660℃之后,随着温度升高 平衡转化率增大的原因
平衡转化率增大的原因
您最近一年使用:0次
9 . 碳资源的合理利用和控制储存具有重要意义。
(1)工业上制备甲醇的主要反应有:
反应Ⅰ. 平衡常数K1
平衡常数K1
反应Ⅱ.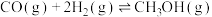 平衡常数K2
平衡常数K2
反应Ⅲ. 平衡常数K3
平衡常数K3
K3=___________ 。(用K1、K2表示)
(2)乙烷直接热解脱氢制乙烯。热化学方程式为: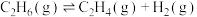 △H
△H
△H=___________ kJ∙mol-1 (填数值,相关键能数据如下表)。
(3)已知草酸( )为二元弱酸,
)为二元弱酸, 、
、 、
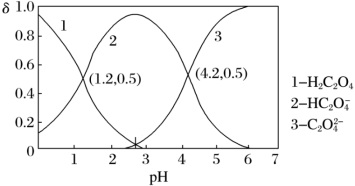
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
①用已知浓度的酸性KMnO4溶液滴定未知浓度草酸溶液,终点判断:当滴入最后半滴KMnO4溶液时,___________ ,停止滴定,并记录KMnO4溶液的体积,重复操作2~3次。
②硫酸酸化的KMnO4溶液滴定H2C2O4溶液的离子方程式为___________ 。
③结合图中信息,pH=2.7的溶液中: =
=___________ 。(填数值)
(1)工业上制备甲醇的主要反应有:
反应Ⅰ.
 平衡常数K1
平衡常数K1反应Ⅱ.
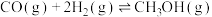 平衡常数K2
平衡常数K2反应Ⅲ.
 平衡常数K3
平衡常数K3K3=
(2)乙烷直接热解脱氢制乙烯。热化学方程式为:
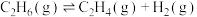 △H
△H△H=
| 化学键 |  |  |  |  |
键能/ | 348 | 615 | 413 | 436 |
(3)已知草酸(
 )为二元弱酸,
)为二元弱酸, 、
、 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
①用已知浓度的酸性KMnO4溶液滴定未知浓度草酸溶液,终点判断:当滴入最后半滴KMnO4溶液时,
②硫酸酸化的KMnO4溶液滴定H2C2O4溶液的离子方程式为
③结合图中信息,pH=2.7的溶液中:
 =
=
您最近一年使用:0次
名校
解题方法
10 . 阅读下列材料,完成6~8题:氯气及含氯物质在生产生活中具有广泛的应用。Deacon催化氧化法将HCl转化为Cl2的反应为: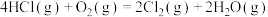

研究发现CuCl2(s)催化反应的过程如下:
反应ⅰ: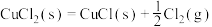

反应ⅱ:

反应ⅲ:……
下列关于Deacon催化氧化法制Cl2的说法正确的是
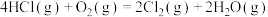

研究发现CuCl2(s)催化反应的过程如下:
反应ⅰ:
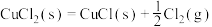

反应ⅱ:


反应ⅲ:……
下列关于Deacon催化氧化法制Cl2的说法正确的是
| A.总反应中反应物的总键能大于生成物的总键能 |
B.反应ⅰ的平衡常数可表示为 |
C.反应ⅱ中,生成22.4L  转移2mol 转移2mol  |
D.推断反应ⅲ应为 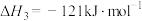 |
您最近一年使用:0次
2024-04-07更新
|
57次组卷
|
2卷引用:江苏省盐城中学2023-2024学年高二下学期3月月考化学试题



