解题方法
1 . (1)研究 、
、 等大气污染气体的处理方法具有重要的意义。
等大气污染气体的处理方法具有重要的意义。
已知:①
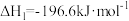
②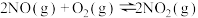
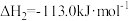
则反应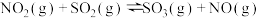 的
的
_______  。
。
(2)t℃时,将2mol 和1mol
和1mol 通入体积为2L的恒温、恒容密闭容器中,发生如下反应:
通入体积为2L的恒温、恒容密闭容器中,发生如下反应: ,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
①下列叙述能证明该反应已达到化学平衡状态的是_______ (选填字母)。
A.容器内压强不再发生变化
B. 的体积分数不再发生变化
的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmol 的同时消耗nmol
的同时消耗nmol
E.相同时间内消耗2nmol 的同时生成nmol
的同时生成nmol
F.混合气体密度不再变化
②从反应开始到达化学平衡,生成 的平均反应速率为
的平均反应速率为___ ;平衡时, 的转化率为
的转化率为___ 。
(3)已知 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是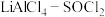 。电池的总反应可表示为
。电池的总反应可表示为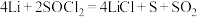 。请回答下列问题:
。请回答下列问题:
①电池的负极材料为_______ ,发生的电极反应为_______ 。
②电池正极发生的电极反应为_______ 。
 、
、 等大气污染气体的处理方法具有重要的意义。
等大气污染气体的处理方法具有重要的意义。已知:①

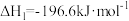
②
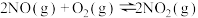
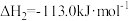
则反应
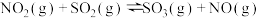 的
的
 。
。(2)t℃时,将2mol
 和1mol
和1mol 通入体积为2L的恒温、恒容密闭容器中,发生如下反应:
通入体积为2L的恒温、恒容密闭容器中,发生如下反应: ,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:①下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.
 的体积分数不再发生变化
的体积分数不再发生变化C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmol
 的同时消耗nmol
的同时消耗nmol
E.相同时间内消耗2nmol
 的同时生成nmol
的同时生成nmol
F.混合气体密度不再变化
②从反应开始到达化学平衡,生成
 的平均反应速率为
的平均反应速率为 的转化率为
的转化率为(3)已知
 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是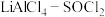 。电池的总反应可表示为
。电池的总反应可表示为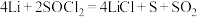 。请回答下列问题:
。请回答下列问题:①电池的负极材料为
②电池正极发生的电极反应为
您最近一年使用:0次
2 . 氢气因燃值高、燃烧产物无污染,被公认为清洁能源。
(1)电解饱和食盐水可制取氢气,该反应的化学方程式为___________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①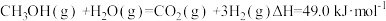
②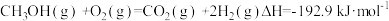
又知:③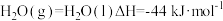
则表示甲醇摩尔燃烧焓的热化学方程式为___________
(3)已知1molH2 完全燃烧生成H2O(g) ,放出 245kJ 能量。根据下列信息,计算a____ 。
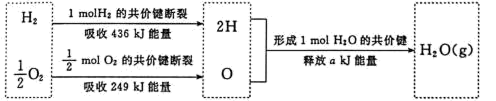
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为氢氧燃料电池的示意图。
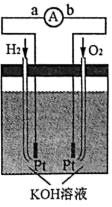
①在导线中电子流动方向为___________ (用 a、b 表示)。
②电极表面镀一层细小的铂粉,其目的是___________ 。
③该电池的负极反应式为H2 2e 2OH 2H2O,请写出正极反应式___________ 。
④假设该电池每发 1 度电(1 度 3.6 106 J )能生成 450g 水蒸气,则该电池的能量转化率为___________ (保留小数点后一位)。
(1)电解饱和食盐水可制取氢气,该反应的化学方程式为
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①
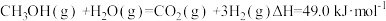
②
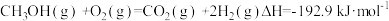
又知:③
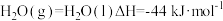
则表示甲醇摩尔燃烧焓的热化学方程式为
(3)已知1molH2 完全燃烧生成H2O(g) ,放出 245kJ 能量。根据下列信息,计算a

(4)氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为氢氧燃料电池的示意图。

①在导线中电子流动方向为
②电极表面镀一层细小的铂粉,其目的是
③该电池的负极反应式为H2 2e 2OH 2H2O,请写出正极反应式
④假设该电池每发 1 度电(1 度 3.6 106 J )能生成 450g 水蒸气,则该电池的能量转化率为
您最近一年使用:0次
名校
3 . 按要求书写下列方程式:
(1)制备粗硅的化学方程式___________ 。
(2)碱性锌锰干电池的正极反应式___________ 。
(3)用氢氧化钠溶液处理NO2尾气的化学方程式___________ 。
(4)海带提取碘下图所示步骤中反应的离子方程式___________ 。
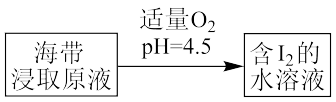
(5)甲硅烷(SiH4)常温下是无色气体遇空气能自燃,生成二氧化硅和水。已知101kPa 25℃时,测得1g SiH4自燃放出热量44.6kJ/mol。写出其热化学方程式___________ 。
(1)制备粗硅的化学方程式
(2)碱性锌锰干电池的正极反应式
(3)用氢氧化钠溶液处理NO2尾气的化学方程式
(4)海带提取碘下图所示步骤中反应的离子方程式

(5)甲硅烷(SiH4)常温下是无色气体遇空气能自燃,生成二氧化硅和水。已知101kPa 25℃时,测得1g SiH4自燃放出热量44.6kJ/mol。写出其热化学方程式
您最近一年使用:0次
名校
4 . 下列说法正确的是
| A.已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol,则1molH2SO4与1molBa(OH)2的反应热ΔH=2×(-57.3)kJ/mol |
| B.已知4P(红磷,s)=P4(白磷,s)ΔH=+17kJ/mol,则白磷比红磷更稳定 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
D.一定条件下,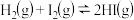 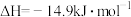 ,则该条件下分解1mol HI吸收的热量为7.45kJ ,则该条件下分解1mol HI吸收的热量为7.45kJ |
您最近一年使用:0次
2021-07-15更新
|
240次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一下学期期末考试化学试题
名校
解题方法
5 . Ⅰ.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为___________ (填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为___________ 。
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式_____ 。
(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式_____ 。

Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是___________ 。
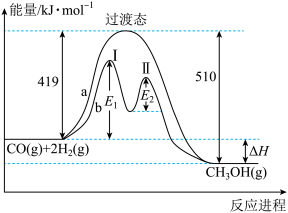
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式
(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式

Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是

A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
您最近一年使用:0次
2021-07-14更新
|
650次组卷
|
3卷引用:江西省景德镇一中2020-2021学年高一下学期期末考试化学试题
江西省景德镇一中2020-2021学年高一下学期期末考试化学试题湖北省襄阳市第一中学2022-2023学年高一下学期4月月考化学试题(已下线)易错点20 化学反应机理-备战2023年高考化学考试易错题
名校
解题方法
6 . 已知:C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1.下列有关说法正确的是
| A.相同条件下,1mol石墨比1mol金刚石能量高 |
| B.断裂1mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少 |
| C.若:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1 则有:C(s,金刚石)+O2(g)=CO2(g) ΔH2=-395.4kJ·mol-1 |
| D.相同条件下,金刚石比石墨稳定 |
您最近一年使用:0次
名校
7 . 2021年6月17日,搭载神舟十二号载人飞船的长征二号F摇十二运载火箭,在酒泉卫星发射中心发射。该运载火箭推进物分为偏二甲基肼(C2H8N2)、四氧化二氮和液氢、液氧两种。
(1)氨热分解法制氢气,相关化学键的键能数据如下表所示:
由以上数据可求得2NH3(g)⇌N2(g)+3H2(g)∆H=_______ 。
(2)在298.15K、100kPa条件下,N2(g)、H2(g)和NH3(g)的摩尔热容分别为29.1、28.9和35.6J·K-1·mol-1(已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。N2(g)、H2(g)合成NH3(g)的能量随温度T的变化示意图合理的是_______ 。
A.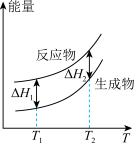 B.
B. 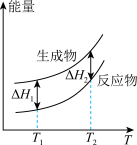 C.
C. 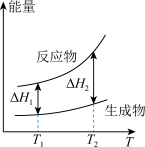 D.
D.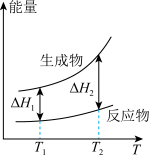
(3)甲烷水蒸气催化重整是制高纯氢的方法之一、反应器中存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH2
iii.C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH3
iv.CH4(g)=C(s)+2H2(g)ΔH4
ⅳ为积炭反应,利用ΔH1、ΔH2和ΔH3,可计算ΔH4=_______ 。
(4)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成N2(g)、H2O(g)和CO2(g),放出112.5kJ的热量,写出上述反应的热化学方程式_______ 。
(5)对C2H8N2和N2O4反应的说法正确的是_______ 。
A.偏二甲肼是比液氢更环保的燃料
B.N2即是氧化产物,又是还原产物
C.偏二甲基肼的燃烧热为2250kJ/mol
D.偏二甲肼在四氧化二氮中的燃烧是放热反应
(1)氨热分解法制氢气,相关化学键的键能数据如下表所示:
| 化学键 | N≡N | H—H | N—H |
| 键能E(kJ/mol) | 946.0 | 436.0 | 390.8 |
(2)在298.15K、100kPa条件下,N2(g)、H2(g)和NH3(g)的摩尔热容分别为29.1、28.9和35.6J·K-1·mol-1(已知:摩尔热容是指单位物质的量的某种物质升高单位温度所需的热量)。N2(g)、H2(g)合成NH3(g)的能量随温度T的变化示意图合理的是
A.
 B.
B.  C.
C.  D.
D.
(3)甲烷水蒸气催化重整是制高纯氢的方法之一、反应器中存在如下反应:
i.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH1
ii.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH2
iii.C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH3
iv.CH4(g)=C(s)+2H2(g)ΔH4
ⅳ为积炭反应,利用ΔH1、ΔH2和ΔH3,可计算ΔH4=
(4)3.0g液态偏二甲基肼与足量液态四氧化二氮完全反应生成N2(g)、H2O(g)和CO2(g),放出112.5kJ的热量,写出上述反应的热化学方程式
(5)对C2H8N2和N2O4反应的说法正确的是
A.偏二甲肼是比液氢更环保的燃料
B.N2即是氧化产物,又是还原产物
C.偏二甲基肼的燃烧热为2250kJ/mol
D.偏二甲肼在四氧化二氮中的燃烧是放热反应
您最近一年使用:0次
名校
解题方法
8 . 如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是
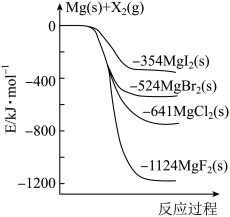

| A.由MgF2制取Mg是放热过程 |
| B.热稳定性:MgI2>MgBr2>MgCl2>MgF2 |
| C.此条件下热化学反应方程式为MgI2(s)+Cl2(g)=MgCl2(s)+I2(g)的∆H=-287kJ/mol |
| D.1molMg(s)和1molX2(g)断键吸收的能量大于形成1molMgX2成键放出的能量 |
您最近一年使用:0次
2021-07-13更新
|
245次组卷
|
3卷引用:吉林省长春市实验中学2020-2021学年高一下学期期末考试化学试题
解题方法
9 .  为工业制硫酸的重要反应。回答下列问题:
为工业制硫酸的重要反应。回答下列问题:
(1)已知该反应在反应过程中体系温度会升高,且每摩尔 、
、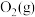 、
、 所含化学能分别为
所含化学能分别为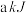 、
、 、
、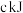 ,则每有
,则每有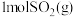 参与反应时,
参与反应时,_______ (填“吸收”或“放出”)的能量为_______  。
。
(2)一定温度下,向体积为2L的刚性密闭容器中充入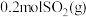 和
和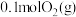 ,发生反应:
,发生反应: 。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如
。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如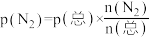 。
。
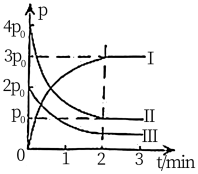
①图中表示 分压变化的曲线为
分压变化的曲线为_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”); 时,
时, 的转化率为
的转化率为_______ 。
② 内,用
内,用 表示该反应的速率为
表示该反应的速率为_______  。
。
③能说明上述反应已达到平衡状态的是_______ (填选项字母)。
a.容器内 、
、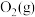 的物质的量浓度之比为
的物质的量浓度之比为
b.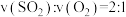
c.容器中气体的密度不随时间而变化
d.容器内压强不随时间面变化
 为工业制硫酸的重要反应。回答下列问题:
为工业制硫酸的重要反应。回答下列问题:(1)已知该反应在反应过程中体系温度会升高,且每摩尔
 、
、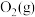 、
、 所含化学能分别为
所含化学能分别为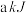 、
、 、
、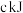 ,则每有
,则每有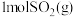 参与反应时,
参与反应时, 。
。(2)一定温度下,向体积为2L的刚性密闭容器中充入
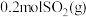 和
和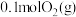 ,发生反应:
,发生反应: 。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如
。反应过程中容器内各物质的分压随时间变化关系如图所示:已知:分压等于各自物质的量分数乘以总压,例如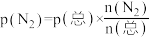 。
。
①图中表示
 分压变化的曲线为
分压变化的曲线为 时,
时, 的转化率为
的转化率为②
 内,用
内,用 表示该反应的速率为
表示该反应的速率为 。
。③能说明上述反应已达到平衡状态的是
a.容器内
 、
、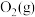 的物质的量浓度之比为
的物质的量浓度之比为
b.
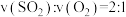
c.容器中气体的密度不随时间而变化
d.容器内压强不随时间面变化
您最近一年使用:0次
解题方法
10 . 中国化学家研究出一种新型复合光催化剂(C3N4/CQDs)可以利用太阳光高效分解水,其原理如下图所示。下列说法不正确的是
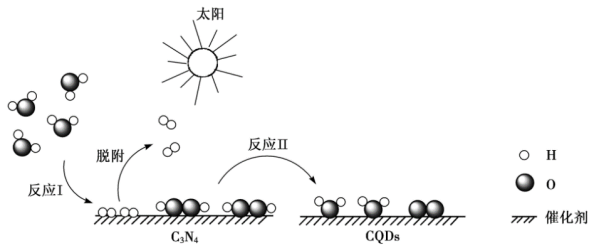

| A.使用该光催化剂,提高了化学反应速率,实现了太阳能向化学能的转化 |
| B.反应Ⅰ中涉及到非极性键的断裂和极性键的形成 |
C.反应Ⅱ中 既做氧化剂又做还原剂 既做氧化剂又做还原剂 |
D.总反应的化学方程式为 |
您最近一年使用:0次



