1 . 氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示:
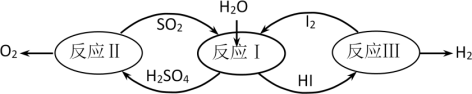
(1)反应Ⅰ的化学方程式是___ 。
(2)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ•mol-1。该反应自发进行的条件是__ (填“高温”、“低温”或“任意温度”),理由是__ 。
反应Ⅱ由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177kJ•mol-1
ii.SO3(g)分解。则SO3(g)分解的热化学方程式为___ 。
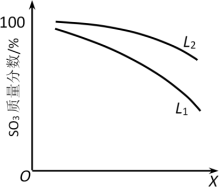
(3)L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
①X代表的物理量是___ 。
②判断L1、L2的大小关系,L1___ L2,并简述理由:___ 。
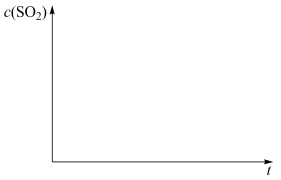
(4)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H1=218.4kJ•mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) △H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g) △H2=-175.6kJ•mol-1(反应Ⅱ)
CaS(s)+4CO2(g) △H2=-175.6kJ•mol-1(反应Ⅱ)
恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请画出反应体系中c(SO2)随时间 变化的总趋势图
变化的总趋势图___ 。
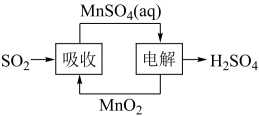
(5)工业生产中产生的SO2废气也可用如图方法获得H2SO4。写出电解的阳极反应式___ 。

(1)反应Ⅰ的化学方程式是
(2)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ•mol-1。该反应自发进行的条件是
反应Ⅱ由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177kJ•mol-1
ii.SO3(g)分解。则SO3(g)分解的热化学方程式为
(3)L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
①X代表的物理量是
②判断L1、L2的大小关系,L1

(4)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) △H1=218.4kJ•mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) △H1=218.4kJ•mol-1(反应Ⅰ)CaSO4(s)+4CO(g)
 CaS(s)+4CO2(g) △H2=-175.6kJ•mol-1(反应Ⅱ)
CaS(s)+4CO2(g) △H2=-175.6kJ•mol-1(反应Ⅱ)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请画出反应体系中c(SO2)随时间
 变化的总趋势图
变化的总趋势图
(5)工业生产中产生的SO2废气也可用如图方法获得H2SO4。写出电解的阳极反应式

您最近一年使用:0次
2 . 在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:
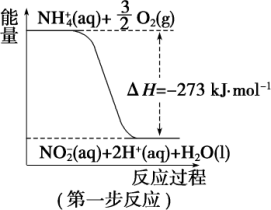
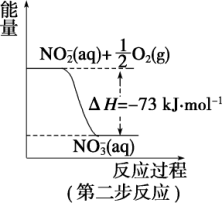
(1)第一步反应是_______ (填“放热”或“吸热”)反应,判断依据是_______ 。
(2)1 molNH (aq) 全部氧化成NO
(aq) 全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
(3) HCl与氧气在催化剂加热条件下可生成氯气:4HCl+O2 2Cl2+2H2O,已知某些化学键的键能数据如表:
2Cl2+2H2O,已知某些化学键的键能数据如表:
该反应的热化学方程式是_______ 。
(4)FeCl3溶液常用于腐蚀印刷电路铜板,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则正极所用的电极材料为_______ ;电解质溶液为_______ ,当电路中转移0.2 mol 电子时,被腐蚀的负极反应物的质量为_______ g。
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:

(1)第一步反应是
(2)1 molNH
 (aq) 全部氧化成NO
(aq) 全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(3) HCl与氧气在催化剂加热条件下可生成氯气:4HCl+O2
 2Cl2+2H2O,已知某些化学键的键能数据如表:
2Cl2+2H2O,已知某些化学键的键能数据如表:| 化学键 | H-Cl | O=O | Cl-Cl | H-O |
| 键能/kJ/mol | 431 | 498 | 243 | 463 |
该反应的热化学方程式是
(4)FeCl3溶液常用于腐蚀印刷电路铜板,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则正极所用的电极材料为
您最近一年使用:0次
名校
解题方法
3 . 研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是____________ 。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为___ mol,放出的热量为_______ kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=__________ 。
(4)已知:N2、O2分子中化学键的键能分别是946kJ·mol−1、497kJ·mol−1。N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol−1。NO分子中化学键的键能为______ 。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=
(4)已知:N2、O2分子中化学键的键能分别是946kJ·mol−1、497kJ·mol−1。N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol−1。NO分子中化学键的键能为
您最近一年使用:0次
2021-06-24更新
|
357次组卷
|
2卷引用:甘肃省静宁县第一中学2020-2021学年高一下学期第三次月考化学(普通班)试题
解题方法
4 . (1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇
I:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.0kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0kJ·mol-1
II:CO(g)+2H2(g) CH3OH(g) ΔH=-129.0kJ·mol-1
CH3OH(g) ΔH=-129.0kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为___ 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图1装置实现上述过程:
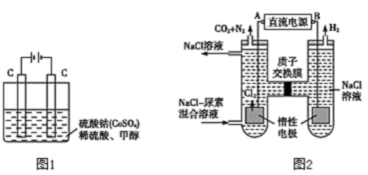
①写出阳极电极反应式___ 。
②写出除去甲醇的离子方程式:___ 。
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素CO(NH2)2,其原理如图2。
①电源的正极为___ (填“A”或“B”)。
②阳极室中发生的反应依次为___ 、___ 。
③电解结束后,阴极室溶液的pH与电解前相比___ (“变大”“变小”或“不变”)。
I:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.0kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0kJ·mol-1II:CO(g)+2H2(g)
 CH3OH(g) ΔH=-129.0kJ·mol-1
CH3OH(g) ΔH=-129.0kJ·mol-1CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图1装置实现上述过程:

①写出阳极电极反应式
②写出除去甲醇的离子方程式:
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素CO(NH2)2,其原理如图2。
①电源的正极为
②阳极室中发生的反应依次为
③电解结束后,阴极室溶液的pH与电解前相比
您最近一年使用:0次
名校
解题方法
5 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______ 。
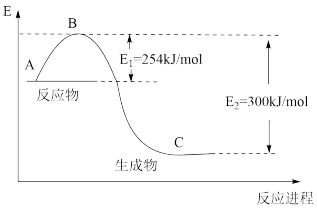
(2)若已知表中数据:
试根据表中及图中数据计算N-H的键能:_______ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
② N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1
则NH3还原NO的热化学方程式:_______ 。
(4)N、H、O元素形成的离子化合物为_______ (填化学式)。
(5) 氨气可用电解法合成,其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。
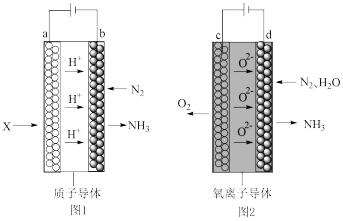
图1中,a 电极上通入的X 为_______ ;图 2 中,d 电极上的电极反应式为_______ 。
(1)图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(2)若已知表中数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能:
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
② N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1
则NH3还原NO的热化学方程式:
(4)N、H、O元素形成的离子化合物为
(5) 氨气可用电解法合成,其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。

图1中,a 电极上通入的X 为
您最近一年使用:0次
6 . 全球大气CO2浓度升高对人类生活产生了影响,CO2的捕集和资源化利用成为研究热点。
(1)CO2能引起海水酸化,原理为___ (用化学方程式表示),因此CO2过量排放对海洋生态系统会造成严重影响。
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是___ 。
A.K2CO3 B.CaO C.NH3. D.NH4Cl
(3)CO2甲烷化是实现其资源化利用的有效方式之一。
I.热化学转化法:工业上常用CO2催化加氢合成CH4。
已知:①CO(g)+H2O(g) H2(g)+CO2(g) ΔH1=-41kJ·mol-1
H2(g)+CO2(g) ΔH1=-41kJ·mol-1
②C(s)+2H2(g) CH4(g) ΔH2=-73kJ·mol-1
CH4(g) ΔH2=-73kJ·mol-1
③2CO(g) C(s)+CO2(g) ΔH3=-171 kJ·mol-1
C(s)+CO2(g) ΔH3=-171 kJ·mol-1
反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的ΔH=
CH4(g)+2H2O(g)的ΔH=___ kJ·mol-1
在该工业生产中,选用了高活性的Ni基催化剂,目的是:___ 。
II.电化学转化法:多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如图。
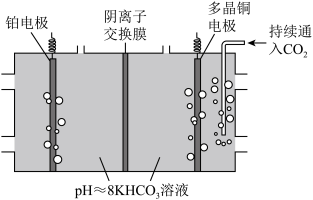
①多晶铜连接电源的___ 极。(填“正”或“负”)
②阳极氧化产物只有O2。电解时实际生成CH4的总最小于由O2理论计算所得CH4的量,结合电极反应式解释原因:___ 。
(1)CO2能引起海水酸化,原理为
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。下列物质中能作为捕碳剂的是
A.K2CO3 B.CaO C.NH3. D.NH4Cl
(3)CO2甲烷化是实现其资源化利用的有效方式之一。
I.热化学转化法:工业上常用CO2催化加氢合成CH4。
已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH1=-41kJ·mol-1
H2(g)+CO2(g) ΔH1=-41kJ·mol-1②C(s)+2H2(g)
 CH4(g) ΔH2=-73kJ·mol-1
CH4(g) ΔH2=-73kJ·mol-1③2CO(g)
 C(s)+CO2(g) ΔH3=-171 kJ·mol-1
C(s)+CO2(g) ΔH3=-171 kJ·mol-1反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的ΔH=
CH4(g)+2H2O(g)的ΔH=在该工业生产中,选用了高活性的Ni基催化剂,目的是:
II.电化学转化法:多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如图。

①多晶铜连接电源的
②阳极氧化产物只有O2。电解时实际生成CH4的总最小于由O2理论计算所得CH4的量,结合电极反应式解释原因:
您最近一年使用:0次
7 . 已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别是393.5kJ·mol-1、285.8kJ·mol-1和870.3kJ·mol-1(注:CH3COOH的燃烧产物是CO2和H2O,则反应2C(g)+2H2+O2(g)=CH3COOH(l)的ΔH为
| A.-488.3kJ·mol-1 | B.-762.6kJ·mol-1 |
| C.-654.9kJ·mol-1 | D.+191kJ·mol-1 |
您最近一年使用:0次
名校
解题方法
8 . 甲醇(CH3OH)是一种基本的有机化工原料,主要用于塑料、医药、农药、合成蛋白质等工业。
I.工业上常用一氧化碳(CO)和氢气(H2)合成甲醇。一定温度下,在容积为2L的某恒容密闭容器中充入一氧化碳和氢气两种气体进行反应,反应过程中各成分的相关数据如图所示。

回答下列问题:
(1)该反应的化学方程为___________ 。
(2)从反应开始至10min内,(恰好达平衡时间内)CO的消耗速率为___________ 。
(3)反应达平衡时,H2的转化率为___________ ,容器内CH3OH与CO的物质的量之比n(CH3OH):n(CO)=___________ 。
II.工业上常用天然气作为制备CH3OH的原料。已知:
①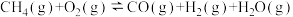 △H=-321.5kJ/mol
△H=-321.5kJ/mol
②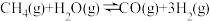 △H=+250.3kJ/mol
△H=+250.3kJ/mol
③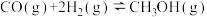 △H=-90.0kJ/mol
△H=-90.0kJ/mol
(4)CH4(g)与O2(g)化合生成CH3OH(g)的热化学方程式是___________ 。
III.CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气和KOH溶液构成。回答下列问题:
(5)该电池的负极反应为___________ 。
I.工业上常用一氧化碳(CO)和氢气(H2)合成甲醇。一定温度下,在容积为2L的某恒容密闭容器中充入一氧化碳和氢气两种气体进行反应,反应过程中各成分的相关数据如图所示。

回答下列问题:
(1)该反应的化学方程为
(2)从反应开始至10min内,(恰好达平衡时间内)CO的消耗速率为
(3)反应达平衡时,H2的转化率为
II.工业上常用天然气作为制备CH3OH的原料。已知:
①
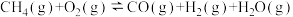 △H=-321.5kJ/mol
△H=-321.5kJ/mol②
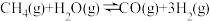 △H=+250.3kJ/mol
△H=+250.3kJ/mol③
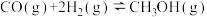 △H=-90.0kJ/mol
△H=-90.0kJ/mol(4)CH4(g)与O2(g)化合生成CH3OH(g)的热化学方程式是
III.CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气和KOH溶液构成。回答下列问题:
(5)该电池的负极反应为
您最近一年使用:0次
9 . 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
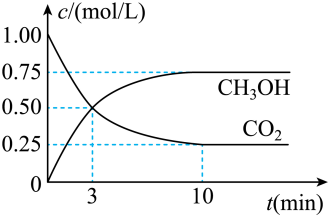
(1)应开始到平衡,H2的平均反应速率v(H2)=___________ mol/(L·min),H2的转化率为___________ 。
(2)能判断该反应是否达到化学平衡状态的依据是___________ 。
a.容器中压强不变 b.混合气体中c(CO2)=c(H2O)
c.混合气体的平均分子量不变 d.混合气体的密度不变
(3)下列措施中能使活化分子百分数增大的是___________ 。
A.升高温度 B.增大反应物浓度 C.增大压强 D.使用正催化剂
(4)一种新型燃料电池,一极通入空气,另一极通入甲醇气体;燃料电池内部是熔融的K2CO3,在其内部可以传导CO 。在电池内部CO
。在电池内部CO 移向
移向___________ ,该电池的负极反应为___________ 。
(5)氮氧化物的污染也受到高度重视,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是___________ 。
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)应开始到平衡,H2的平均反应速率v(H2)=
(2)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(CO2)=c(H2O)
c.混合气体的平均分子量不变 d.混合气体的密度不变
(3)下列措施中能使活化分子百分数增大的是
A.升高温度 B.增大反应物浓度 C.增大压强 D.使用正催化剂
(4)一种新型燃料电池,一极通入空气,另一极通入甲醇气体;燃料电池内部是熔融的K2CO3,在其内部可以传导CO
 。在电池内部CO
。在电池内部CO 移向
移向(5)氮氧化物的污染也受到高度重视,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.5kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
您最近一年使用:0次
10 . Ⅰ.钢铁容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一、可采用电化学防护技术减缓海水中钢铁设施的腐蚀,下图是钢铁桥墩部分防护原理示意图。
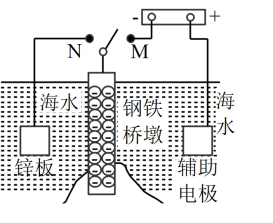
(1)K 与 M 连接时钢铁桥墩的电化学防护方法为___________ 。
(2)K与N连接时,钢铁桥墩为___________ 极(填"正"、"负"、"阴"或"阳"),电极反应式为___________ 。
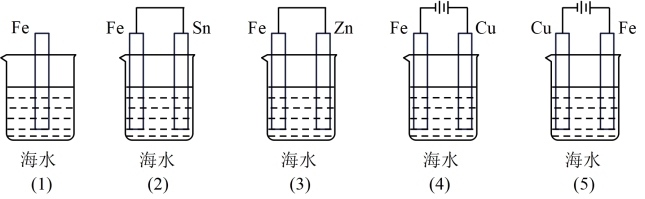
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是___________ 。
(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是__________ 。
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。
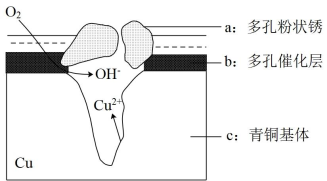
(1)腐蚀过程中,负极是___________ (填图中字母"a"或"b"或"c");
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为___________ 。
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为___________ L(标准状况)。

(1)K 与 M 连接时钢铁桥墩的电化学防护方法为
(2)K与N连接时,钢铁桥墩为
(3)下列各情况中,Fe片腐蚀由快到慢的顺序是

(4)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH = +234.1 kJ/mol
C(s)+O2(g)=CO2(g) ΔH = -393.5 kJ/mol。
根据以上信息,则Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式是
Ⅱ.经研究发现青铜器的腐蚀竟然都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。

(1)腐蚀过程中,负极是
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为
(3)若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
2021-06-17更新
|
180次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题



