1 . 近年来,改善环境是科学研究的重要课题,对实现碳循环及废气资源的再利用技术的发展都具有重要意义。
(1)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1 K1
CH3OH(g)+H2O(g) △H1 K1
Ⅱ.CO(g)+2H2(g) CH3OH(g) △H2 K2
CH3OH(g) △H2 K2
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) △H3 K3
CO(g)+H2O(g) △H3 K3
则△H2=______ (用含△H1、△H3的代数式表示),K2=______ (用含K1、K3的代数式表示)。
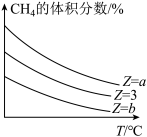
(2)一定条件下,CH4和H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) △H,设起始
CO(g)+3H2(g) △H,设起始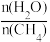 =Z,在恒压下,反应达到平衡时CH4的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
=Z,在恒压下,反应达到平衡时CH4的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是______ (填标号)。
(3)在T1℃时,往10L的某恒容密闭容器中充入3molCH4(g)和5molH2O(g),发生反应CH4(g)+H2O(g) CO(g)+3H2(g),5min后该反应达到平衡,此时测得混合气体的总压强为起始压强的1.5倍,则:
CO(g)+3H2(g),5min后该反应达到平衡,此时测得混合气体的总压强为起始压强的1.5倍,则:
①0~5min内,v(H2)=______ mol•L-1•min-1,H2O(g)的平衡转化率为______ %。
②该反应的平衡常数K=______ (mol•L-1)2。
③反应达到平衡时,再充入1molH2O(g)和2molCO(g),此时v正______ (填“>”、“<”或“=”)v逆。
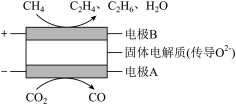
(4)CH4和CO2都是比较稳定的分子,科学家利用化学装置实现两种分子的耦合转化,其原理如图所示。若生成乙烯和乙烷的体积比为7∶3,则消耗CH4和CO2的体积比为______ 。
(1)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1 K1
CH3OH(g)+H2O(g) △H1 K1Ⅱ.CO(g)+2H2(g)
 CH3OH(g) △H2 K2
CH3OH(g) △H2 K2Ⅲ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H3 K3
CO(g)+H2O(g) △H3 K3则△H2=
(2)一定条件下,CH4和H2O(g)发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H,设起始
CO(g)+3H2(g) △H,设起始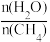 =Z,在恒压下,反应达到平衡时CH4的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
=Z,在恒压下,反应达到平衡时CH4的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
| A.若氢气的物质的量分数不再随时间而改变,则该反应达到平衡 |
| B.加入合适的催化剂,该反应的平衡转化率和△H的值均增大 |
| C.当混合气体的平均相对分子质量不再随时间而改变时,该反应达到平衡 |
| D.a>3>b |
 CO(g)+3H2(g),5min后该反应达到平衡,此时测得混合气体的总压强为起始压强的1.5倍,则:
CO(g)+3H2(g),5min后该反应达到平衡,此时测得混合气体的总压强为起始压强的1.5倍,则:①0~5min内,v(H2)=
②该反应的平衡常数K=
③反应达到平衡时,再充入1molH2O(g)和2molCO(g),此时v正
(4)CH4和CO2都是比较稳定的分子,科学家利用化学装置实现两种分子的耦合转化,其原理如图所示。若生成乙烯和乙烷的体积比为7∶3,则消耗CH4和CO2的体积比为

您最近一年使用:0次
2023-04-16更新
|
92次组卷
|
2卷引用:山西省忻州一中忻州实验中学校2022-2023学年高二下学期4月期中联考化学试题
2 . 在“碳达峰、碳中和”的目标引领下,减少 排放实现
排放实现 的有效转化成为科研工作者的研究热点。根据以下几种常见的
的有效转化成为科研工作者的研究热点。根据以下几种常见的 利用方法,回答下列问题。
利用方法,回答下列问题。
I.以 作催化剂,采用“
作催化剂,采用“ 催化加氢制甲醇”方法将其资源化利用。反应历程如下:
催化加氢制甲醇”方法将其资源化利用。反应历程如下:
i.催化剂活化: (无活性)
(无活性)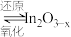 (有活性);
(有活性);
ii. 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:
①主反应:
 ,
,
②副反应:
 。
。
(1)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是_______(填序号)。
(2)a. 选择性随气体流速增大而升高的原因可能是
选择性随气体流速增大而升高的原因可能是_______ 。(已知: 选择性
选择性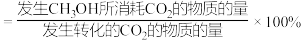 )
)
b.某温度下, 与
与 的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中
的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中 的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:
的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:_______ 。
(3)反应①、②的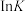 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。

升高温度,反应 的化学平衡常数
的化学平衡常数_______ (填“增大”或“减小”或“不变”)。
(4)恒温恒压密闭容器中,加入2mol 和4mol
和4mol ,只发生反应①和反应②,初始压强为
,只发生反应①和反应②,初始压强为 。
。
a.在230℃以上,升高温度 的平衡转化率增大,但甲醇的产率降低,原因是
的平衡转化率增大,但甲醇的产率降低,原因是_______ 。
b.在300℃发生反应,反应达平衡时, 的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=
的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=_______ (保留两位有效数字)。
II.利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
i.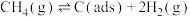
ii.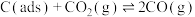
上述反应中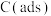 为吸附活性炭,反应历程的能量变化如图1所示:
为吸附活性炭,反应历程的能量变化如图1所示:

(5) 干重整反应的速率由决定
干重整反应的速率由决定_______ (填“反应i”或“反应ⅱ”), 干重整反应的热化方程式为
干重整反应的热化方程式为_______ 。(选取图1中 、
、 、
、 表示反应热)。
表示反应热)。
 排放实现
排放实现 的有效转化成为科研工作者的研究热点。根据以下几种常见的
的有效转化成为科研工作者的研究热点。根据以下几种常见的 利用方法,回答下列问题。
利用方法,回答下列问题。I.以
 作催化剂,采用“
作催化剂,采用“ 催化加氢制甲醇”方法将其资源化利用。反应历程如下:
催化加氢制甲醇”方法将其资源化利用。反应历程如下:i.催化剂活化:
 (无活性)
(无活性)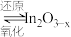 (有活性);
(有活性);ii.
 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:①主反应:

 ,
,②副反应:

 。
。(1)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是_______(填序号)。
A.分别用 和 和 表示的速率之比为3:1 表示的速率之比为3:1 |
| B.混合气体的平均摩尔质量不变 |
| C.混合气体的密度不变 |
D. 和 和 的分压之比不变 的分压之比不变 |
 选择性随气体流速增大而升高的原因可能是
选择性随气体流速增大而升高的原因可能是 选择性
选择性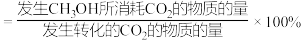 )
)b.某温度下,
 与
与 的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中
的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中 的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:
的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:(3)反应①、②的
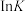 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
升高温度,反应
 的化学平衡常数
的化学平衡常数(4)恒温恒压密闭容器中,加入2mol
 和4mol
和4mol ,只发生反应①和反应②,初始压强为
,只发生反应①和反应②,初始压强为 。
。a.在230℃以上,升高温度
 的平衡转化率增大,但甲醇的产率降低,原因是
的平衡转化率增大,但甲醇的产率降低,原因是b.在300℃发生反应,反应达平衡时,
 的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=
的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=II.利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
i.
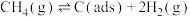
ii.
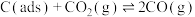
上述反应中
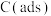 为吸附活性炭,反应历程的能量变化如图1所示:
为吸附活性炭,反应历程的能量变化如图1所示:
(5)
 干重整反应的速率由决定
干重整反应的速率由决定 干重整反应的热化方程式为
干重整反应的热化方程式为 、
、 、
、 表示反应热)。
表示反应热)。
您最近一年使用:0次
名校
3 . TiN具有良好的导电和导热性,可用于高温结构材料和超导材料。可利用化学气相沉积技术来制备氮化钛。请回答下列问题:
(1)已知1200℃下,三种制备氮化钛反应的热化学方程式:
(ⅰ)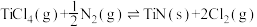
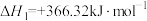
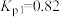
(ⅱ)
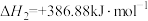
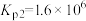
(ⅲ)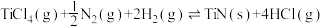
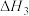
①已知反应(ⅳ)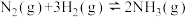
 ,则
,则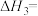
_______  。
。
②利用反应ⅰ和ⅱ两种方式制备TiN时。反应ⅱ的反应趋势远大于ⅰ,其原因是_______ 。
(2)在1200℃、130kPa反应条件下,将 、
、 、
、 以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中
以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中 与
与 的分压相等,则
的分压相等,则 平衡转化率为
平衡转化率为_______ (保留三位有效数字),0~20min之间,以分压表示 的平均反应速率为
的平均反应速率为_______  。
。
(3)制备氮化钛的原料氨气的合成。将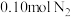 和
和 投入到某刚性反应容器中,测得反应过程中
投入到某刚性反应容器中,测得反应过程中 的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
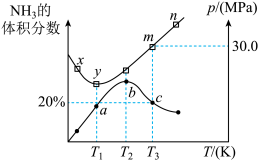
①对于该可逆反应过程,下列有关说法正确的是_______ (填序号)。
A.a、b、c三点时,该反应均处于平衡状态
B.m→n过程中,该反应平衡逆向移动
C.混合气体的平均摩尔质量M(b)>M(c)>M(a)
D.混合气体的密度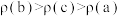
②x、y、m三点对应温度下的平衡常数由大到小的顺序为_______ 。
③当温度为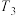 ,该反应达到平衡时,以气体分压表示的该反应的平衡常数
,该反应达到平衡时,以气体分压表示的该反应的平衡常数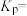
_______  (列出计算式即可)。
(列出计算式即可)。
(1)已知1200℃下,三种制备氮化钛反应的热化学方程式:
(ⅰ)
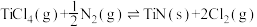
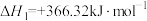
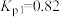
(ⅱ)

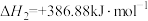
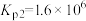
(ⅲ)
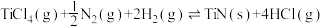
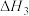
①已知反应(ⅳ)
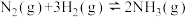
 ,则
,则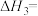
 。
。②利用反应ⅰ和ⅱ两种方式制备TiN时。反应ⅱ的反应趋势远大于ⅰ,其原因是
(2)在1200℃、130kPa反应条件下,将
 、
、 、
、 以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中
以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中 与
与 的分压相等,则
的分压相等,则 平衡转化率为
平衡转化率为 的平均反应速率为
的平均反应速率为 。
。(3)制备氮化钛的原料氨气的合成。将
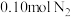 和
和 投入到某刚性反应容器中,测得反应过程中
投入到某刚性反应容器中,测得反应过程中 的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
①对于该可逆反应过程,下列有关说法正确的是
A.a、b、c三点时,该反应均处于平衡状态
B.m→n过程中,该反应平衡逆向移动
C.混合气体的平均摩尔质量M(b)>M(c)>M(a)
D.混合气体的密度
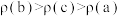
②x、y、m三点对应温度下的平衡常数由大到小的顺序为
③当温度为
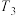 ,该反应达到平衡时,以气体分压表示的该反应的平衡常数
,该反应达到平衡时,以气体分压表示的该反应的平衡常数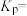
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2022-09-03更新
|
476次组卷
|
3卷引用:山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题
名校
4 . 由于雾霾严重,长沙市19年12月15、16日在部分路段施行了限行。已知汽车尾气排放出的 、
、 等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)汽车尾气中的 和
和 在一定温度和催化剂条件下可发生如下反应:
在一定温度和催化剂条件下可发生如下反应:
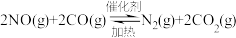

已知:① 燃烧热的
燃烧热的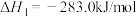
②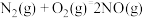
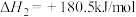 ,则
,则
__________ 。
(2)某研究小组对反应
 进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各次实验的温度可能相同,也可能不同),测定
进行多组实验(各次实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率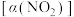 ,部分实验结果如图1所示。
,部分实验结果如图1所示。

①如果将图中 点的平衡状态改变为
点的平衡状态改变为 点的平衡状态,应采取的措施是
点的平衡状态,应采取的措施是__________ 。
②图中 、
、 两点对应的实验温度分别为
两点对应的实验温度分别为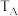 和
和 ,通过判断:
,通过判断: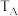
__________  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(3)工业废气也是产生雾霾的重要原因,某厂采用湿法 氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
① 水解时生成
水解时生成 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:____________________ 。
②过二硫酸钾可通过电解 溶液的方法制得。电解液中含硫微粒主要存在形式与
溶液的方法制得。电解液中含硫微粒主要存在形式与 的关系如图2所示。
的关系如图2所示。
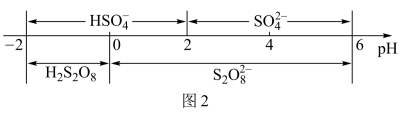
已知在阳极放电的离子主要是 ,阳极区电解质溶液的
,阳极区电解质溶液的 范围为
范围为__________ ;阳极的电极反应式为______________________________ 。
 、
、 等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。(1)汽车尾气中的
 和
和 在一定温度和催化剂条件下可发生如下反应:
在一定温度和催化剂条件下可发生如下反应: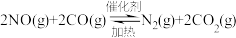

已知:①
 燃烧热的
燃烧热的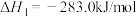
②
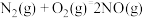
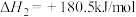 ,则
,则
(2)某研究小组对反应

 进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各次实验的温度可能相同,也可能不同),测定
进行多组实验(各次实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率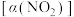 ,部分实验结果如图1所示。
,部分实验结果如图1所示。
①如果将图中
 点的平衡状态改变为
点的平衡状态改变为 点的平衡状态,应采取的措施是
点的平衡状态,应采取的措施是②图中
 、
、 两点对应的实验温度分别为
两点对应的实验温度分别为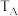 和
和 ,通过判断:
,通过判断: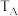
 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。(3)工业废气也是产生雾霾的重要原因,某厂采用湿法
 氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。①
 水解时生成
水解时生成 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:②过二硫酸钾可通过电解
 溶液的方法制得。电解液中含硫微粒主要存在形式与
溶液的方法制得。电解液中含硫微粒主要存在形式与 的关系如图2所示。
的关系如图2所示。
已知在阳极放电的离子主要是
 ,阳极区电解质溶液的
,阳极区电解质溶液的 范围为
范围为
您最近一年使用:0次
2021-10-12更新
|
200次组卷
|
2卷引用:山西省名校2021-2022学年高一下学期期中联合考试化学试题
解题方法
5 . (1)一定温度下,某体积不变的密闭容器进行的可逆反应: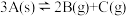 ,下列各关系中能说明反应已达到平衡状态的是
,下列各关系中能说明反应已达到平衡状态的是_________
①B的百分含量保持不变②体系的压强不再发生变化
③混合气体的平均分子量不变④混合气体的密度不变
⑤生成2n摩尔B同时生成n摩尔C
(2)一定条件下,向2L恒容密闭容器中加入3molA和1molB,发生反应 .2min末该反应达到平衡,生成
.2min末该反应达到平衡,生成 ,并测得C的浓度为0.4mol/L.请回答下列问题:
,并测得C的浓度为0.4mol/L.请回答下列问题:
①x=____________ ;
②A的平衡转化率为__________ .
(3)下列表格中的各种情况,能用图的曲线表示的是___________

(4)氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染.
已知: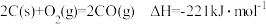
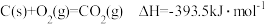
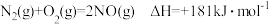
若某反应的平衡常数表达式为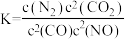 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式______________
(5)25℃时,在体积为2L的恒容密闭容器中通入 和
和 发生反应
发生反应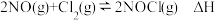 ,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图I所示,则
,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图I所示,则
_____ (填“>”“<”或“=”)0:图Ⅱ是甲、乙两同学描绘上述反应的平衡常数的对数值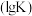 与温度的变化关系图,其中正确的曲线是
与温度的变化关系图,其中正确的曲线是_________ (填“甲”或“乙”),a值为_______________ .

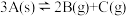 ,下列各关系中能说明反应已达到平衡状态的是
,下列各关系中能说明反应已达到平衡状态的是①B的百分含量保持不变②体系的压强不再发生变化
③混合气体的平均分子量不变④混合气体的密度不变
⑤生成2n摩尔B同时生成n摩尔C
(2)一定条件下,向2L恒容密闭容器中加入3molA和1molB,发生反应
 .2min末该反应达到平衡,生成
.2min末该反应达到平衡,生成 ,并测得C的浓度为0.4mol/L.请回答下列问题:
,并测得C的浓度为0.4mol/L.请回答下列问题:①x=
②A的平衡转化率为
(3)下列表格中的各种情况,能用图的曲线表示的是

| 反应 | 纵坐标 | 甲 | 乙 | |
| ① | 相同质量的氨,在同一容器中 | 氨气的转化率 | 400℃ | 500℃ |
| ② | 等质量钾、钠分别与足量水反应 |  质量 质量 | 钠 | 钾 |
| ③ | 在体积可变的恒压容器中,体积比1:3的 、 、 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| ④ |  和 和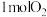 ,在相同温度 ,在相同温度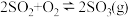 |  物质的量 物质的量 | 2个大气压 | 10个大气压 |
已知:
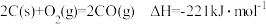
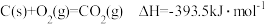
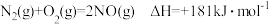
若某反应的平衡常数表达式为
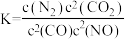 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(5)25℃时,在体积为2L的恒容密闭容器中通入
 和
和 发生反应
发生反应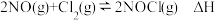 ,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图I所示,则
,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图I所示,则
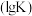 与温度的变化关系图,其中正确的曲线是
与温度的变化关系图,其中正确的曲线是
您最近一年使用:0次
名校
6 . 下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

下列说法不正确的是( )

下列说法不正确的是( )
A.通过计算,可知系统(Ⅰ)制备氢气的热化学方程式为:H2O(l)= H2(g)+1/2O2(g) ΔH = 286 kJ· mol-1 |
| B.通过计算,可知系统(Ⅱ)制备氢气的热化学方程式为:H2S(g)=H2(g)+S(s) ΔH =20kJ·mol-1 |
C.若反应H2(g)+1/2O2(g)=H2O(g) ΔH = -a kJ · mol-1, 则a>286  |
| D.制得等量H2所需能量较少的是热化学硫碘循环硫化氢分解法 |
您最近一年使用:0次
2019-08-11更新
|
964次组卷
|
4卷引用:山西省太原市2019-2020学年高二上学期期中测评化学试题
山西省太原市2019-2020学年高二上学期期中测评化学试题浙江省稽阳2018-2019学年高三联考化学试题江西省吉安市遂川中学2019—2020学年高二上学期第一次月考化学试题(B)(已下线)课时28 焓变与热化学方程式-2022年高考化学一轮复习小题多维练(全国通用)
7 . CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=______ kJ·mol−1。有利于提高CH4平衡转化率的条件是____ (填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______ mol2·L−2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
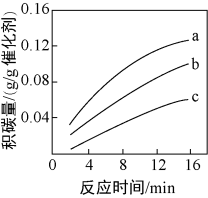
①由上表判断,催化剂X____ Y(填“优于”或“劣于”),理由是_________________ 。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________ 填标号)。

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________ 。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
| 积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
| ΔH/(kJ·mol−1) | 75 | 172 | |
| 活化能/ (kJ·mol−1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为

您最近一年使用:0次
2018-06-09更新
|
14117次组卷
|
23卷引用:【全国百强校】山西省平遥中学2018-2019学年高二上学期期中考试化学试题
【全国百强校】山西省平遥中学2018-2019学年高二上学期期中考试化学试题【全国百强校】江西省南昌市第十中学2019届高三下学期期中考试(第二次模拟)理科综合化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题青海省湟川中学2020-2021学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高二上学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合(已下线)高考母题题源14 基本概念、基本理论综合二【全国百强校】西藏自治区拉萨中学2019届高三上学期第二次月考理科综合化学试题【校级联考】江西省上饶市“山江湖”协作体2018-2019学年高二上学期第三次月考化学试题(已下线)2019年高考总复习巅峰冲刺-专题06 化学反应速率、化学平衡问题应试策略辽宁省实验中学东戴河分校2019-2020学年高二10月月考化学试题四川省宜宾市叙州区第一中学2020届高三上学期开学考试理综化学试题山东省2020届高三新高考仿真模拟化学试题(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训安徽省淮南市第一中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考安徽省临泉第一中学2020-2021学年高二上学期第三次月考化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练甘肃省临夏县中学2020-2021学年高二上学期期末考试化学试题贵州省遵义市务川县汇佳中学2020-2021学年高二下学期第三次月考化学试题(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)湖南省长沙县第九中学2021-2022学年高二上学期第二次月考化学试题
名校
解题方法
8 . 碳、氮及其化合物在生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
CH4(g) + 4NO(g) 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=____ 。
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____ (填字母)。
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA___ KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些___________ 。
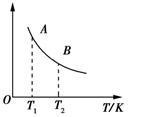
a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是____ (填字母)。
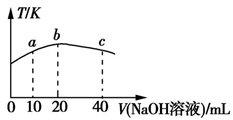
a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g)
 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;CH4(g) + 4NO(g)
 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g)
 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA

a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是

a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
您最近一年使用:0次
9 . 氮的氧化物是主要的空气污染物,目前消除氯氧化物污染的方法有多种。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:________
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=___ mol,NO2的转化率a1=_________ .其它条件不变,反应在恒压条件下进行,平衡时NO2的转化率a2____ a1(填“大于” 小于”或“ 等于” )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
①不能作为判断反应达到化学平衡状态的依据 是_________
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为_______ (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是________ 。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g) N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
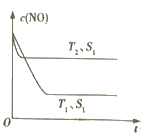
①该反应的ΔH____ 0(填“>”或“<”)。
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。____
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下| 时间 浓度(mol/L) 物质 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①不能作为判断反应达到化学平衡状态的依据 是
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的ΔH
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。
您最近一年使用:0次
名校
解题方法
10 . 天然气、煤炭气(CO、H2)的研究在世界上相当普遍。其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为:
①CH3OCH3(g)+H2O(g)⇌2CH3OH(g);△H=37kJ•mol-1
②CH3OH(g)+H2O(g)⇌3H2(g)+CO2(g);△H=49kJ•mol-1
③CO2(g)+H2(g)⇌CO(g)+H2O(g);△H=41.3kJ•mol-1
其中反应③是主要的副反应,产生的CO对燃料电池Pt电极有不利影响.
请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为______________ .
(2)CH3OCH3(g)与水蒸气制氢气的热化学方程式为______________ .
(3)下列采取的措施和解释正确的是______________ (填字母).
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在高温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,虽然对制取氢气不利,但能减少CO的产生
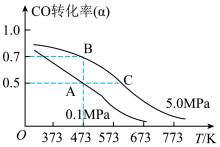
(4)煤炭气在一定条件下可合成燃料电池的另一种重要原料甲醇,反应的化学方程式为CO(g)+2H2(g)⇌CH3OH(g);△H<0.现将10mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度、压强的关系如图所示.
①自反应开始到达平衡状态所需的时间tA________ tB(填“大于”“小于”或“等于”).
②A、C两点的平衡常数KA____ KC(填“大于”“小于”或“等于”).
①CH3OCH3(g)+H2O(g)⇌2CH3OH(g);△H=37kJ•mol-1
②CH3OH(g)+H2O(g)⇌3H2(g)+CO2(g);△H=49kJ•mol-1
③CO2(g)+H2(g)⇌CO(g)+H2O(g);△H=41.3kJ•mol-1
其中反应③是主要的副反应,产生的CO对燃料电池Pt电极有不利影响.
请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为
(2)CH3OCH3(g)与水蒸气制氢气的热化学方程式为
(3)下列采取的措施和解释正确的是
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在高温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,虽然对制取氢气不利,但能减少CO的产生
(4)煤炭气在一定条件下可合成燃料电池的另一种重要原料甲醇,反应的化学方程式为CO(g)+2H2(g)⇌CH3OH(g);△H<0.现将10mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度、压强的关系如图所示.
①自反应开始到达平衡状态所需的时间tA
②A、C两点的平衡常数KA

您最近一年使用:0次



