名校
解题方法
1 . 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1
CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3
回答下列问题:
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=___________ kJ·mol-1;该反应的平衡常数K=___________ (用K1、K2、K3表示)。
(2)下列措施中,能提高(1)中CH3OCH3产率的有___________ 。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2 mol CO和0.1 mol H2O(g)通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5 min内v(H2O)=___________ ,CO的转化率α(CO)=___________ 。
(4)将合成气以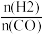 =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是___________ (填字母)。
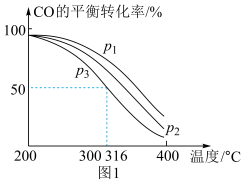
A.ΔH<0 B.p1>p2>p3 C.若在p3和316 ℃时,起始时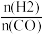 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
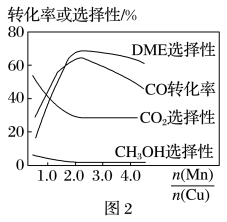
(5)采用一种新型的催化剂(主要成分是CuMn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当 约为
约为___________ 时最有利于二甲醚的合成。
①CO(g)+2H2(g)
 CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1
CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3回答下列问题:
(1)反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=(2)下列措施中,能提高(1)中CH3OCH3产率的有
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2 mol CO和0.1 mol H2O(g)通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5 min内v(H2O)=
(4)将合成气以
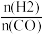 =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
A.ΔH<0 B.p1>p2>p3 C.若在p3和316 ℃时,起始时
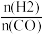 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%(5)采用一种新型的催化剂(主要成分是CuMn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当
 约为
约为
您最近一年使用:0次
2023-09-29更新
|
175次组卷
|
15卷引用:山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题
山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题山东省实验中学2019-2020学年高二上学期期中考试化学试题辽宁省六校协作体2020-2021学年高二上学期期中联考化学试题黑龙江省八校2021-2022学年高二上学期期中联合考试化学试题广东省深圳市南山为明学校2023-2024学年高二上学期期中考试化学试题广东省深圳市罗湖外语学校2023-2024学年高二上学期期中考试化学试题山东省师范大学附属中学2019-2020学年高二上学期第五次学分认定考试化学试题吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题辽宁省铁岭市六校协作体2021-2022学年高一下学期期末联考化学试题第二章化学反应速率与化学平衡湖南省衡阳市田家炳实验中学2022-2023学年高二上学期9月月考化学试题黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题重庆市璧山来凤中学2023-2024学年高二上学期9月月考化学试题陕西省西安市铁一中学2023-2024学年高二上学期期末考试化学试题湖南省长沙市周南中学2023-2024学年高二下学期第一次月考化学试题
名校
解题方法
2 . 用 和
和 的混合溶液可溶出废旧印刷电路板上的铜。已知:
的混合溶液可溶出废旧印刷电路板上的铜。已知:
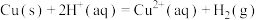
 kJ⋅mol
kJ⋅mol
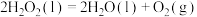
 kJ⋅mol
kJ⋅mol
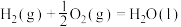
 kJ⋅mol
kJ⋅mol
在 溶液中,Cu与
溶液中,Cu与 反应生成
反应生成 和
和 的反应热
的反应热 等于
等于
 和
和 的混合溶液可溶出废旧印刷电路板上的铜。已知:
的混合溶液可溶出废旧印刷电路板上的铜。已知: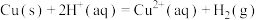
 kJ⋅mol
kJ⋅mol
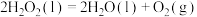
 kJ⋅mol
kJ⋅mol
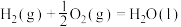
 kJ⋅mol
kJ⋅mol
在
 溶液中,Cu与
溶液中,Cu与 反应生成
反应生成 和
和 的反应热
的反应热 等于
等于A.-417.91 kJ⋅mol | B.-319.68 kJ⋅mol |
C.+546.69 kJ⋅mol | D.-448.46 kJ⋅mol |
您最近一年使用:0次
2023-06-20更新
|
298次组卷
|
62卷引用:山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题
山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题2016届江西省临川区第二中学高三上学期期中测试化学试卷2016-2017学年新疆生产建设兵团二中高二上期中化学卷陕西省西安电子科技大学附属中学2019-2020学年高二上学期期中考试化学(理)试题辽宁省朝阳市建平县实验中学2021-2022学年高二上学期期中考试化学试题辽宁省辽河油田第二高级中学2021-2022学年高二上学期期中考试化学试题新疆乌鲁木齐高级中学2022-2023学年高二上学期期中考试化学试题广东省兴宁市沐彬中学2022-2023学年高二上学期期中考试化学试题西藏昌都市第三高级中学2021-2022学年高二上学期期中考试化学试题(已下线)2013届四川省绵阳市第三次诊断性考试理综化学试卷(已下线)2014年高考化学 题型八 能量变化型专题练习卷(已下线)2015届广西桂林市第十八中学高三上学期第二次月考化学试卷(已下线)2015届广西桂林十八中高三上第二次月考化学试卷2015-2016学年安徽省合肥一中等三校高二上期末化学试卷2016-2017学年山西省大同一中高二上10月月考化学卷2017届宁夏银川二中高三上学期统练二化学试卷新疆呼图壁县第一中学2017-2018学年高二上学期期中考试化学试题甘肃省岷县二中2018-2019学年高二上学期第一次月考化学试题【全国百强校】四川省成都市双流区棠湖中学2018-2019学年高二上学期第一次月考理科综合化学试题新疆维吾尔自治区昌吉市第四中学2018-2019学年第一学期高二第一次月考化学试题吉林省乾安县第七中学2018-2019学年高一下学期第二次质量检测化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用2020届高三化学二轮冲刺新题专练——盖斯定律的应用1辽宁省丹东市2020年高三线上教学质量监测(全国II卷)理综化学试题广东省广州、深圳市学调联盟2020届高三第二次调研考试化学试题湖北省武汉市蔡甸区汉阳一中2019-2020学年高一下学期3月月考化学试题(已下线)第22讲 化学反应与能量变化-2021年高考化学一轮复习名师精讲练(已下线)1.3.1 盖斯定律(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第一章 化学反应与能量(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)江西省赣州市南康中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市一〇三中学2020-2021学年高二10月月考化学试题(已下线)1.2.2 反应热的计算 (练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山东省临沂市费县第二中学2020-2021学年高二上学期11月月考化学试题四川省乐山市2020-2021学年高二上学期期末考试化学试题河北省名校联盟2021届高三下学期开学考试(新高考)化学试题四川省乐山市峨山彝族自治县第一中学2020-2021学年高二下学期4月月考化学试题甘肃省静宁县第一中学2020-2021学年高一下学期第三次月考化学(普通班)试题(已下线)【浙江新东方】高中化学20210621-011【2021】【高三下】黑龙江省大庆中学2020-2021学年高一下学期期末考试化学试题(已下线)专题1.2 反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)1.3 化学反应热的计算-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第1章 化学反应与能量(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题江西省南昌市莲塘第一中学2021-2022学年高二上学期9月质量检测化学试题(已下线)1.2 反应热的计算(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江西省上饶市铅山县第一中学2021-2022学年高二下学期开学考试化学试题 辽宁省抚顺市第一中学2021-2022学年高一下学期6月月考化学试题河北省邢台市2021-2022学年高一下学期期末考试化学试题湖北省恩施土家族苗族自治州2021-2022学年高一下学期期末化学试题湖北省恩施州高中教育联盟2021-2022学年高一下学期期末考试化学试题(已下线)第25练 反应热的计算-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)陕西省延安市富县高级中学2021-2022学年高一下学期期末考试化学试题(B卷)江西省金溪县第一中学2023届高三上学期第一次月考化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题(已下线)第一章 化学反应的热效应(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)安徽省安庆二中2022-2023学年高一下学期5月月考化学试题上海市杨浦高级中学2023-2024学年高二下学期摸底考试(等级)化学试题
3 . 氮的氧化物是造成大气污染的主要成分之一,降低氮氧化物的排放可改善大气质量。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+181kJ•mol-1
2C(s)+O2(g)=2CO(g) △H2=-221kJ•mol-1
2NO(g)+2CO(g) N2(g)+2CO2(g) △H3=-747kJ•mol-1
N2(g)+2CO2(g) △H3=-747kJ•mol-1
碳完全燃烧时的热化学方程式为______ 。
(2)向密闭反应器中按n(NO):n(CO)=1:1投料,发生(1)中的反应③。不同温度下,反应达到平衡时,NO的平衡转化率随压强的变化曲线如图所示。
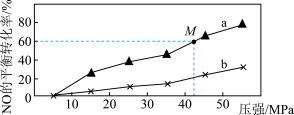
①曲线a、b对应温度较低的是______ (填“曲线a”或“曲线b”)。
②M点时混合气体的平均相对分子质量为______ (结果保留两位小数)。
(3)一定温度下,向恒容密闭容器中通入1molNO、1molCO,发生(1)中的反应③。测得容器中混合气体的压强(p)随时间(t)的变化关系如表所示。
①反应开始到刚达平衡状态的时间段内,v(CO)=______ kPa·min-1,该反应条件下的平衡常数Kp=_____ (kPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。该反应中正反应速率v正=k正·p2(NO)·p2(CO),逆反应速率v逆=k逆·p(N2)·p2(CO2),则该温度下,该反应的k正_____ (填“>”“<”或“=”)k逆。
②能判断反应已达到化学平衡状态的是______ (填字母序号)。
A.N2和CO2的浓度比保持不变 B.容器中熵值保持不变
C.2v正(NO)=v逆(N2) D.气体的密度保持不变
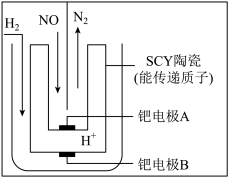
(4)工业上利用电化学方法处理NO的原理如图所示。正极的电极反应式为______ 。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+181kJ•mol-1
2C(s)+O2(g)=2CO(g) △H2=-221kJ•mol-1
2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H3=-747kJ•mol-1
N2(g)+2CO2(g) △H3=-747kJ•mol-1碳完全燃烧时的热化学方程式为
(2)向密闭反应器中按n(NO):n(CO)=1:1投料,发生(1)中的反应③。不同温度下,反应达到平衡时,NO的平衡转化率随压强的变化曲线如图所示。

①曲线a、b对应温度较低的是
②M点时混合气体的平均相对分子质量为
(3)一定温度下,向恒容密闭容器中通入1molNO、1molCO,发生(1)中的反应③。测得容器中混合气体的压强(p)随时间(t)的变化关系如表所示。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| p/kPa | 200 | 185 | 173 | 165 | 160 | 160 |
②能判断反应已达到化学平衡状态的是
A.N2和CO2的浓度比保持不变 B.容器中熵值保持不变
C.2v正(NO)=v逆(N2) D.气体的密度保持不变
(4)工业上利用电化学方法处理NO的原理如图所示。正极的电极反应式为

您最近一年使用:0次
2023-05-16更新
|
310次组卷
|
3卷引用:山西省吕梁市孝义市2022-2023学年高二下学期期中考试化学试题
4 . 甲烷及其衍生物在国民经济中有着重要的作用。回答下列问题:
(1)研究表明 与
与 在催化剂存在下可发生反应制得合成气:
在催化剂存在下可发生反应制得合成气:

已知:①
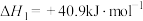
②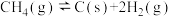
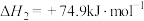
③
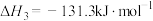
则上述制取合成气反应的
_______  ,利于反应自发进行的条件是
,利于反应自发进行的条件是_______ (填“高温”或“低温”)。
(2)在T℃,向VL体积恒定的密闭容器中,充入10mol 和15mol
和15mol 发生反应
发生反应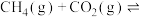
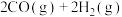 。
。
①为了加快该反应的速率,下列措施可行的是_______ (填字母)。
A.按原比例充入 、
、 B.缩小容器体积
B.缩小容器体积
C.增大反应物与催化剂的接触面积 D.移出产物CO、
②起始时容器内的总压强为25kPa,测得t min后反应达到平衡, 的平衡转化率为60%。则从起始到平衡反应的平均速率
的平衡转化率为60%。则从起始到平衡反应的平均速率
_______  ,在该温度下反应的平衡常数
,在该温度下反应的平衡常数
_______ ( 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
(3)下列能说明反应达到平衡状态的是_______(填字母)。
(4)甲醇是重要的化工原料。利用CO与 合成甲醇,其反应的化学方程式为
合成甲醇,其反应的化学方程式为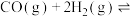
 。在一容积可变的密闭容器中按一定的投料比充入CO与
。在一容积可变的密闭容器中按一定的投料比充入CO与 ,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
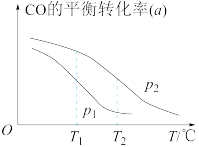
①该反应平衡常数大小: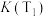
_______ 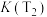 (填“>”或“<”)。
(填“>”或“<”)。
②图中压强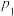
_______  (填“>”或“<”)。
(填“>”或“<”)。
(1)研究表明
 与
与 在催化剂存在下可发生反应制得合成气:
在催化剂存在下可发生反应制得合成气:

已知:①

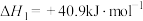
②
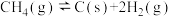
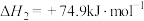
③

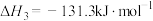
则上述制取合成气反应的

 ,利于反应自发进行的条件是
,利于反应自发进行的条件是(2)在T℃,向VL体积恒定的密闭容器中,充入10mol
 和15mol
和15mol 发生反应
发生反应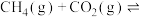
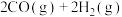 。
。①为了加快该反应的速率,下列措施可行的是
A.按原比例充入
 、
、 B.缩小容器体积
B.缩小容器体积C.增大反应物与催化剂的接触面积 D.移出产物CO、

②起始时容器内的总压强为25kPa,测得t min后反应达到平衡,
 的平衡转化率为60%。则从起始到平衡反应的平均速率
的平衡转化率为60%。则从起始到平衡反应的平均速率
 ,在该温度下反应的平衡常数
,在该温度下反应的平衡常数
 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。(3)下列能说明反应达到平衡状态的是_______(填字母)。
| A.混合气体的密度保持不变 |
B. 的物质的量保持不变 的物质的量保持不变 |
| C.容器内混合气体原子总数不变 |
D.每生成1molCO的同时消耗1mol |
 合成甲醇,其反应的化学方程式为
合成甲醇,其反应的化学方程式为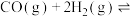
 。在一容积可变的密闭容器中按一定的投料比充入CO与
。在一容积可变的密闭容器中按一定的投料比充入CO与 ,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
①该反应平衡常数大小:
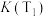
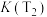 (填“>”或“<”)。
(填“>”或“<”)。②图中压强
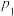
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
5 . 接触法制硫酸生产中的关键工序是SO2的催化氧化:2SO2(g)+O2(g)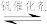 2SO3(g) △H=-196kJ·mol-1。钒催化剂参与反应的能量变化如图所示。下列说法正确的是
2SO3(g) △H=-196kJ·mol-1。钒催化剂参与反应的能量变化如图所示。下列说法正确的是
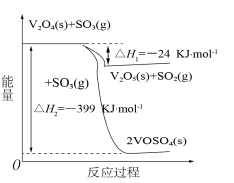
 2SO3(g) △H=-196kJ·mol-1。钒催化剂参与反应的能量变化如图所示。下列说法正确的是
2SO3(g) △H=-196kJ·mol-1。钒催化剂参与反应的能量变化如图所示。下列说法正确的是
| A.钒催化剂改变了SO2催化氧化的反应热 |
| B.上述条件下加入2molSO2和1molO2发生反应,释放的能量等于196kJ |
| C.1molV2O4(s)的能量比2mol VOSO4(s)的能量多399kJ |
| D.2V2O5(s)+2SO2(g)=2VOSO4(s)+V2O4(s) △H=-351kJ·mol-1 |
您最近一年使用:0次
2021-11-14更新
|
315次组卷
|
3卷引用:山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题
名校
6 . 根据下列热化学方程式
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
| A.△H=+244.1 kJ·mol-1 | B.△H=-488.3 kJ·mol-1 |
| C.△H=-996.6 kJ·mol-1 | D.△H=+996.6 kJ·mol-1 |
您最近一年使用:0次
2019-05-06更新
|
276次组卷
|
3卷引用:山西省吕梁市汾阳中学、孝义中学、文水中学2020-2021学年高二上学期期中测评考试化学试题
7 . 已知下列热化学方程式
(1)C(s)+1/2O2(g)===CO(g) △H1=-110.5kJ/mol
(2)2H2(g)+O2(g)===2H2O(g) △H2=-483.6 kJ/mol
由此可知 C(s)+H2O(g) ===CO(g)+H2(g)ΔH3 ,则ΔH3等于
(1)C(s)+1/2O2(g)===CO(g) △H1=-110.5kJ/mol
(2)2H2(g)+O2(g)===2H2O(g) △H2=-483.6 kJ/mol
由此可知 C(s)+H2O(g) ===CO(g)+H2(g)ΔH3 ,则ΔH3等于
| A.+131.3 kJ/mol | B.+373.1 kJ/mol |
| C.-131.3 kJ/mol | D.-373.1 kJ/mol |
您最近一年使用:0次
2018-11-29更新
|
132次组卷
|
6卷引用:山西省吕梁市高级中学2018-2019学年高二上学期期中考试化学试题
山西省吕梁市高级中学2018-2019学年高二上学期期中考试化学试题(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2012-2013学年福建省三明一中高二第一次月考化学试卷2014-2015甘肃省白银市会宁县五中高二上学期期末化学试卷河北省石家庄市元氏县第四中学2020-2021学年高二上学期第一次月考化学试题贵州省安顺市平坝第一高级中学2020-2021学年高二上学期9月月考化学试题
名校
解题方法
8 . 肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g) =N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g) = N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式______________ ;
(2)上述反应中氧化剂是______________ 。
(3)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4 (g)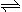 2NO2 (g)
2NO2 (g)
① 上述反应的ΔH_________ 0(选填“>”或“<”)。
② 保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,再次达到平衡时,混合气体中NO2的体积分数_______ (填“增大”、“ 减小”或“不变”),混合气体的颜色_______ (填“变深”或“变浅”)。
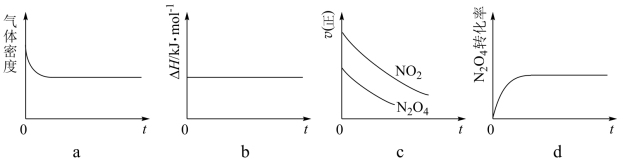
③一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是___________ 。
④若在相同温度下,上述反应改在体积为10L的恒容密闭容器中进行,反应3s后NO2的物质的量为0.6mol,则0-3s内的平均反应速率v(N2O4)=___________ mol·L-1·s-1。
①N2(g)+2O2(g) =N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g) = N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式
(2)上述反应中氧化剂是
(3)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4 (g)
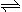 2NO2 (g)
2NO2 (g)① 上述反应的ΔH
② 保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,再次达到平衡时,混合气体中NO2的体积分数
③一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是

④若在相同温度下,上述反应改在体积为10L的恒容密闭容器中进行,反应3s后NO2的物质的量为0.6mol,则0-3s内的平均反应速率v(N2O4)=
您最近一年使用:0次



