1 . 在“碳达峰、碳中和”的目标引领下,减少 排放实现
排放实现 的有效转化成为科研工作者的研究热点。根据以下几种常见的
的有效转化成为科研工作者的研究热点。根据以下几种常见的 利用方法,回答下列问题。
利用方法,回答下列问题。
I.以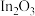 作催化剂,采用“
作催化剂,采用“ 催化加氢制甲醇”方法将其资源化利用。反应历程如下:
催化加氢制甲醇”方法将其资源化利用。反应历程如下:
i.催化剂活化: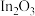 (无活性)
(无活性)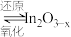 (有活性);
(有活性);
ii. 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:
①主反应:
 ,
,
②副反应:
 。
。
(1)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是_______(填序号)。
(2)a. 选择性随气体流速增大而升高的原因可能是
选择性随气体流速增大而升高的原因可能是_______ 。(已知: 选择性
选择性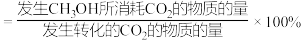 )
)
b.某温度下, 与
与 的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中
的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中 的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:
的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:_______ 。
(3)反应①、②的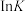 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。

升高温度,反应 的化学平衡常数
的化学平衡常数_______ (填“增大”或“减小”或“不变”)。
(4)恒温恒压密闭容器中,加入2mol 和4mol
和4mol ,只发生反应①和反应②,初始压强为
,只发生反应①和反应②,初始压强为 。
。
a.在230℃以上,升高温度 的平衡转化率增大,但甲醇的产率降低,原因是
的平衡转化率增大,但甲醇的产率降低,原因是_______ 。
b.在300℃发生反应,反应达平衡时, 的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=
的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=_______ (保留两位有效数字)。
II.利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
i.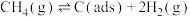
ii.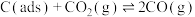
上述反应中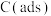 为吸附活性炭,反应历程的能量变化如图1所示:
为吸附活性炭,反应历程的能量变化如图1所示:

(5) 干重整反应的速率由决定
干重整反应的速率由决定_______ (填“反应i”或“反应ⅱ”), 干重整反应的热化方程式为
干重整反应的热化方程式为_______ 。(选取图1中 、
、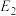 、
、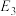 表示反应热)。
表示反应热)。
 排放实现
排放实现 的有效转化成为科研工作者的研究热点。根据以下几种常见的
的有效转化成为科研工作者的研究热点。根据以下几种常见的 利用方法,回答下列问题。
利用方法,回答下列问题。I.以
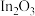 作催化剂,采用“
作催化剂,采用“ 催化加氢制甲醇”方法将其资源化利用。反应历程如下:
催化加氢制甲醇”方法将其资源化利用。反应历程如下:i.催化剂活化:
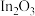 (无活性)
(无活性)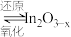 (有活性);
(有活性);ii.
 与
与 在活化的催化剂表面同时发生如下反应:
在活化的催化剂表面同时发生如下反应:①主反应:

 ,
,②副反应:

 。
。(1)某温度下,在恒容反应器中,能说明反应①达到平衡状态的是_______(填序号)。
A.分别用 和 和 表示的速率之比为3:1 表示的速率之比为3:1 |
| B.混合气体的平均摩尔质量不变 |
| C.混合气体的密度不变 |
D. 和 和 的分压之比不变 的分压之比不变 |
 选择性随气体流速增大而升高的原因可能是
选择性随气体流速增大而升高的原因可能是 选择性
选择性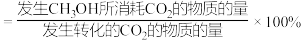 )
)b.某温度下,
 与
与 的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中
的混合气体以不同流速通过恒容反应器。气体流速增大可减少产物中 的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:
的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:(3)反应①、②的
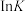 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
升高温度,反应
 的化学平衡常数
的化学平衡常数(4)恒温恒压密闭容器中,加入2mol
 和4mol
和4mol ,只发生反应①和反应②,初始压强为
,只发生反应①和反应②,初始压强为 。
。a.在230℃以上,升高温度
 的平衡转化率增大,但甲醇的产率降低,原因是
的平衡转化率增大,但甲醇的产率降低,原因是b.在300℃发生反应,反应达平衡时,
 的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=
的转化率为50%,容器体积减小20%。则反应②用平衡分压表示的平衡常数Kp=II.利用干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
i.
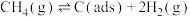
ii.
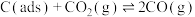
上述反应中
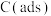 为吸附活性炭,反应历程的能量变化如图1所示:
为吸附活性炭,反应历程的能量变化如图1所示:
(5)
 干重整反应的速率由决定
干重整反应的速率由决定 干重整反应的热化方程式为
干重整反应的热化方程式为 、
、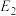 、
、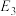 表示反应热)。
表示反应热)。
您最近一年使用:0次
2 . 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。
已知:反应1: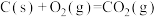

反应2: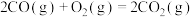
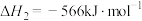
反应3: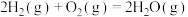
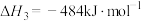
(1)①相同质量的C、CO和 完全燃烧时放出的热量由大到小的顺序为
完全燃烧时放出的热量由大到小的顺序为_______ (用化学式表示)。
②25℃,101kPa时,若断裂1mol O=O,1mol C=O需要吸收的能量分别为495kJ、799kJ,则断裂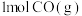 分子中的碳氧键需要吸收的热量为
分子中的碳氧键需要吸收的热量为_______ kJ。
(2)水煤气反应: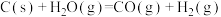
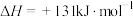 。
。
①工业生产水煤气时,通常交替通入 适量的空气和水蒸气与煤炭反应,其理由是_______ 。
②将煤先转化为水煤气再完全燃烧整个过程的热效应与煤直接完全燃烧的热效应_______ (填“相等”或“不相等”)。
(3)一氧化碳变换反应: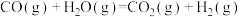
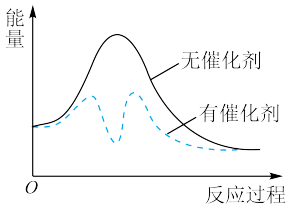
 。以固体催化剂M催化变换反应,反应历程分两步完成,能量-反应过程如图所示。
。以固体催化剂M催化变换反应,反应历程分两步完成,能量-反应过程如图所示。
①
_______  。
。
②用两个化学方程式表示该反应历程:
步骤I: 步骤II:
步骤II:_______ 。
③从图中可以看出加入催化剂能够加快反应速率的原因是_______ 。
已知:反应1:
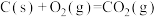

反应2:
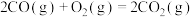
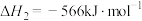
反应3:
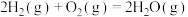
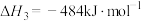
(1)①相同质量的C、CO和
 完全燃烧时放出的热量由大到小的顺序为
完全燃烧时放出的热量由大到小的顺序为②25℃,101kPa时,若断裂1mol O=O,1mol C=O需要吸收的能量分别为495kJ、799kJ,则断裂
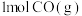 分子中的碳氧键需要吸收的热量为
分子中的碳氧键需要吸收的热量为(2)水煤气反应:
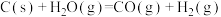
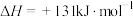 。
。①工业生产水煤气时,通常
②将煤先转化为水煤气再完全燃烧整个过程的热效应与煤直接完全燃烧的热效应
(3)一氧化碳变换反应:
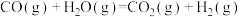
 。以固体催化剂M催化变换反应,反应历程分两步完成,能量-反应过程如图所示。
。以固体催化剂M催化变换反应,反应历程分两步完成,能量-反应过程如图所示。
①

 。
。②用两个化学方程式表示该反应历程:
步骤I:
 步骤II:
步骤II:③从图中可以看出加入催化剂能够加快反应速率的原因是
您最近一年使用:0次
2022-11-16更新
|
126次组卷
|
2卷引用:山西省运城市教育发展联盟2022-2023学年高二上学期11月期中考试化学试题
名校
3 . 我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是
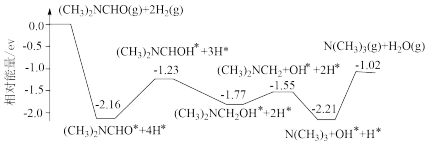

| A.该历程中最小能垒的化学方程式为 (CH3)2NCH2OH*=(CH3)2NCH2+OH* |
| B.该历程中最大能垒(活化能)为2.16eV |
| C.该反应热化学方程式为(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02ev•mol-1 |
| D.增大压强或升高温度均能加快反应速率,并增大DMF平衡转化率 |
您最近一年使用:0次
2022-08-24更新
|
778次组卷
|
29卷引用:山西省运城市教育发展联盟2021-2022学年高二上学期11月期中检测化学试题
山西省运城市教育发展联盟2021-2022学年高二上学期11月期中检测化学试题浙江省杭州第二中学2021届高三上学期期中考试化学试题辽宁省大连市第一中学 2021-2022学年高三上学期期中联考化学试题辽宁省大连市普兰店区第一中学2022届高三上学期期中联考化学试题湖南省株洲市第二中学2022-2023学年高二上学期期中考试化学试题湖南省株洲南方中学2022-2023学年高二上学期期中考试化学试题山东省青岛第二中学2021-2022学年高二上学期期中考试化学试题山东省德州市实验中学2023-2024学年高二上学期期中考试 化学试题山东省威海市2020届高三年级高考模拟考(二模)化学试题(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编河北省张家口市宣化一中2020-2021学年高二下学期期初考试化学试题(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)浙江省绍兴市第一中学2020-2021学年高三1月高考适应性考试化学试题(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏伽德罗常数-备战2021年高考化学临考题号押题(课标全国卷)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)湖南省长沙市雅礼中学2021-2022学年高三上学期月考卷(三)化学试题河南省顶尖名校联盟2021-2022学年高二下学期联赛考试化学试题(已下线)卷04 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)2022年湖南卷高考真题变式题(11-14)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)湖南省邵阳市第二中学2022届高三下学期全真模拟考试化学试题(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用北京市第二十中学2022-2023学年高三下学期开学检测化学试题(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)福建省南安市华侨中学2023-2024学年高二上学期10月月考化学试题福建省德化一中、永安一中、漳平一中三校协作2023-2024学年高二上学期12月联考化学试题(已下线)广西“贵百河”2023-2024学年高二上学期12月份联考化学试题
名校
4 . 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g) CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=___ kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___ kJ·mol-1。
(2)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:
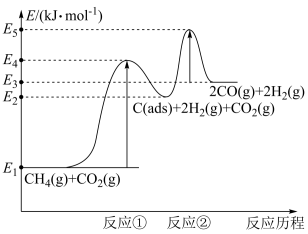
CH4与CO2制备合成气的热化学方程式为__ 。
(3)利用铜基配合物1,10—phenanthroline—Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。
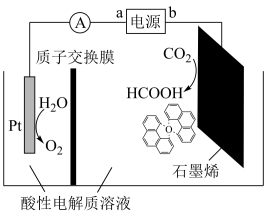
①电池工作过程中,图中Pt电极附近溶液的pH__ (填“变大”或“变小”),阴极的电极反应式为___ 。
②每转移2mol电子,阴极室溶液质量增加___ g。
(4)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
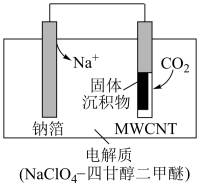
①放电时,正极的电极反应式为___ 。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol电子时,两极的质量差为___ g。(假设放电前两电极质量相等)
①CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2③CO2(g)+H2(g)
 CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:

CH4与CO2制备合成气的热化学方程式为
(3)利用铜基配合物1,10—phenanthroline—Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。

①电池工作过程中,图中Pt电极附近溶液的pH
②每转移2mol电子,阴极室溶液质量增加
(4)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
①放电时,正极的电极反应式为
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol电子时,两极的质量差为
您最近一年使用:0次
2021-10-18更新
|
114次组卷
|
2卷引用:山西省运城市2021-2022学年高三上学期期中考试化学试题
名校
5 . 由于雾霾严重,长沙市19年12月15、16日在部分路段施行了限行。已知汽车尾气排放出的 、
、 等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)汽车尾气中的 和
和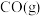 在一定温度和催化剂条件下可发生如下反应:
在一定温度和催化剂条件下可发生如下反应:
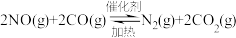

已知:① 燃烧热的
燃烧热的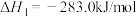
②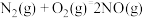
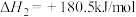 ,则
,则
__________ 。
(2)某研究小组对反应
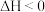 进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各次实验的温度可能相同,也可能不同),测定
进行多组实验(各次实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率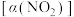 ,部分实验结果如图1所示。
,部分实验结果如图1所示。

①如果将图中 点的平衡状态改变为
点的平衡状态改变为 点的平衡状态,应采取的措施是
点的平衡状态,应采取的措施是__________ 。
②图中 、
、 两点对应的实验温度分别为
两点对应的实验温度分别为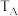 和
和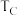 ,通过判断:
,通过判断: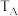
__________ 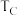 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(3)工业废气也是产生雾霾的重要原因,某厂采用湿法 氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
① 水解时生成
水解时生成 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:____________________ 。
②过二硫酸钾可通过电解 溶液的方法制得。电解液中含硫微粒主要存在形式与
溶液的方法制得。电解液中含硫微粒主要存在形式与 的关系如图2所示。
的关系如图2所示。
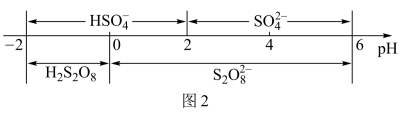
已知在阳极放电的离子主要是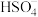 ,阳极区电解质溶液的
,阳极区电解质溶液的 范围为
范围为__________ ;阳极的电极反应式为______________________________ 。
 、
、 等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。(1)汽车尾气中的
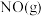 和
和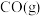 在一定温度和催化剂条件下可发生如下反应:
在一定温度和催化剂条件下可发生如下反应: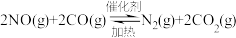

已知:①
 燃烧热的
燃烧热的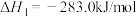
②
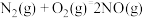
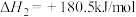 ,则
,则
(2)某研究小组对反应

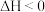 进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各次实验的温度可能相同,也可能不同),测定
进行多组实验(各次实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率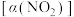 ,部分实验结果如图1所示。
,部分实验结果如图1所示。
①如果将图中
 点的平衡状态改变为
点的平衡状态改变为 点的平衡状态,应采取的措施是
点的平衡状态,应采取的措施是②图中
 、
、 两点对应的实验温度分别为
两点对应的实验温度分别为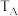 和
和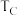 ,通过判断:
,通过判断: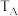
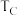 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。(3)工业废气也是产生雾霾的重要原因,某厂采用湿法
 氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。①
 水解时生成
水解时生成 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:②过二硫酸钾可通过电解
 溶液的方法制得。电解液中含硫微粒主要存在形式与
溶液的方法制得。电解液中含硫微粒主要存在形式与 的关系如图2所示。
的关系如图2所示。
已知在阳极放电的离子主要是
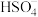 ,阳极区电解质溶液的
,阳极区电解质溶液的 范围为
范围为
您最近一年使用:0次
2021-10-12更新
|
200次组卷
|
2卷引用:山西省名校2021-2022学年高一下学期期中联合考试化学试题
名校
解题方法
6 . (1)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
①在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为__________________________ 。
②甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
a.CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
b.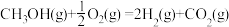 △H2
△H2
已知H2(g)+ O2(g)
O2(g)  H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
则反应②的△H2=_________ kJ·mol-1。
(2)工业上一般可采用下列反应来合成甲醇:CO(g)+2H2(g)⇌CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线。
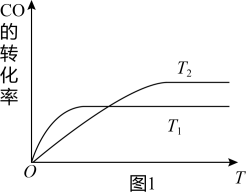

①该反应的焓变△H_____ 0(填“>”“<”或“=”).
②T1和T2温度下的平衡常数大小关系是K1_____ K2(填“>”“<”或“=”)
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)=_____ ,该反应的平衡常数为K=_____ 。
④恒容条件下,达到平衡后,下列措施中能使 增大的有
增大的有_____ 。
A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
①在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
②甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
a.CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
CO2(g)+3H2(g) △H1=+49.0kJ·mol—1b.
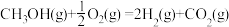 △H2
△H2已知H2(g)+
 O2(g)
O2(g)  H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1则反应②的△H2=
(2)工业上一般可采用下列反应来合成甲醇:CO(g)+2H2(g)⇌CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线。


①该反应的焓变△H
②T1和T2温度下的平衡常数大小关系是K1
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)=
④恒容条件下,达到平衡后,下列措施中能使
 增大的有
增大的有A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
您最近一年使用:0次
2017-12-05更新
|
236次组卷
|
3卷引用:山西省运城中学、芮城中学2017-2018学年高二上学期期中联考化学试题
7 . 氮的氧化物是主要的空气污染物,目前消除氯氧化物污染的方法有多种。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:________
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=___ mol,NO2的转化率a1=_________ .其它条件不变,反应在恒压条件下进行,平衡时NO2的转化率a2____ a1(填“大于” 小于”或“ 等于” )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
①不能作为判断反应达到化学平衡状态的依据 是_________
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为_______ (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是________ 。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g) N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
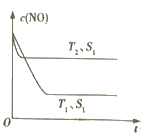
①该反应的ΔH____ 0(填“>”或“<”)。
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。____
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下| 时间 浓度(mol/L) 物质 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①不能作为判断反应达到化学平衡状态的依据 是
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的ΔH
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。
您最近一年使用:0次



