山西省吕梁市汾阳中学、孝义中学、文水中学2020-2021学年高二上学期期中测评考试化学试题
山西
高二
期中
2021-01-04
174次
整体难度:
容易
考查范围:
化学反应原理、认识化学科学
一、单选题 添加题型下试题
| A.铁管的生锈属于氧化反应 |
| B.催化剂不能完全消除汽车尾气的污染 |
| C.调整反应条件无法使可逆反应正向进行到底 |
| D.化学反应速率越快,可逆反应正向进行的程度越大 |
【知识点】 化学平衡的移动及其影响因素 可逆反应及反应限度解读
| A.1.0×10-8 mol·L-1 | B.1.0×10-7 mol·L-1 | C.1.0×10-6 mol·L-1 | D.无法确定 |
【知识点】 水的电离 水溶液中水的电离程度及的计算解读
 2NO2 △H>0中N2O4,的平衡浓度与温度的关系曲线,下列有关说法正确的是
2NO2 △H>0中N2O4,的平衡浓度与温度的关系曲线,下列有关说法正确的是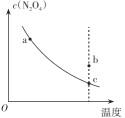
| A.逆反应速率:c点<a点 | B.b点所处状态的v(正)>v(逆) |
| C.N2O4的转化率:c点<a点 | D.化学平衡常数:b点>c点 |
| A.放热反应的速率一定比吸热反应快 | B.合适的催化剂能将放热反应转化为吸热反应 |
| C.化学反应一定伴随着能量的变化 | D.吸热反应的逆反应也可能为吸热反应 |
 CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s) Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,则下列说法正确的是
Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,则下列说法正确的是A.K1=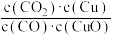 | B.反应②的逆反应的平衡常数K′=-K2 |
| C.若反应②为放热反应,则升温时K2减小 | D.恒温时增大H2的浓度,K1将减小 |
A.H+、Cu2+、 、 、 | B.Cl-、Na+、 、Ba2+ 、Ba2+ |
C.K+、 、 、 、Cl- 、Cl- | D. 、 、 、K+、Na+ 、K+、Na+ |
【知识点】 离子共存 限定条件下的离子共存解读 影响水电离的因素解读
A.2H2O 2H2↑+O2↑与2H2+O2 2H2↑+O2↑与2H2+O2 2H2O互为可逆反应 2H2O互为可逆反应 |
| B.向新制氯水中加入少量石灰石固体可提高其漂白能力 |
| C.向稀氨水中加入少量水,溶液的导电能力增强 |
D.恒容密闭容器中发生反应4NH3+5O2 4NO+6H2O,充入少量N2可加快反应速率 4NO+6H2O,充入少量N2可加快反应速率 |
A.Ca(NO3)2=Ca2++2 | B.H2O+H2O H3O++OH- H3O++OH- |
C.H2S 2H++S2- 2H++S2- | D.KOH=K++OH- |
【知识点】 电离方程式解读 弱电解质的电离方程式解读
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1
下列说法错误的是
| A.CH3OH(l)的燃烧热为726 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,CH3OH(l)放出的热量多 |
C. H2SO4(aq)+ H2SO4(aq)+ Ba(OH)2(aq)= Ba(OH)2(aq)= BaSO4(s)+H2O(l) △H≠-57.3 kJ·mol-1 BaSO4(s)+H2O(l) △H≠-57.3 kJ·mol-1 |
| D.2 mol H2(g)和1 mol O2(g)的总能量大于2 mol H2O(l)的总能量 |
 2C(g)达到化学平衡状态的是
2C(g)达到化学平衡状态的是| A.容器内气体的压强不随时间而变化 |
| B.容器内气体的密度不随时间而变化 |
| C.单位时间内生成1 mol C(g)的同时消耗1 mol B(g) |
| D.A(g)、B(g)、C(g)的物质的量之比为1∶2∶2 |
【知识点】 化学平衡状态的判断方法解读
| A.溶液的质量变小 | B.溶液pH不变 | C.溶液底部存在固体 | D.溶液中离子数目不变 |
【知识点】 溶解度、饱和溶液的概念解读 溶液的酸碱性与pH
| A.自发反应可能放热也可能吸热 |
| B.熵增的反应不一定为自发反应 |
| C.自发反应可能需要一定条件引发才能发生 |
| D.焓增同时熵减的反应一定是自发反应 |
二、多选题 添加题型下试题
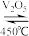 2SO3(g),某小组研究了在其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g),某小组研究了在其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是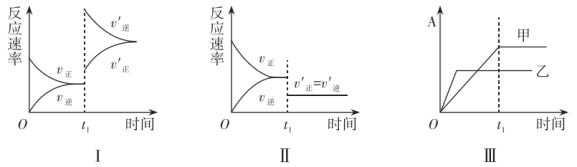
| A.图I表示的是t1时刻升温对反应速率的影响 |
| B.图II表示的是t1时刻撤去催化剂V2O5后对反应速率的影响 |
| C.图III可以表示催化剂对化学平衡的影响,且乙的催化效率比甲高 |
| D.图III表示的是压强对化学平衡的影响,且A表示的是SO2的转化率 |
三、单选题 添加题型下试题
 2Z(g) △H=-196.64 kJ·mol-1,反应达到化学平衡状态后测得共放出314.624 kJ热量,则X的转化率为
2Z(g) △H=-196.64 kJ·mol-1,反应达到化学平衡状态后测得共放出314.624 kJ热量,则X的转化率为| A.30% | B.50% | C.64% | D.80% |
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
| A.△H=+244.1 kJ·mol-1 | B.△H=-488.3 kJ·mol-1 |
| C.△H=-996.6 kJ·mol-1 | D.△H=+996.6 kJ·mol-1 |
【知识点】 化学反应热的计算 盖斯定律与热化学方程式解读
H2(g)+Cl2(g)=2HCl(l) △H1
H2(l)+Cl2(l)=2HCl(g) △H2
有关上述反应的叙述正确的是
| A.△H1>△H2 |
| B.两反应的生成物总能量均低于反应物总能量 |
| C.生成1 mol HCl(g)时放出的热量多于生成1 mol HCl(l)时放出的热量 |
| D.1 mol HCl(g)具有的能量小于1 mol HCl(l)具有的能量 |
【知识点】 焓变产生原因及表示解读 反应焓变与热化学方程式的关系解读
| A.HA在水溶液中部分电离 | B.加水时,HA的电离程度增大 |
| C.升高温度,溶液的pH增大 | D.此溶液中由水电离出的c(H+)约为1.0×10-10 mol·L-1 |
 2N2(g)+6H2O(g),在下列四种不同情况下的反应速率最快的是
2N2(g)+6H2O(g),在下列四种不同情况下的反应速率最快的是| A.v(NH3)=0.2 mol·L-1·min-1 | B.v(O2)=0.3 mol·L-1·min-1 |
| C.v(N2)=0.1 mol·L-1·min-1 | D.v(H2O)=0.3 mol·L-1·min-1 |
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸稀溶液中既存在醋酸分子又存在醋酸根离子;
④常温下,0.1 mol·L-1醋酸的pH比0.1 mol·L-1盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2
| A.②③ | B.①④ | C.③④ | D.②⑤ |
【知识点】 强电解质和弱电解质的判断
| A.配制标准溶液的固体NaOH中混有少量KOH杂质 |
| B.滴定终点读数时,俯视滴定管的刻度,其他操作正确 |
| C.盛装待测硝酸的锥形瓶用蒸馏水洗涤后未干燥 |
| D.滴定到终点读数时,发现滴定管尖嘴内存在气泡 |
【知识点】 酸碱中和滴定的误差分析解读
四、填空题 添加题型下试题
(1)冰箱能够在一定时间内保鲜食物,原因是
(2)乳酸饮料(含乳酸
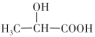 )显酸性的原因是
)显酸性的原因是(3)工业上合成氨气时总是及时分离出反应器中的氨气,这样做的原因是
(4)燃气灶具进风口通入的空气总是适当过量,这是为了
(5)接近沸腾的纯净水pH<7,原因是
五、解答题 添加题型下试题
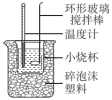
(1)装置中明显的错误之处为
(2)取50 mL NaOH溶液和50 mL硝酸溶液进行实验,实验数据如下表。请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2−t1)/℃ | ||
HNO3 | NaOH | 平均值 | |||
1 | 26.3 | 26.1 | 26.2 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 30.4 | |
3 | 25.9 | 25.9 | 25.9 | 28.9 | |
(4)上述实验数值结果与57.3 kJ∙mol−1有偏差,产生偏差的原因可能是
a.倾倒硝酸时少量硝酸溅出 b.小烧杯实验前充分干燥 c.仰视读取反应后温度计的示数
(5)实验中若改用50 mL 0.70 mol∙L−1 NaOH溶液和50 mL 0.65 mol∙L−1硝酸溶液进行实验,测得的“温度差平均值”
六、填空题 添加题型下试题
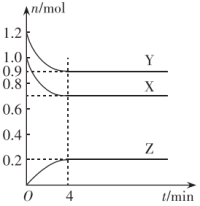
(1)该反应的化学方程式为
(2)反应开始至4 min末,用气体Y表示反应的平均速率为
(3)若X、Y、Z均为气体,反应达到平衡时:
①容器内反应达到平衡时的压强与起始时的压强之比为
②若此时将容器的体积缩小,达到平衡时,容器内温度降低(容器不与外界进行热交换),则该反应的正反应为
(4)若上述反应在4 min后的t1~t5内反应速率与反应时间的关系如图,在每一时刻均改变一个影响反应速率的因素,则下列判断错误的是

A.t1时可能是升高了容器内的温度 B.t2时Y的转化率大于t1时Y的转化率
C.t3时可能加入了适量的X或Y D.t4时正反应的速率小于t2时正反应的速率
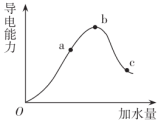
(1)Oa段溶液的导电能力逐渐增强的原因是
(2)c点溶液的pH
(3)a点溶液中H+的物质的量
(4)若使c点溶液中的c(CH3COO-)减小,可以采取下列措施中的
A.加水 B.通入HCl(g) C.加入锌粒
七、解答题 添加题型下试题
 3B(g)+C(?)的能量变化如图所示。
3B(g)+C(?)的能量变化如图所示。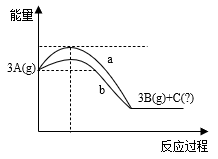
则3A(g)
 3B(g)+C(?)的正反应是
3B(g)+C(?)的正反应是(2)在密闭恒容容器中,充入一定量的A发生反应3A(g)
 3B(g)+C(?)。
3B(g)+C(?)。①容器中气体的平均相对分子质量随时间的变化如图所示:
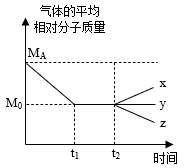
则下列有关C物质的状态的判断正确的是
a.可能为气态 b.一定为气态 c.一定为非气态
②若t2时刻只扩大容器的体积,容器中气体的平均相对分子质量变化符合z线,则C物质的状态为
(3)在汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无害物质,减少污染。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221.0 kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
试计算尾气转化的反应之一:2NO(g)+2CO(g)
 N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=(1)在体积为1 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:T/℃ | 700 | 800 | 850 | 1000 |
K | 0.6 | 0.9 | 1.0 | 1.7 |
此反应的正反应为
(2)下表列出了苯酚(C6H5OH)、H2CO3两种弱电解质的电离平衡常数,请根据表中的数据回答:
弱酸 | 苯酚 | H2CO3 |
电离平衡常数 (25℃) | Ka=1.1×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①已知常温下苯酚在水中的溶解度不大,与水混合振荡形成乳浊液。又知苯酚具有弱酸性,其电离方程式为C6H5OH
 C6H5O-+H+。若向苯酚和水形成的乳浊液中加入适量Na2CO3固体,乳浊液
C6H5O-+H+。若向苯酚和水形成的乳浊液中加入适量Na2CO3固体,乳浊液②适当升温时,H2CO3的Ka1
试卷分析
试卷题型(共 26题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 化学平衡的移动及其影响因素 可逆反应及反应限度 | |
| 2 | 0.85 | 水的电离 水溶液中水的电离程度及的计算 | |
| 3 | 0.65 | 温度对化学反应速率的影响 化学平衡图像分析 化学平衡常数的影响因素及应用 转化率的相关计算及判断 | |
| 4 | 0.94 | 化学反应中能量变化的原因 焓变 吸热反应和放热反应 催化剂对化学反应速率的影响 | |
| 5 | 0.85 | 化学平衡常数的概念及表达方式 化学平衡常数的影响因素及应用 | |
| 6 | 0.65 | 离子共存 限定条件下的离子共存 影响水电离的因素 | |
| 7 | 0.65 | 浓度对化学反应速率的影响 可逆反应及反应限度 浓度对电离平衡的影响 | |
| 8 | 0.85 | 电离方程式 弱电解质的电离方程式 | |
| 9 | 0.65 | 热化学方程式含义 中和热概念 燃烧热概念 | |
| 10 | 0.85 | 化学平衡状态的判断方法 | |
| 11 | 0.85 | 溶解度、饱和溶液的概念 溶液的酸碱性与pH | |
| 12 | 0.85 | 化学反应自发过程 化学反应进行方向的判据 复合判据 反应进行方向判据的应用 | |
| 14 | 0.85 | 反应焓变与热化学方程式的关系 转化率的相关计算及判断 | |
| 15 | 0.85 | 化学反应热的计算 盖斯定律与热化学方程式 | |
| 16 | 0.65 | 焓变产生原因及表示 反应焓变与热化学方程式的关系 | |
| 17 | 0.85 | 水溶液中水的电离程度及的计算 电离平衡常数及影响因素 | |
| 18 | 0.94 | 化学反应速率的定量表示方法 化学反应速率与化学计量数之间的关系 | |
| 19 | 0.94 | 强电解质和弱电解质的判断 | |
| 20 | 0.65 | 酸碱中和滴定的误差分析 | |
| 二、多选题 | |||
| 13 | 0.65 | 化学反应速率的图像 化学平衡图像分析 | |
| 三、填空题 | |||
| 21 | 0.85 | 温度对化学反应速率的影响 浓度对化学平衡移动的影响 影响水电离的因素 弱电解质在水溶液中的电离平衡 | |
| 23 | 0.4 | 化学反应速率与化学计量数之间的关系 化学反应速率与化学平衡的综合应用 | |
| 24 | 0.65 | 弱电解质电离平衡的影响因素 弱电解质在水溶液中的电离平衡 浓度对电离平衡的影响 | |
| 四、解答题 | |||
| 22 | 0.85 | 中和热 中和热概念 中和热的测定与误差分析 中和热的计算 | 实验探究题 |
| 25 | 0.65 | 化学反应热的计算 化学平衡的移动及其影响因素 化学平衡图像分析 化学平衡常数的影响因素及应用 | 原理综合题 |
| 26 | 0.65 | 化学平衡常数的影响因素及应用 化学平衡常数的有关计算 弱电解质在水溶液中的电离平衡 电离平衡常数及影响因素 | 原理综合题 |



