名校
1 .  是环境污染物。
是环境污染物。
(1)消除 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为_______ 。
(2)以氨气为原料脱硝除去 。
。
①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知: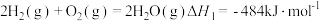
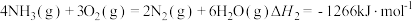
则 的
的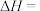
_______  。
。
②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为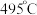 时,
时, 的温度为
的温度为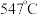 ,而
,而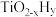 的温度为
的温度为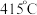 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是_______ 。 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。_______ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为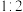 ,则反应的化学方程式为
,则反应的化学方程式为_______ 。
(4)以 为原料脱硝除去
为原料脱硝除去 。
。
烟气中的 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的 (羟基自由基),
(羟基自由基), 能将
能将 快速氧化为
快速氧化为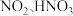 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示:_______ 。
②化学式为 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
 是环境污染物。
是环境污染物。(1)消除
 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为(2)以氨气为原料脱硝除去
 。
。①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
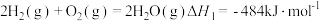
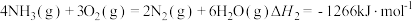
则
 的
的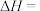
 。
。②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用
 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为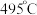 时,
时, 的温度为
的温度为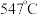 ,而
,而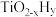 的温度为
的温度为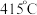 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是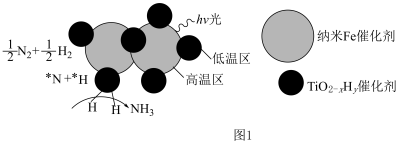
 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。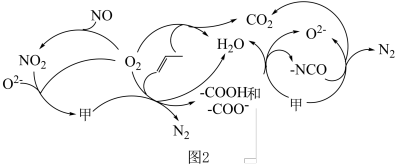
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为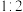 ,则反应的化学方程式为
,则反应的化学方程式为(4)以
 为原料脱硝除去
为原料脱硝除去 。
。烟气中的
 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的 (羟基自由基),
(羟基自由基), 能将
能将 快速氧化为
快速氧化为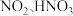 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示: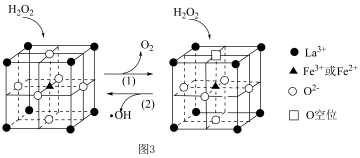
②化学式为
 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2024·贵州贵阳·二模
名校
解题方法
2 . 氯乙烯是用途广泛的石油化工产品,工业上常利用乙烯氧氯化法生产:

已知:ⅰ.
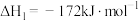
ⅱ.
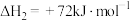
ⅲ.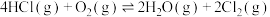
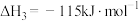
回答下列问题:
(1)
___________  。
。
(2)已知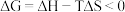 ,反应可自发进行。若
,反应可自发进行。若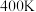 时反应ⅱ中
时反应ⅱ中 ,此时反应ⅱ
,此时反应ⅱ___________ (“能”或“不能”)自发进行。
(3)为提高反应ⅱ中氯乙烯的平衡产率,可采取的措施有___________ 。
a.加入合适的催化剂 b.升高温度 c.增大压强 d.及时氧化
(4)向 密闭容器中初始投入
密闭容器中初始投入 、
、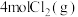 和
和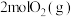 发生乙烯氧氯化反应,不同温度下测得反应在平衡时
发生乙烯氧氯化反应,不同温度下测得反应在平衡时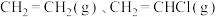 、
、 三种组分的体积分数随温度的变化如图1所示。
三种组分的体积分数随温度的变化如图1所示。___________ 和___________ 的体积分数随温度的变化。
②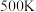 时反应进行到
时反应进行到 达到平衡,
达到平衡, 内用
内用 的浓度变化表示的
的浓度变化表示的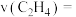
___________ ,该反应的平衡常数
___________ 。
(5)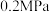 时,控制进料浓度
时,控制进料浓度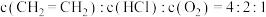 。容器中发生反应
。容器中发生反应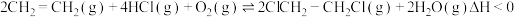 ,不同温度对
,不同温度对 的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过
的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过 转化为
转化为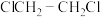 的转化率大小来体现)
的转化率大小来体现)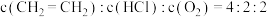 ,所得
,所得 的平衡转化率曲线应在点M的
的平衡转化率曲线应在点M的___________ (填“上”或“下”)方。
②因受现有工业设备限制,需保持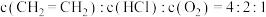 不变,在235℃、
不变,在235℃、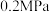 下,若要进一步增大
下,若要进一步增大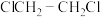 的选择性,可选择从
的选择性,可选择从___________ 方向进一步展开研究。

已知:ⅰ.

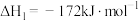
ⅱ.

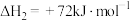
ⅲ.
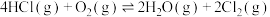
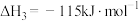
回答下列问题:
(1)

 。
。(2)已知
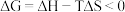 ,反应可自发进行。若
,反应可自发进行。若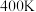 时反应ⅱ中
时反应ⅱ中 ,此时反应ⅱ
,此时反应ⅱ(3)为提高反应ⅱ中氯乙烯的平衡产率,可采取的措施有
a.加入合适的催化剂 b.升高温度 c.增大压强 d.及时氧化

(4)向
 密闭容器中初始投入
密闭容器中初始投入 、
、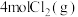 和
和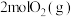 发生乙烯氧氯化反应,不同温度下测得反应在平衡时
发生乙烯氧氯化反应,不同温度下测得反应在平衡时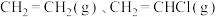 、
、 三种组分的体积分数随温度的变化如图1所示。
三种组分的体积分数随温度的变化如图1所示。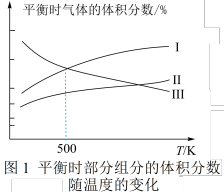
②
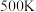 时反应进行到
时反应进行到 达到平衡,
达到平衡, 内用
内用 的浓度变化表示的
的浓度变化表示的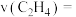

(5)
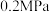 时,控制进料浓度
时,控制进料浓度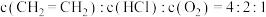 。容器中发生反应
。容器中发生反应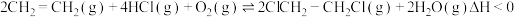 ,不同温度对
,不同温度对 的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过
的平衡转化率和催化剂的催化效率的影响如图2所示。(备注:催化效率是指催化剂转化反应物为生成物的能力,通常通过产物的选择性和反应速率来衡量。图2中通过 转化为
转化为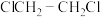 的转化率大小来体现)
的转化率大小来体现)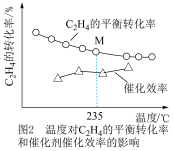
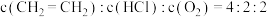 ,所得
,所得 的平衡转化率曲线应在点M的
的平衡转化率曲线应在点M的②因受现有工业设备限制,需保持
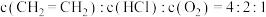 不变,在235℃、
不变,在235℃、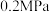 下,若要进一步增大
下,若要进一步增大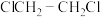 的选择性,可选择从
的选择性,可选择从
您最近一年使用:0次
名校
3 . 氨及其盐都是重要的化工原料,有广泛的用途。
(1)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。
2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。

①比较:p1____ p2(填“>”、“<”或“=”,下同)。
②当压强为p2时,在y点的v(正)____ v(逆)。
(2)研发氨燃料电池是当前科研的一个热点,如图所示。
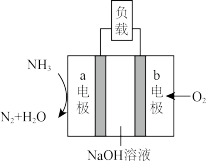
①该电池负极的电极反应式为____ 。
②当有6mol发生转移时,消耗NH3的质量为____ 。
③若该电池用于金属表面镀银,____ (填“a”或“b”)电极连接镀件(待镀金属)。
(3)传统工业以CO2与NH3为原料合成尿素的反应在进行时
分为如下两步:
第一步:2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ•mol-1
第二步:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ•mol-1
①写出以CO2与NH3为原料合成尿素的热化学方程式____ 。
②为模拟工业合成尿素,某同学向体积为0.5L密闭容器中投入4molNH3和1molCO2,测得反应中各组分物质的量随时间的变化如图所示。反应进行到____ min时到达平衡。

(1)已知:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。
2NH3(g) ΔH=-92.4kJ•mol-1。两相同密闭容器中分别通入相同含量的N2和H2,在一定条件下发生反应,测得H2的平衡转化率(%)与温度及压强的关系如图所示。
①比较:p1
②当压强为p2时,在y点的v(正)
(2)研发氨燃料电池是当前科研的一个热点,如图所示。

①该电池负极的电极反应式为
②当有6mol发生转移时,消耗NH3的质量为
③若该电池用于金属表面镀银,
(3)传统工业以CO2与NH3为原料合成尿素的反应在进行时
分为如下两步:
第一步:2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ•mol-1
第二步:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ•mol-1
①写出以CO2与NH3为原料合成尿素的热化学方程式
②为模拟工业合成尿素,某同学向体积为0.5L密闭容器中投入4molNH3和1molCO2,测得反应中各组分物质的量随时间的变化如图所示。反应进行到

您最近一年使用:0次
4 . 铅及其化合物在工业生产及日常生活中有非常广泛的用途。
(1)工业上可用PbS与PbSO4反应制备粗铅,反应为PbS+PbSO4 2Pb+2SO2↑。
2Pb+2SO2↑。
已知下列反应的热化学方程式:
Ⅰ.2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
Ⅱ.PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2= b kJ·mol-1
Ⅲ.PbS(s)+2O2(g)=PbSO4(s) ΔH3=c kJ·mol-1
①反应PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=_______ (用含a,b,c的代数式表示)。
②反应Ⅲ在一定条件下能自发进行的原因是_______ 。
(2)工业上可通过电解将粗铅精炼,电解液为H2SiF6和PbSiF6的混合溶液。电解时,当c(H2SiF6)过大时,铅产率减小的原因可能是_______ 。(已知:H2SiF6和PbSiF6均为易溶子水的强电解质。)
(3)铅易造成环境污染,水溶液中铅的存在形态与pH关系如图1所示。
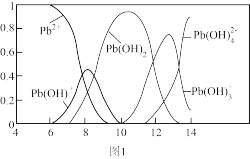
①常温下,向pH=10的含Pb(II)废水滴加氨水至pH=11时,所发生反应的离子方程式为_______ 。
②某工业含有Pb2+的废水,经处理后c(Pb2+)=2×l0-6 mol·L-1,达到排放标准,此溶液的pH不低于_______ 。(已知室温下:Ksp[Pb(OH)2]=2×10-l5)
(4)我国科学家在一种铅的卤化物光电材料中引入稀土铕(Eu3+)盐,可以提升太阳能电池的效率和使用寿命,其作用原理如图2所示。该过程可描述为_______ 。

(1)工业上可用PbS与PbSO4反应制备粗铅,反应为PbS+PbSO4
 2Pb+2SO2↑。
2Pb+2SO2↑。已知下列反应的热化学方程式:
Ⅰ.2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
Ⅱ.PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2= b kJ·mol-1
Ⅲ.PbS(s)+2O2(g)=PbSO4(s) ΔH3=c kJ·mol-1
①反应PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=
②反应Ⅲ在一定条件下能自发进行的原因是
(2)工业上可通过电解将粗铅精炼,电解液为H2SiF6和PbSiF6的混合溶液。电解时,当c(H2SiF6)过大时,铅产率减小的原因可能是
(3)铅易造成环境污染,水溶液中铅的存在形态与pH关系如图1所示。

①常温下,向pH=10的含Pb(II)废水滴加氨水至pH=11时,所发生反应的离子方程式为
②某工业含有Pb2+的废水,经处理后c(Pb2+)=2×l0-6 mol·L-1,达到排放标准,此溶液的pH不低于
(4)我国科学家在一种铅的卤化物光电材料中引入稀土铕(Eu3+)盐,可以提升太阳能电池的效率和使用寿命,其作用原理如图2所示。该过程可描述为

您最近一年使用:0次
2021·河南·模拟预测
5 . 环己酮( )作为一种重要的基础化工原料,在各个领域有着广泛用途,作为精细化工的一部分。苯酚(
)作为一种重要的基础化工原料,在各个领域有着广泛用途,作为精细化工的一部分。苯酚( )催化加氢制备环已酮既可实现苯酚的综合利用,又可避免使用氧化剂对环境造成污染,一直受到研究人员的关注。涉及反应如下:
)催化加氢制备环已酮既可实现苯酚的综合利用,又可避免使用氧化剂对环境造成污染,一直受到研究人员的关注。涉及反应如下:
ⅰ.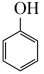 (g)+2H2(g)⇌
(g)+2H2(g)⇌ 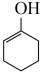 (g)
(g) ;
;
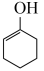
ⅱ.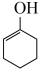 (g)⇌
(g)⇌ 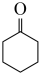 (g)
(g) ;
;
ⅲ.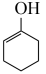 (g)+H2(g)⇌
(g)+H2(g)⇌ 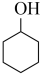 (g)
(g)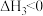 ;
;
ⅳ.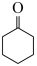 (g)+H2(g)⇌
(g)+H2(g)⇌ 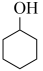 (g)
(g)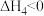 。
。
请回答下列问题:
(1)稳定性: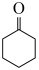
_______  (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)反应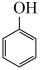 (g)+3H2(g)⇌
(g)+3H2(g)⇌ 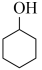 (g)的反应热
(g)的反应热
_______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(3)通过上述反应完成苯酚(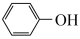 )催化加氢制备环己酮。平衡时,随温度升高,
)催化加氢制备环己酮。平衡时,随温度升高,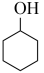 的体积分数变化如图甲所示:
的体积分数变化如图甲所示:
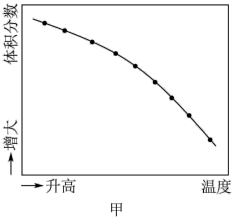
随着温度升高,环己醇的体积分数减小的原因为_______ 。
(4)采用适宜的温度,在容积为1L的恒容密闭容器中,加入1mol苯酚和2mol 只发生反应ⅰ,10min后反应达到平衡状态,测得体系压强是起始压强的0.5倍。
只发生反应ⅰ,10min后反应达到平衡状态,测得体系压强是起始压强的0.5倍。
①达到平衡时1−环己烯醇的平均生成速率v=_______ 。
②该温度下,该反应的平衡常数
_______  ,如果这时向该密闭容器中再充入1mol苯酚和1mol1−环己烯醇,此时v正
,如果这时向该密闭容器中再充入1mol苯酚和1mol1−环己烯醇,此时v正_______ v逆(填“>”“<”或“=”)。
(5)环己酮也可以用环己醇间接电解氧化法制备,其原理如图乙所示:
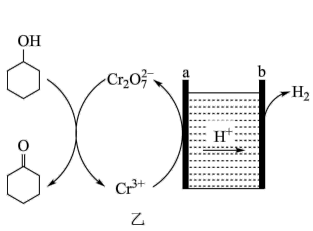
b应接直流电源的_______ (填“负极”或“正极”),a电极的电极反应式为_______ 。
 )作为一种重要的基础化工原料,在各个领域有着广泛用途,作为精细化工的一部分。苯酚(
)作为一种重要的基础化工原料,在各个领域有着广泛用途,作为精细化工的一部分。苯酚( )催化加氢制备环已酮既可实现苯酚的综合利用,又可避免使用氧化剂对环境造成污染,一直受到研究人员的关注。涉及反应如下:
)催化加氢制备环已酮既可实现苯酚的综合利用,又可避免使用氧化剂对环境造成污染,一直受到研究人员的关注。涉及反应如下:ⅰ.
 (g)+2H2(g)⇌
(g)+2H2(g)⇌  (g)
(g) ;
;ⅱ.
 (g)⇌
(g)⇌  (g)
(g) ;
;ⅲ.
 (g)+H2(g)⇌
(g)+H2(g)⇌  (g)
(g) ;
;ⅳ.
 (g)+H2(g)⇌
(g)+H2(g)⇌  (g)
(g) 。
。请回答下列问题:
(1)稳定性:

 (填“>”“<”或“=”)
(填“>”“<”或“=”)(2)反应
 (g)+3H2(g)⇌
(g)+3H2(g)⇌  (g)的反应热
(g)的反应热
 、
、 、
、 的代数式表示)。
的代数式表示)。(3)通过上述反应完成苯酚(
 )催化加氢制备环己酮。平衡时,随温度升高,
)催化加氢制备环己酮。平衡时,随温度升高, 的体积分数变化如图甲所示:
的体积分数变化如图甲所示:
随着温度升高,环己醇的体积分数减小的原因为
(4)采用适宜的温度,在容积为1L的恒容密闭容器中,加入1mol苯酚和2mol
 只发生反应ⅰ,10min后反应达到平衡状态,测得体系压强是起始压强的0.5倍。
只发生反应ⅰ,10min后反应达到平衡状态,测得体系压强是起始压强的0.5倍。①达到平衡时1−环己烯醇的平均生成速率v=
②该温度下,该反应的平衡常数

 ,如果这时向该密闭容器中再充入1mol苯酚和1mol1−环己烯醇,此时v正
,如果这时向该密闭容器中再充入1mol苯酚和1mol1−环己烯醇,此时v正(5)环己酮也可以用环己醇间接电解氧化法制备,其原理如图乙所示:

b应接直流电源的
您最近一年使用:0次
2021-12-06更新
|
296次组卷
|
3卷引用:押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)
(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)河南省部分重点高中2021-2022学年高三上学期12月适应性检测化学试题辽宁省凌源市2021-2022学年高三下学期高三开学考试化学试题
6 . 甲醇是一种基本的有机化工原料,用途十分广泛。
已知:CH3OH(g) ⇌HCHO(g)+H2(g) ΔH=+84kJ·mol-1
2H2(g)+O2(g) ⇌2H2O(g) ΔH=-484kJ·mol-1
(1)①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:_______ 。
②若在恒温恒容的容器内进行反应CO(g)+2H2(g) ⇌CH3OH(g),下列表示该反应达到平衡状态的标志有_______ (填字母序号)。
A.容器中混合气体的密度不变化
B.有2个H—H键断裂的同时有3个C—H键生成
C.容器中混合气体的压强不变化
D.CH3OH(g)百分含量保持不变
(2)工业上以CO、CO2、H2为原料制备甲醇,其原理如下:
主反应:①CO+2H2⇌CH3OH ②CO2+3H2⇌CH3OH+H2O
副反应:2CO⇌CO2+C 2CO+2H2⇌CH4+CO2
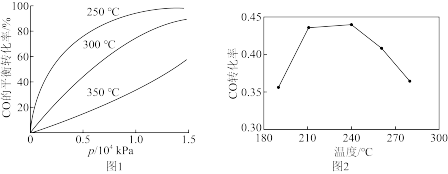
CO在不同温度下的平衡转化率与压强的关系如图1所示。该反应ΔH_____ (填“>”或“<”)0,实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_____ 。由图2知,当温度高于240℃时,CO转化率下降的原因为_____ 。
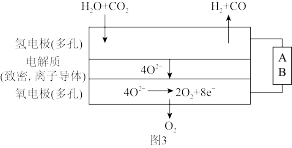
(3)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2,由图3可知A为直流电源的_____ (填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:_____ 。
已知:CH3OH(g) ⇌HCHO(g)+H2(g) ΔH=+84kJ·mol-1
2H2(g)+O2(g) ⇌2H2O(g) ΔH=-484kJ·mol-1
(1)①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:
②若在恒温恒容的容器内进行反应CO(g)+2H2(g) ⇌CH3OH(g),下列表示该反应达到平衡状态的标志有
A.容器中混合气体的密度不变化
B.有2个H—H键断裂的同时有3个C—H键生成
C.容器中混合气体的压强不变化
D.CH3OH(g)百分含量保持不变
(2)工业上以CO、CO2、H2为原料制备甲醇,其原理如下:
主反应:①CO+2H2⇌CH3OH ②CO2+3H2⇌CH3OH+H2O
副反应:2CO⇌CO2+C 2CO+2H2⇌CH4+CO2
CO在不同温度下的平衡转化率与压强的关系如图1所示。该反应ΔH

(3)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2,由图3可知A为直流电源的

您最近一年使用:0次
名校
解题方法
7 . 化学反应与能量变化是化学家研究的永恒话题。
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。
①硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把_______ 能转化为_______ 能的装置。
②工业制备纯硅的反应: ,生成的
,生成的 通入
通入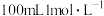 的
的 溶液恰好反应,则制备纯硅的过程中
溶液恰好反应,则制备纯硅的过程中_______ (填“吸收或“释放”)的热量为_______  。
。
(2)氢气是一种理想的绿色能源.请回答下列问题
①在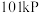 下,
下, 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出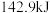 的热量。写出表示氢气燃烧热的热化学方程式
的热量。写出表示氢气燃烧热的热化学方程式_______ 。
②氢能的存储是氢能利用的前提,科学家研究出一种储氢合金 ,已知:
,已知:
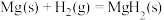
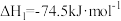
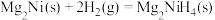
 ;
;

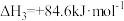
则
_______  。
。
(3)化学能与电能的相互转换有着重要的用途。如图是一个化学过程的示意图.请回答下列问题。
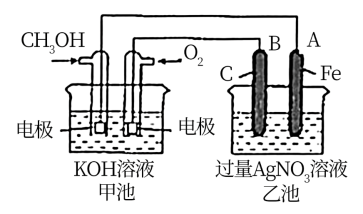
①乙池是_______ 装置(填“原电池”或“电解池”),A电极的名称是_______ ;B(石墨)电极的电极反应式为:_______ 。
②甲池中通入 一极的电极反应式为:
一极的电极反应式为:_______ 。
③反应一段时间后,要使乙池反应后的溶液恢复到原来的状态,则需加入_______ (填化学式)。
④研究证实,甲醇可由 在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:_______ 。
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。
①硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把
②工业制备纯硅的反应:
 ,生成的
,生成的 通入
通入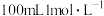 的
的 溶液恰好反应,则制备纯硅的过程中
溶液恰好反应,则制备纯硅的过程中 。
。(2)氢气是一种理想的绿色能源.请回答下列问题
①在
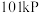 下,
下, 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出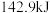 的热量。写出表示氢气燃烧热的热化学方程式
的热量。写出表示氢气燃烧热的热化学方程式②氢能的存储是氢能利用的前提,科学家研究出一种储氢合金
 ,已知:
,已知: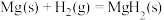
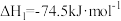
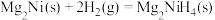
 ;
;
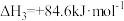
则

 。
。(3)化学能与电能的相互转换有着重要的用途。如图是一个化学过程的示意图.请回答下列问题。

①乙池是
②甲池中通入
 一极的电极反应式为:
一极的电极反应式为:③反应一段时间后,要使乙池反应后的溶液恢复到原来的状态,则需加入
④研究证实,甲醇可由
 在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
您最近一年使用:0次
2021-05-07更新
|
201次组卷
|
2卷引用:江苏省苏州市吴中区2020-2021学年高二下学期期中调研测试化学试题
8 . 天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H1;
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2;
2CO(g)+O2(g)=2CO2(g) ∆H3;
则CO2(g)+CH4(g)=2CO(g)+2H2(g)的∆H=___________ 。
②天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式___________ 。
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。该反应的平衡常数表达式为
2CO(g)+2H2(g)。该反应的平衡常数表达式为___________ ;在密闭容器中通入物质的量浓度均为0.1 mol/L的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图20-1所示。则压强P1___________ P2(填“大于”或“小于");压强为P2时,在Y点:v(正)___________ v(逆)(填“大于”“小于”或“等于”)。
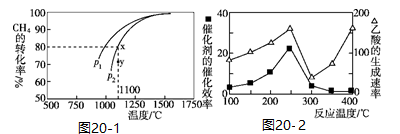
(3)CH4和CO2合成乙酸,某工业生产中以CuAlO2为合成的催化剂,在不同温度下催化剂的催化效率与乙酸的生成速率如图20-2所示。250℃~300℃时,温度升高而乙酸的生成速率降低的原因是___________ ,将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为___________ 。
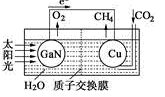
(4)科学家用氮化镓材料与铜组装如下图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式___________ 。
(1)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H1;
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2;
2CO(g)+O2(g)=2CO2(g) ∆H3;
则CO2(g)+CH4(g)=2CO(g)+2H2(g)的∆H=
②天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)
 2CO(g)+2H2(g)。该反应的平衡常数表达式为
2CO(g)+2H2(g)。该反应的平衡常数表达式为
(3)CH4和CO2合成乙酸,某工业生产中以CuAlO2为合成的催化剂,在不同温度下催化剂的催化效率与乙酸的生成速率如图20-2所示。250℃~300℃时,温度升高而乙酸的生成速率降低的原因是
(4)科学家用氮化镓材料与铜组装如下图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式

您最近一年使用:0次
9 . 氮和氮的化合物在工农业生产、国防和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在一定条件下通过以下反应制得:2NO+Cl2=2ClNO,已知几种化学键的键能数据如下表所示:
请根据表中数据计算:2NO(g)+Cl2(g)=2ClNO(g)△H=___ kJ•mol-1。
(2)温度一定时,在一个体积为1L的密闭容器中通入2molNO和1molCl2,10min时ClNO体积占气体总体积40%(气体的“体积分数”即“物质的量分数”),则反应开始到10min内NO的平均反应速率:v(NO)=___ mol·L-1·min-1
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物,
主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
①△H1=___ 。
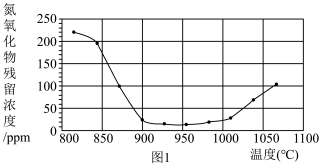
②将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图1,试分析脱硝的适宜温度是___ (填序号)
a.<850℃ b.900~1000℃ c.>1050 ℃
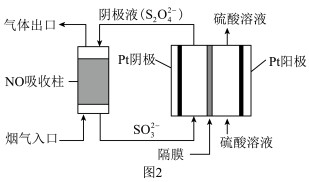
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图2。阴极的电极反应式为___ 。
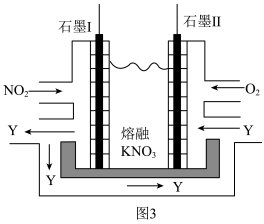
(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图3所示,电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅰ附近发生的电极反应式为:___ 。
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在一定条件下通过以下反应制得:2NO+Cl2=2ClNO,已知几种化学键的键能数据如下表所示:
| 化学键 | Cl-Cl | Cl-N | N=O | N=O(NO) |
| 键能(kJ·mol-1) | 243 | a | 607 | 630 |
(2)温度一定时,在一个体积为1L的密闭容器中通入2molNO和1molCl2,10min时ClNO体积占气体总体积40%(气体的“体积分数”即“物质的量分数”),则反应开始到10min内NO的平均反应速率:v(NO)=
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物,
主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
①△H1=
②将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图1,试分析脱硝的适宜温度是
a.<850℃ b.900~1000℃ c.>1050 ℃

(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图2。阴极的电极反应式为

(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图3所示,电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅰ附近发生的电极反应式为:

您最近一年使用:0次
10 . 天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的ΔH=___ kJ·mol-1。
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是
N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是___ 。
a.使用催化剂 b.降低温度 c.及时分离水
(3)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
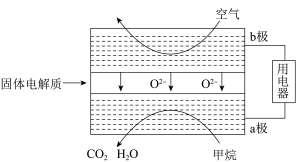
①外电路电子移动方向:___ 。(填“a极到b极”或“b极到a极”)。
②a极电极反应式为___ 。
③若燃料电池消耗的空气在标准状况下的体积是22.4L(假设空气中O2体积分数为20%),则理论上消耗甲烷___ mol。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的ΔH=
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是
N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是a.使用催化剂 b.降低温度 c.及时分离水
(3)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:

①外电路电子移动方向:
②a极电极反应式为
③若燃料电池消耗的空气在标准状况下的体积是22.4L(假设空气中O2体积分数为20%),则理论上消耗甲烷
您最近一年使用:0次



