1 . 铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________ 。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________ (用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
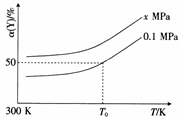
①上述反应的△H_______ 0(填“>”“<”或“=”)。
②图象中,x_________ 0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________ 。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________ 。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________ 。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g)
 c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
①上述反应的△H
②图象中,x
③在T0K、0.1MPa时,上述反应的平衡常数K=
④提高上述反应的反应速率的措施有
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)
 [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:
您最近一年使用:0次
2017-12-31更新
|
365次组卷
|
3卷引用:湖北省稳派教育2018届高三上学期第二次联考理科综合化学试题
名校
2 . “绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
②N2(g)+O2(g) 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g) 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________ 以及此热化学方程式的平衡常数K=____________ (用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=
,则反应开始到平衡时CO的平均反应速率v(CO)=________ 。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________ 。
(3)电化学降解NO2-的原理如下图:
①电源的负极是________ (填A或B)阴极反应式为________________________________________ 。
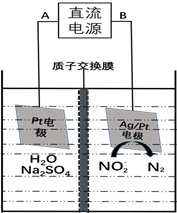
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差 为
为_________ g。
(1)已知:①NO2 + CO
 CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为
CO2 + NO 该反应的平衡常数为K1(下同)每1mol下列物质分解为气态基态原子消耗能量分别为 NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)
 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2 ③2NO(g) +O2(g)
 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3试写出NO与CO反应生成无污染物气体的热化学方程式
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO
 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时CO的平均反应速率v(CO)=
,则反应开始到平衡时CO的平均反应速率v(CO)=若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围
(3)电化学降解NO2-的原理如下图:
①电源的负极是

②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差
 为
为
您最近一年使用:0次
2017-12-09更新
|
532次组卷
|
5卷引用:湖北省鄂南高中+、华师一附中、黄冈中学等八校2018届高三上学期第一次联考试题(12月)理综-化学试题
3 . 高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是_____________ (写化学式)。
(2)CO 可以用于生产甲醇,甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH (g) △H=-90.8kJ/mol
已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ·mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ`mol-1
①H2的燃烧热为___________________ kJ/mol。
②CH3OH(g)+O2(g) CO(g) +2H2O(g) 的反应热△H=
CO(g) +2H2O(g) 的反应热△H=___________________ 。
③若在恒温恒容的容器内进行反应CO (g) +2H2 (g) CH3OH (g),则可用来判断该反应达到平衡状态的标志有
CH3OH (g),则可用来判断该反应达到平衡状态的标志有______________________ 。(填字母)
A.CO 百分含量保持不变B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变D.CO 的生成速率与CH3OH 的生成速率相等
(3)高炉煤气中N2的含量较高,利用CO前需要对CO进行富集,实现CO和N2的分离。工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为CH3COOCu(NH3)2(aq)+CO(g) CH3COOCu(NH3)2·CO(aq)△H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有
CH3COOCu(NH3)2·CO(aq)△H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________ (写出一种即可)。
(1)上述提及的气体分子中,电子数相等的两种气体是
(2)CO 可以用于生产甲醇,甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH (g) △H=-90.8kJ/mol
已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ·mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ`mol-1
①H2的燃烧热为
②CH3OH(g)+O2(g)
 CO(g) +2H2O(g) 的反应热△H=
CO(g) +2H2O(g) 的反应热△H=③若在恒温恒容的容器内进行反应CO (g) +2H2 (g)
 CH3OH (g),则可用来判断该反应达到平衡状态的标志有
CH3OH (g),则可用来判断该反应达到平衡状态的标志有A.CO 百分含量保持不变B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变D.CO 的生成速率与CH3OH 的生成速率相等
(3)高炉煤气中N2的含量较高,利用CO前需要对CO进行富集,实现CO和N2的分离。工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为CH3COOCu(NH3)2(aq)+CO(g)
 CH3COOCu(NH3)2·CO(aq)△H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有
CH3COOCu(NH3)2·CO(aq)△H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有
您最近一年使用:0次
2017-11-29更新
|
122次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2017-2018学年高二上学期期中考试化学试题
4 . 按要求对下图中两极进行必要的联接 并填空:
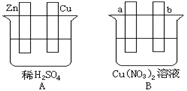
(1)在A图中,使铜片上冒H2气泡。请加以必要联接__________ (在答题卡的图中画线),则联接后的装置叫_________ 。电极反应式:锌板:____________________ ;铜板:___________ 。
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出____________ 。加以必要的联接后,该装置叫___________ 。电极反应式:a极:___________________________ b极:____________________________ 。经过一段时间后,停止反应并搅均溶液,溶液的pH值________________ (升高、降低、不变),加入一定量的____________ 后,溶液能恢复至与电解前完全一致。
(3)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+ O2(g) = CH3OH(g) △H=-128.5kJ/mol
O2(g) = CH3OH(g) △H=-128.5kJ/mol
副反应有:CH4(g)+ O2(g) = CO(g)+2H2O(g) △H=a kJ/mol
O2(g) = CO(g)+2H2O(g) △H=a kJ/mol
CH4(g)+2O2(g) = CO2(g)+2H2O(g) △H=b kJ/mol
CH4(g)+O2(g) = HCHO(g) +H2O(g) △H=c kJ/mol
甲醇与氧气反应生成HCHO(g)和水蒸气的热化学方程式为_____________________ 。

(1)在A图中,使铜片上冒H2气泡。请加以必要联接
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出
(3)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+
 O2(g) = CH3OH(g) △H=-128.5kJ/mol
O2(g) = CH3OH(g) △H=-128.5kJ/mol副反应有:CH4(g)+
 O2(g) = CO(g)+2H2O(g) △H=a kJ/mol
O2(g) = CO(g)+2H2O(g) △H=a kJ/molCH4(g)+2O2(g) = CO2(g)+2H2O(g) △H=b kJ/mol
CH4(g)+O2(g) = HCHO(g) +H2O(g) △H=c kJ/mol
甲醇与氧气反应生成HCHO(g)和水蒸气的热化学方程式为
您最近一年使用:0次
名校
5 . 氮氧化物和碳氧化合物的综合治理是当前的重要课题之一。
已知:ⅰ.NO(g)+CO2(g) NO2(g)+CO(g) △H1=+234kJ·mol-1
NO2(g)+CO(g) △H1=+234kJ·mol-1
ⅱ.2NO(g)+2CO(g) N2(g)+2CO2(g) △H2=-745kJ·mol-1
N2(g)+2CO2(g) △H2=-745kJ·mol-1
(1)NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为______________ 。
(2)反应ⅰ的正反应的活化能E_____ △H1(填“>”、“<”或“=”)。
(3)一定压强下,密闭容器中发生反应ⅰ和反应ⅱ。达到平衡后,保持其他条件不变,升高温度,CO(g)的体积分数________ (填“增大”、“减少”或“无法确定”),原因为_____________________ 。
(4)向起始温度为t℃、容积为10L的恒容绝热的密闭容器中充入2molNO(g)和1molCO2(g),发生反应ⅰ。5min时达到平衡。则:
①下列事实能说明该反应达到平衡状态的是________ (填选项字母)
A.混合气体温度不变 B.混合气体的压强不变
C. NO2和CO的浓度之比为1: 1 D.混合气体的平均相对分子质量不变
②t℃时,向另一容积为10 L的恒温恒容的密闭容器中充入2 mol NO(g)和1 mol CO2(g),发生反应i。达到平衡的时间______ 5 min(填“>”、“<”或“=”)。
(5)在某密闭容器中充有10 mol CO(g)和20 mol NO(g),发生反应ii,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
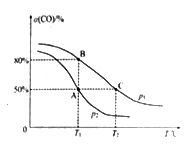
①A、B、C 三点的平衡常数KA、KB、KC的大小关系为________ ;p1和p2的大小关系为__________ 。
②A点时.测得容器的体积为10 L,则T1℃时,该反应平衡常数K的值为____________ 。
已知:ⅰ.NO(g)+CO2(g)
 NO2(g)+CO(g) △H1=+234kJ·mol-1
NO2(g)+CO(g) △H1=+234kJ·mol-1ⅱ.2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H2=-745kJ·mol-1
N2(g)+2CO2(g) △H2=-745kJ·mol-1(1)NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为
(2)反应ⅰ的正反应的活化能E
(3)一定压强下,密闭容器中发生反应ⅰ和反应ⅱ。达到平衡后,保持其他条件不变,升高温度,CO(g)的体积分数
(4)向起始温度为t℃、容积为10L的恒容绝热的密闭容器中充入2molNO(g)和1molCO2(g),发生反应ⅰ。5min时达到平衡。则:
①下列事实能说明该反应达到平衡状态的是
A.混合气体温度不变 B.混合气体的压强不变
C. NO2和CO的浓度之比为1: 1 D.混合气体的平均相对分子质量不变
②t℃时,向另一容积为10 L的恒温恒容的密闭容器中充入2 mol NO(g)和1 mol CO2(g),发生反应i。达到平衡的时间
(5)在某密闭容器中充有10 mol CO(g)和20 mol NO(g),发生反应ii,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C 三点的平衡常数KA、KB、KC的大小关系为
②A点时.测得容器的体积为10 L,则T1℃时,该反应平衡常数K的值为
您最近一年使用:0次
2017-05-29更新
|
307次组卷
|
3卷引用:湖北省随州二中2019-2020学年高二上学期9月份月考化学试题
6 . 甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO (g)+H2(g) CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ/mol;②H2(g)+1/2O2(g)=H2O(g) ΔH2=-241.8 kJ/mol;③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3=-192.2 kJ/mol。回答下列问题:
CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ/mol;②H2(g)+1/2O2(g)=H2O(g) ΔH2=-241.8 kJ/mol;③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3=-192.2 kJ/mol。回答下列问题:
(1)计算CO(g)+2H2(g) CH3OH(g)的反应热ΔH4=
CH3OH(g)的反应热ΔH4=_________________ 。
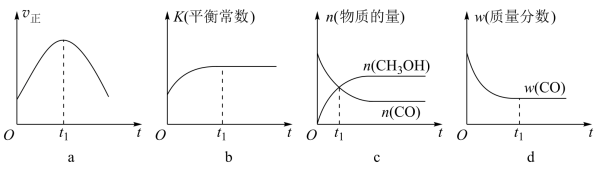
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生反应CO(g)+2H2(g) CH3OH(g),下列示意图正确且能说明在进行到t1时刻为平衡状态的是
CH3OH(g),下列示意图正确且能说明在进行到t1时刻为平衡状态的是________ (填选项字母)。
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积______ 5 L(填“>、<或=”);T1℃时,CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=____________ 。
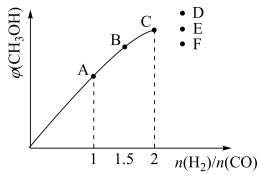
(4)在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当n(H2)/n(CO)=2.5时,达到平衡状态,CH3OH的体积分数可能是图象中的________ 点。
(5)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式________________________________________________ 。
 CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ/mol;②H2(g)+1/2O2(g)=H2O(g) ΔH2=-241.8 kJ/mol;③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3=-192.2 kJ/mol。回答下列问题:
CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g) ΔH1=-283.0 kJ/mol;②H2(g)+1/2O2(g)=H2O(g) ΔH2=-241.8 kJ/mol;③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3=-192.2 kJ/mol。回答下列问题:(1)计算CO(g)+2H2(g)
 CH3OH(g)的反应热ΔH4=
CH3OH(g)的反应热ΔH4=(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生反应CO(g)+2H2(g)
 CH3OH(g),下列示意图正确且能说明在进行到t1时刻为平衡状态的是
CH3OH(g),下列示意图正确且能说明在进行到t1时刻为平衡状态的是
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当n(H2)/n(CO)=2.5时,达到平衡状态,CH3OH的体积分数可能是图象中的

(5)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式
您最近一年使用:0次
7 . 二氧化碳的回收利用是环保和能源领域研究的热点课题。
(1)新的研究表明,利用太阳能可以将CO2分解制取炭黑,其原理如右图所示。该过程的能量转化形式为______ ,在整个过程中,FeO的作用是_________ 。
已知:
①2Fe2O4(s)=6FeO(s)+O2(g) ΔH=akJ/mol
②C(s)+O2(g)=CO2(g) ΔH=bKJ/mol 则过程2的热化学方程式为________ 。
(2)一定温度下,在密闭容器中进行反应CO2(g)+CH4(g) 2CO(g)+2H2(g) ΔH>0,下列说法正确的是
2CO(g)+2H2(g) ΔH>0,下列说法正确的是________ 。
A.当混合气体的平均相对分子质量不变时,反应达到平衡状态
B.升高温度,加快反应速率,CO2的转化率降低
C.增大CO2的浓度,平衡向正反应方向移动,平衡常数增大
D.平衡时CO、H2的体积分数不一定相等
(3)在2L恒容密闭容器中充入2molCO2和nmolH2,在一定条件下发生反应CO2(g)+3H2(g) CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比
CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比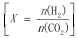 的关系如右图所示。
的关系如右图所示。
①若从反应开始到A点需要10s,则V(H2)=_____ 。
②该反应的平衡常数表达式为______ ,若X1=3,则B点的K=___________ 。
③根据图象判断X1____ X2(填“>”、“<”或“=”,下同),平衡常数KA ___ KB。
④若在500K时,按X1投料,在恒压下进行,达到平衡状态,此时CO2的转化率______ 75%(填“>”、“<”或“=”)
(4)美国伊利诺大学芝加哥分校(UIC)的研究团队设计出一种突破性的新太阳能电池,能把大气中的二氧化碳转换成碳氢化合物(hydrocarbon)燃料,解决了现代社会的两大挑战:“减少大气的碳含量”以及“有效率地制造高密度能源”。右图是通过CO2和H2O作用制备CH3OH的原理示意图。
①a电极的名称_________ ,电极产物___________ 。
②b电极的电极反应为_________ 。
(1)新的研究表明,利用太阳能可以将CO2分解制取炭黑,其原理如右图所示。该过程的能量转化形式为
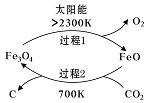
已知:
①2Fe2O4(s)=6FeO(s)+O2(g) ΔH=akJ/mol
②C(s)+O2(g)=CO2(g) ΔH=bKJ/mol 则过程2的热化学方程式为
(2)一定温度下,在密闭容器中进行反应CO2(g)+CH4(g)
 2CO(g)+2H2(g) ΔH>0,下列说法正确的是
2CO(g)+2H2(g) ΔH>0,下列说法正确的是A.当混合气体的平均相对分子质量不变时,反应达到平衡状态
B.升高温度,加快反应速率,CO2的转化率降低
C.增大CO2的浓度,平衡向正反应方向移动,平衡常数增大
D.平衡时CO、H2的体积分数不一定相等
(3)在2L恒容密闭容器中充入2molCO2和nmolH2,在一定条件下发生反应CO2(g)+3H2(g)
 CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比
CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比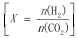 的关系如右图所示。
的关系如右图所示。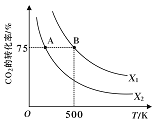
①若从反应开始到A点需要10s,则V(H2)=
②该反应的平衡常数表达式为
③根据图象判断X1
④若在500K时,按X1投料,在恒压下进行,达到平衡状态,此时CO2的转化率
(4)美国伊利诺大学芝加哥分校(UIC)的研究团队设计出一种突破性的新太阳能电池,能把大气中的二氧化碳转换成碳氢化合物(hydrocarbon)燃料,解决了现代社会的两大挑战:“减少大气的碳含量”以及“有效率地制造高密度能源”。右图是通过CO2和H2O作用制备CH3OH的原理示意图。
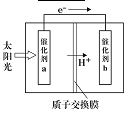
①a电极的名称
②b电极的电极反应为
您最近一年使用:0次
8 . NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g) 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应II:4NH3(g)+3O2(g) 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
写出NO分解生成N2与O2的热化学方程式_____ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
则下列有关叙述中正确的是_____________ 。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内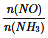 =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
①该催化剂在低温时选择反应_______ (填“ I ”或“ II”)。
②52℃时,4NH3+3O2 2N2+6H2O的平衡常数K=
2N2+6H2O的平衡常数K=_______ (不要求得出计算结果,只需列出数字计算式)。
③C点比B点所产生的NO的物质的量少的主要原因________ 。
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol •L-1氢硫酸的pH≈______ (取近似整数)。
②某同学通过近似计算发现0.lmol •L-1氢硫酸与0.0lmol •L-1氢硫酸中的c(S2-)相等,而且等于_____ mol·L-1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >_____ mol·L-1(计算结果保留两位有效数字),就会产生CuS沉淀。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)
 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1反应II:4NH3(g)+3O2(g)
 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1写出NO分解生成N2与O2的热化学方程式
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
| c(O2)/mol• L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内
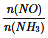 =1时,说明反应已达平衡
=1时,说明反应已达平衡D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
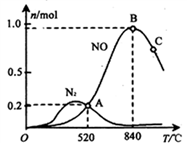
①该催化剂在低温时选择反应
②52℃时,4NH3+3O2
 2N2+6H2O的平衡常数K=
2N2+6H2O的平衡常数K=③C点比B点所产生的NO的物质的量少的主要原因
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol •L-1氢硫酸的pH≈
②某同学通过近似计算发现0.lmol •L-1氢硫酸与0.0lmol •L-1氢硫酸中的c(S2-)相等,而且等于
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >
您最近一年使用:0次
9 . 碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:
①CH3OH(g) CO(g)+2H2(g) △H1=+90.8kJ/mol
CO(g)+2H2(g) △H1=+90.8kJ/mol
②CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H2=+49kJ/mol
CO2(g)+3H2(g) △H2=+49kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
回答下列问题:
(1)△H3=__________ ;
(2)根据化学原理分析升高温度对反应②的影响__________ ;
(3)甲醇使用不当会造成其对水质的污染,用电化学可消除这种污染,其原理是电解CoSO4、稀硫酸和CH3OH混合溶液,将Co2+氧化成Co3+,Co3+再将CH3OH氧化成CO2。
①电解时,阳极的电极反应式为__________ ;
②Co3+氧化CH3OH的离子方程式为__________ 。
(4)控制反应条件,反应①中的产物也可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比[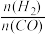 ]的变化如图所示:
]的变化如图所示:
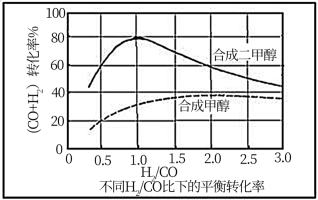
合成二甲醚的最佳氢碳比为__________ ,对于气相反应,用某组分(B)的平衡分压(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),水煤气合成二甲醚的反应的平衡常数表达式为KP=__________ 。
(5)在标态(反应物和产物都处于100kPa)和T(K)条件下由稳定单质生成1mol化合物的焓变称为该物质在T(K)时的标准焓,用符号△Hθ表示。已知石墨和一氧化碳的燃烧热△H分别为-393.5kJ•mol-1和—283.0 kJ •mol-1,则CO2(g)、CO(g)的△Hθ分别为__________ 、__________ 。
①CH3OH(g)
 CO(g)+2H2(g) △H1=+90.8kJ/mol
CO(g)+2H2(g) △H1=+90.8kJ/mol②CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) △H2=+49kJ/mol
CO2(g)+3H2(g) △H2=+49kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3回答下列问题:
(1)△H3=
(2)根据化学原理分析升高温度对反应②的影响
(3)甲醇使用不当会造成其对水质的污染,用电化学可消除这种污染,其原理是电解CoSO4、稀硫酸和CH3OH混合溶液,将Co2+氧化成Co3+,Co3+再将CH3OH氧化成CO2。
①电解时,阳极的电极反应式为
②Co3+氧化CH3OH的离子方程式为
(4)控制反应条件,反应①中的产物也可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比[
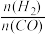 ]的变化如图所示:
]的变化如图所示:
合成二甲醚的最佳氢碳比为
(5)在标态(反应物和产物都处于100kPa)和T(K)条件下由稳定单质生成1mol化合物的焓变称为该物质在T(K)时的标准焓,用符号△Hθ表示。已知石墨和一氧化碳的燃烧热△H分别为-393.5kJ•mol-1和—283.0 kJ •mol-1,则CO2(g)、CO(g)的△Hθ分别为
您最近一年使用:0次
2016-12-09更新
|
309次组卷
|
3卷引用:2016届湖北省沙市中学高三下第三次半月考理综化学试卷
名校
解题方法
10 . CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)= H2O(g) ΔH2
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________ 。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有____。
(3)工业可采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,
在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
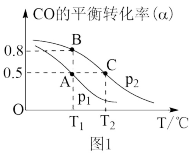
①合成甲醇的反应为_____ (填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为_________ 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为______________ L。
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图______________ .
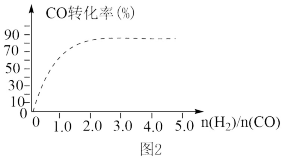
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________ 。

(1)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)= H2O(g) ΔH2
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有____。
| A.2v(H2)= v(CO) |
| B.CO的消耗速率等于CH3OCH3的生成速率 |
| C.容器内的压强保持不变 |
| D.混合气体的密度保持不变 |
| E.混合气体的平均相对分子质量不随时间而变化 |
CO(g)+ 2H2(g)
 CH3OH(g)
CH3OH(g)在一容积可变的密闭容器中充有10molCO和20mol H2,
在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。

①合成甲醇的反应为
②A、B、C三点的平衡常数KA、KB、KC的大小关系为
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图

⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是

您最近一年使用:0次
2016-12-09更新
|
1018次组卷
|
3卷引用:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷



