名校
解题方法
1 . 随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g) ΔH。回答下列问题:
CH3NH2(g)+H2O(g) ΔH。回答下列问题:
(1)上述反应中所需的甲醇工业上利用水煤气合成,已知
①CO(g)+ O2(g)═CO2(g) △H1=-284kJ/mol
O2(g)═CO2(g) △H1=-284kJ/mol
②H2(g)+ O2(g)═H2O(g) △H2=-248kJ/mol
O2(g)═H2O(g) △H2=-248kJ/mol
③CH3OH(g)+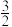 O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
CO(g)+2H2(g) CH3OH(g)ΔH=
CH3OH(g)ΔH=___ 。
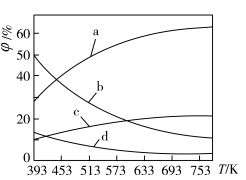
(2)在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____ 。
②X轴上b点的数值比a点___ (填“大”或“小”)。某同学认为图中Y轴表示温度,你认为他判断的理由是___ 。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=___ ;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbI2(s)+2Cl-(aq) PbCl2(s)+2I-(aq)的平衡常数K=
PbCl2(s)+2I-(aq)的平衡常数K=___ 。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g) 2HI(g)的ΔH
2HI(g)的ΔH__ (填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I- I3-,图2中曲线a、b分别代表的微粒是
I3-,图2中曲线a、b分别代表的微粒是___ 、___ (填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___ 。
 CH3NH2(g)+H2O(g) ΔH。回答下列问题:
CH3NH2(g)+H2O(g) ΔH。回答下列问题:(1)上述反应中所需的甲醇工业上利用水煤气合成,已知
①CO(g)+
 O2(g)═CO2(g) △H1=-284kJ/mol
O2(g)═CO2(g) △H1=-284kJ/mol②H2(g)+
 O2(g)═H2O(g) △H2=-248kJ/mol
O2(g)═H2O(g) △H2=-248kJ/mol③CH3OH(g)+
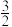 O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/molCO(g)+2H2(g)
 CH3OH(g)ΔH=
CH3OH(g)ΔH=(2)在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②X轴上b点的数值比a点
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=
 PbCl2(s)+2I-(aq)的平衡常数K=
PbCl2(s)+2I-(aq)的平衡常数K=(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)
 2HI(g)的ΔH
2HI(g)的ΔH②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O
 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I- I3-,图2中曲线a、b分别代表的微粒是
I3-,图2中曲线a、b分别代表的微粒是
您最近一年使用:0次
2019-11-19更新
|
352次组卷
|
3卷引用:福建省仙游第一中学、福州八中2020届高三上学期第三次质检(期中)考试化学试题
名校
解题方法
2 . 低碳经济是指在可持续发展理念指导下,尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。下列是有关碳元素的相关转化,回答下列问题:
(1)已知甲醇是一种清洁燃料,制备甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为∆H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g) CH3OH(l)△H=
CH3OH(l)△H=________ kJ/mol。
(2)一定温度下,一定可以提高甲醇合成速率的措施有( )
a.增大起始通入 值
值
b.恒温恒容,再通入氦气
c.使用新型的高效正催化剂
d.将产生的甲醇及时移走
e.压缩体积,增大压强
(3)在恒温恒容条件下,下列说法可以判定反应CO(g)+2H2(g) CH3OH(g)已经达到平衡状态的是
CH3OH(g)已经达到平衡状态的是( )
a.体系中碳氢单键数目不再改变
b.体系中n(CO):n(H2)不再改变
c.体系中压强或者平均摩尔质量不再改变
d.单位时间内消耗氢气和CH3OH的物质的量相等
(4)在恒压的容器中,曲线X、Y、Z分别表示在T1°C、T2°C和T3°C三种温度下合成甲醇气体的过程。控制不同的原料投料比,CO的平衡转化率如图所示:
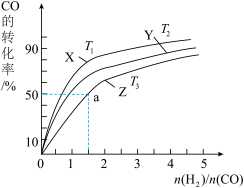
①温度T1°C、T2°C和T3°C由高到低的顺序为:_________________ ;
②若温度为T3°C时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=1.5,则平衡时CO和CH3OH的分压之比为__________ ,该反应的压强平衡常数Kp的计算式为__________ 。(Kp生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压强×该物质的物质的量分数)。
(1)已知甲醇是一种清洁燃料,制备甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为∆H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g)
 CH3OH(l)△H=
CH3OH(l)△H=(2)一定温度下,一定可以提高甲醇合成速率的措施有
a.增大起始通入
 值
值b.恒温恒容,再通入氦气
c.使用新型的高效正催化剂
d.将产生的甲醇及时移走
e.压缩体积,增大压强
(3)在恒温恒容条件下,下列说法可以判定反应CO(g)+2H2(g)
 CH3OH(g)已经达到平衡状态的是
CH3OH(g)已经达到平衡状态的是a.体系中碳氢单键数目不再改变
b.体系中n(CO):n(H2)不再改变
c.体系中压强或者平均摩尔质量不再改变
d.单位时间内消耗氢气和CH3OH的物质的量相等
(4)在恒压的容器中,曲线X、Y、Z分别表示在T1°C、T2°C和T3°C三种温度下合成甲醇气体的过程。控制不同的原料投料比,CO的平衡转化率如图所示:

①温度T1°C、T2°C和T3°C由高到低的顺序为:
②若温度为T3°C时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=1.5,则平衡时CO和CH3OH的分压之比为
您最近一年使用:0次
名校
解题方法
3 . CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益。请回答下列问题:
(1)利用废气中的CO2为原料可制取甲醇。一定条件下,在恒容密闭容器中发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ·mol-1;
CH3OH (1)===CH3OH (g) △H=+35.2kJ·mol-1;
H2O(1)===H2O(g) △H=+44kJ·mol-1。
则CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=
CH3OH(g)+H2O(g) △H=___________ kJ·mol-1。有利于提高H2平衡转化率的条件是___________ (填选项字母)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,向体积为2L的容器中充入6molH2、4 mol CO2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为___________ (保留两位有效数字)。
③起始条件(T1℃、2L密闭容器)如表所示:
达到平衡时,该反应的平衡常数:K(I)___________ K(Ⅱ)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度:c(I)___________ c(Ⅱ)。
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(
CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(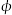 )如图所示:
)如图所示:
①曲线b、c表示的物质分别为___________ 、___________ (填化学式)。
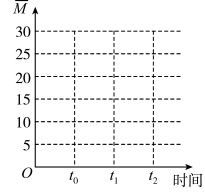
②保持温度不变,在体积为VL的恒容容器中以n(CO2)︰n(H2)=2︰3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象_________ 。
(1)利用废气中的CO2为原料可制取甲醇。一定条件下,在恒容密闭容器中发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。①已知:H2(g)、CH3OH(1)的燃烧热(△H)分别为-285.8kJ·mol-1和-726.5kJ·mol-1;
CH3OH (1)===CH3OH (g) △H=+35.2kJ·mol-1;
H2O(1)===H2O(g) △H=+44kJ·mol-1。
则CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=
CH3OH(g)+H2O(g) △H=A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,向体积为2L的容器中充入6molH2、4 mol CO2,发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为
CH3OH(g)+H2O(g),达到平衡时H2的转化率为50%,其平衡常数为③起始条件(T1℃、2L密闭容器)如表所示:
| CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
| I(恒温恒容) | 2 | 6 | 0 | 0 |
| II(绝热恒容) | 0 | 0 | 2 | 2 |
达到平衡时,该反应的平衡常数:K(I)
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)
 CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(
CH2=CH2(g)+4H2O(g) △H=-127.8 kJ·mol-1。0.1MPa下,按n(CO2)︰n(H2)=1︰3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度(T)下平衡时的四种气态物质的质量分数(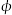 )如图所示:
)如图所示:
①曲线b、c表示的物质分别为
②保持温度不变,在体积为VL的恒容容器中以n(CO2)︰n(H2)=2︰3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2VL并保持不变,t2时重新达到平衡。请在图中画出容器内混合气体的平均相对分子质量M随时间的变化图象

您最近一年使用:0次
2019-02-17更新
|
708次组卷
|
2卷引用:福建2020届高三化学总复习专题训练——选修四化学反应原理测试
名校
4 . 以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝.电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用.
请回答:
(1)已知:2Al2O3(s)═4Al(g)+3O2(g)△H1=3351KJ•mol﹣1
2C(s)+O2(g)═2CO(g)△H2=﹣221KJ•mol﹣1
2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJ•mol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是___________________________ 。
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比).
反应ⅠCO2(g)+4H2(g) CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4
反应ⅡCO2(g)+H2(g) CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
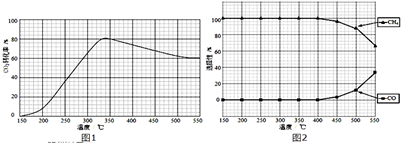
①下列说法不正确的是_______
A.△H4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL该温度下反应Ⅰ的平衡常数为______ (用a、V表示)
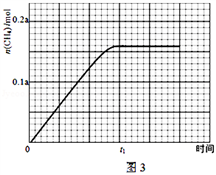
③350℃下CH4物质的量随时间的变化曲线如图3所示.画出400℃下0~t1时刻CH4物质的量随时间的变化曲线_______ .
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是_______ .
请回答:
(1)已知:2Al2O3(s)═4Al(g)+3O2(g)△H1=3351KJ•mol﹣1
2C(s)+O2(g)═2CO(g)△H2=﹣221KJ•mol﹣1
2Al(g)+N2(g)═2AlN(s)△H3=﹣318KJ•mol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比).
反应ⅠCO2(g)+4H2(g)
 CH4(g)+2H2O(g)△H4
CH4(g)+2H2O(g)△H4反应ⅡCO2(g)+H2(g)
 CO(g)+H2O(g)△H5
CO(g)+H2O(g)△H5
①下列说法不正确的是
A.△H4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL该温度下反应Ⅰ的平衡常数为
③350℃下CH4物质的量随时间的变化曲线如图3所示.画出400℃下0~t1时刻CH4物质的量随时间的变化曲线

(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是
您最近一年使用:0次
9-10高二下·福建龙岩·期末
解题方法
5 .
(1)在25℃、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:_______________________ 。
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g); △H=-394kJ/mol;
2CO(g)+O2(g)=2CO2(g); △H=-566kJ/mol;
2H2(g)+O2(g)=2H2O(g); △H=-484 kJ/mol;
①在25℃、101kPa时,1 g甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:___________________________________ 。
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气和一氧化碳的热化学方程式_______________________ 。
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧气。写出负极的电极反应式___________________ 。
②下列有关甲醇燃料电池的说法中,错误的是_________ 。
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO
D.甲醇燃料电池中使用的氢氧化钾浓度保持不变
(1)在25℃、101KPa时,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ,则能表示甲醇燃烧的热化学方程式为:
(2)已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g); △H=-394kJ/mol;
2CO(g)+O2(g)=2CO2(g); △H=-566kJ/mol;
2H2(g)+O2(g)=2H2O(g); △H=-484 kJ/mol;
①在25℃、101kPa时,1 g甲醇不完全燃烧生成1∶1的CO、CO2和液态水,写出此甲醇燃烧的热化学方程式:
②工业上可由CO和H2合成甲醇。试写出由C(s)与水蒸气在高温条件下反应生成氢气和一氧化碳的热化学方程式
(3)利用甲醇可设计燃料电池。
①如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入甲醇和氧气。写出负极的电极反应式
②下列有关甲醇燃料电池的说法中,错误的是
A.甲醇燃料电池的负极发生氧化反应
B.甲醇燃料电池的电子由负极、经外电路流入正极
C.甲醇燃料电池在负极区产生CO

D.甲醇燃料电池中使用的氢氧化钾浓度保持不变
您最近一年使用:0次
6 . 氢氰酸(HCN)是一种具有苦杏仁气味的无色液体,易溶于水。回答下列问题:
(1)一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸。
①氨气的电子式为______________ 。
②合成氢氰酸的化学方程式为________ 。
(2)已知25℃时HCN和H2CO3的电离常数(Ka)如下表:
25 ℃时,物质的量浓度均为0.1 mol • L-1的NaCN、NaHCO3和Na2CO3三种溶液,其pH最大的是________ (填化学式)。
(3)—定条件下,HCN与H2和H2O反应如下:
I. HCN(g)+3H2(g)⇌NH3(g)+CH4(g) △H1
Ⅱ.HCN(g) + H2O(g)⇌NH3(g)+CO(g) △H2
①反应Ⅲ,CO(g)+3H2(g)⇌CH4(g)+H2O(g)的△H=__________ (用△H1、△H2表示)。
②对于反应Ⅱ,减小压强,HCN的转化率______ (填“提高”、“不变”或“降低”)。
③反应I、Ⅱ的平衡常数对数值(lgK)与温度的关系如图甲所示,则T1K时,反应Ⅲ的平衡常数对数值lgK=_________ 。
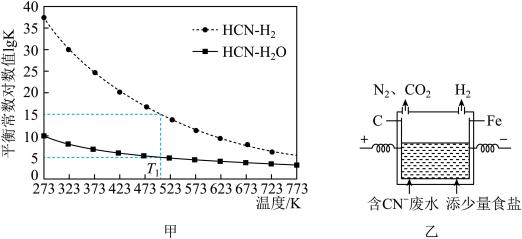
(4)电解法处理含氰废水的原理如图乙所示,阳极CN-先发生电极反应:CN-+2OH--2e-= CNO-+H2O,CNO-在阳极上进一步氧化的电极反应式为________________ 。
(1)一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸。
①氨气的电子式为
②合成氢氰酸的化学方程式为
(2)已知25℃时HCN和H2CO3的电离常数(Ka)如下表:
| 物质 | 电离常数(Ka) |
| HCN | Ka=5×10-10 |
| H2CO3 | Ka1=4. 5×10-7 Ka2=4.7×10-11 |
(3)—定条件下,HCN与H2和H2O反应如下:
I. HCN(g)+3H2(g)⇌NH3(g)+CH4(g) △H1
Ⅱ.HCN(g) + H2O(g)⇌NH3(g)+CO(g) △H2
①反应Ⅲ,CO(g)+3H2(g)⇌CH4(g)+H2O(g)的△H=
②对于反应Ⅱ,减小压强,HCN的转化率
③反应I、Ⅱ的平衡常数对数值(lgK)与温度的关系如图甲所示,则T1K时,反应Ⅲ的平衡常数对数值lgK=

(4)电解法处理含氰废水的原理如图乙所示,阳极CN-先发生电极反应:CN-+2OH--2e-= CNO-+H2O,CNO-在阳极上进一步氧化的电极反应式为
您最近一年使用:0次
7 . 硫化碳又称氧硫化碳(化学式为COS),是农药、医药和其它有机合成的重要原料。COS的合成方法之一是在无溶剂的条件下用CO与硫蒸气反应制得,该法流程简单、收效高,但含有CO2、SO2等杂质。
(1)COS的电子式为_________ 。
(2)已知CO2催化加氢合成乙醇的反应原理是: 2CO2(g)+6H2(g) C2H5OH+3H2O(g) △H=-173.6 kJ/mol
C2H5OH+3H2O(g) △H=-173.6 kJ/mol
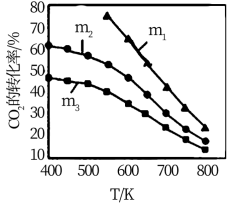
下图是不同起始投料时,CO2的平衡转化率随温度变化的关系,图中m=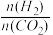 ,为起始时的投料比,则 m1、m2、m3从大到小的顺序为
,为起始时的投料比,则 m1、m2、m3从大到小的顺序为_______ ,理由是____________ 。
(3)天然气部分氧化制取的化工原料气中,常含有COS。目前COS水解是脱除COS的常见方法,即COS在催化剂作用下与水蒸气反应生成硫化氢,生成的硫化氢可用氧化锌等脱硫剂脱除。
①COS 水解的化学方程式为_________________ 。
②常温下,实验测得脱硫(脱除硫化氢)反应过程中,每消耗4.05gZnO,放出3.83 kJ热量。该脱硫反应的热化学方程式为_________________ 。
③近年来,电化学间接氧化法处理硫化氢的技术得到较快发展。该方法是利用Fe3+在酸性条件下与H2S反应生成硫单质,反应后的溶液再用电解的方法“再生”,实现循环利用。电解法使Fe3+“再生”的离子方程式为___________ ,该反应的阳极材料是______ 。
④常温下,HCl和CuCl2的混合溶液中,c(H+) =0.30mol/L,c(Cu2+) =0.10mol/L,往该溶液中通入H2S 至饱和(H2S的近似浓度为0.10mol/L),_____ (填“能”或“不能”)出现沉淀,用必要的计算过程和文字说明理由。
(已知Ka1(H2S)= 1.3×10-7,Ka2(H2S)= 7.0×10-5,Ksp(CuS) = 1.4×10-36)
(1)COS的电子式为
(2)已知CO2催化加氢合成乙醇的反应原理是: 2CO2(g)+6H2(g)
 C2H5OH+3H2O(g) △H=-173.6 kJ/mol
C2H5OH+3H2O(g) △H=-173.6 kJ/mol下图是不同起始投料时,CO2的平衡转化率随温度变化的关系,图中m=
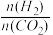 ,为起始时的投料比,则 m1、m2、m3从大到小的顺序为
,为起始时的投料比,则 m1、m2、m3从大到小的顺序为
(3)天然气部分氧化制取的化工原料气中,常含有COS。目前COS水解是脱除COS的常见方法,即COS在催化剂作用下与水蒸气反应生成硫化氢,生成的硫化氢可用氧化锌等脱硫剂脱除。
①COS 水解的化学方程式为
②常温下,实验测得脱硫(脱除硫化氢)反应过程中,每消耗4.05gZnO,放出3.83 kJ热量。该脱硫反应的热化学方程式为
③近年来,电化学间接氧化法处理硫化氢的技术得到较快发展。该方法是利用Fe3+在酸性条件下与H2S反应生成硫单质,反应后的溶液再用电解的方法“再生”,实现循环利用。电解法使Fe3+“再生”的离子方程式为
④常温下,HCl和CuCl2的混合溶液中,c(H+) =0.30mol/L,c(Cu2+) =0.10mol/L,往该溶液中通入H2S 至饱和(H2S的近似浓度为0.10mol/L),
(已知Ka1(H2S)= 1.3×10-7,Ka2(H2S)= 7.0×10-5,Ksp(CuS) = 1.4×10-36)
您最近一年使用:0次
解题方法
8 . 含氮化合物的研发与绿色反展、经济可持续发展有着密切关联。
(1)氨是一种重要化工原料。合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如下图所示。
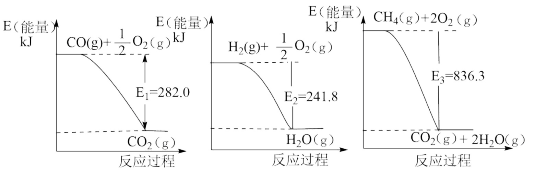
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:_______ 。
(2)氮的氧化物有着广泛用途,又是环境的污染物。
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g) N2O4(g)。
N2O4(g)。
每隔一定时间测定容器内各物质的物质的量,数据如下表:
①当反应在1500C达到平衡时,该反应平衡常数K=________ 。(填数值)
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为_______ 。
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2) =1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质。若用1mol尿素吸收该尾气,则能吸收氮氧化物_______ g。
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)==CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:①b应控制在________ ;
A.1.5. 1.6 B.1~1.1 C.0.6~0.7
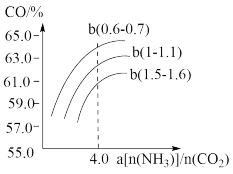
②a应控制在4.0的理由是_______ 。
(1)氨是一种重要化工原料。合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如下图所示。

则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:
(2)氮的氧化物有着广泛用途,又是环境的污染物。
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)
 N2O4(g)。
N2O4(g)。每隔一定时间测定容器内各物质的物质的量,数据如下表:
| 时间 | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①当反应在1500C达到平衡时,该反应平衡常数K=
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度应为
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2) =1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素反应生成对环境无污染的物质。若用1mol尿素吸收该尾气,则能吸收氮氧化物
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)==CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:①b应控制在
A.1.5. 1.6 B.1~1.1 C.0.6~0.7

②a应控制在4.0的理由是
您最近一年使用:0次
名校
9 . 已知氨气在生活、生产、科研中有极广泛用途。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和液态水 的热化学方程式为___________________ ,该反应在_________ 条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________ ;
②计算得到可逆反应AgCl (s)+2NH3(aq) Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________ ;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______ mol(保留2位有效数字)。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)
 Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=②计算得到可逆反应AgCl (s)+2NH3(aq)
 Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=
您最近一年使用:0次
2017-12-31更新
|
196次组卷
|
2卷引用:【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第二次月考化学试题
名校
解题方法
10 . Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
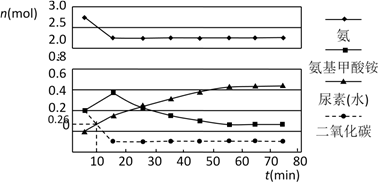
已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________ 步反应决定,总反应进行到_________ min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________ 。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s ) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
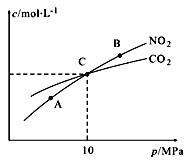
①A、B两点的浓度平衡常数关系:Kc(A)_______ Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______ (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )
 N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)
②计算C点时该反应的压强平衡常数Kp(C)=
您最近一年使用:0次



