名校
解题方法
1 . 灰锡(以粉末状存在)和白锡是锡的两种同素异形体。下列说法正确的是
已知:①
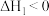
②
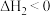
③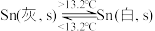
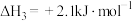
已知:①

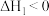
②

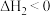
③
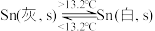
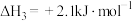
A.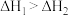 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
D.锡制器皿长期处在低于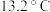 的环境中,会自行毁坏 的环境中,会自行毁坏 |
您最近一年使用:0次
2023-12-18更新
|
86次组卷
|
89卷引用:广东省珠海市第二中学2021-2022学年高二上学期期中考试化学试题
广东省珠海市第二中学2021-2022学年高二上学期期中考试化学试题广东仲元中学2021-2022学年高二上学期开学检测 化学试题(已下线)2014-2015学年广东东莞市第七中学高二上学期第一次月考化学试卷广东省汕头市澄海中学2020-2021学年高二上学期期中考试化学(选考)试题河北省张家口市宣化第一中学2020-2021学年高二上学期1月月考化学试题云南省通海县一中2020-2021学年高二下学期期中考试化学试题(已下线)第一节 化学反应与能量变化 (第2课时 热化学方程式 中和热的测定)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)1.1.2 热化学方程式-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)1.1.2 热化学方程式 燃烧热-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)安徽省合肥新城高升学校2021-2022学年高二上学期第一次月考化学试题河北省藁城新冀明中学2021-2022学年高二上学期10月月考化学试题内蒙古赤峰市第二中学2021-2022学年高二上学期第一次月考化学试题河北省衡水市第十四中学(西校区)2021-2022学年高二上学期二调考试化学试题四川省遂宁市射洪中学校2021—2022学年高二上学期第三次(12月)月考化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题江西省丰城市第九中学2021-2022学年高二上学期期中考试(日新班)化学试题河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题福建省平潭翰英中学2021-2022学年高二上学期第一次月考(选考)化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题广东华侨中学2022-2023学年高二上学期期中考试化学试题广东省广州市越秀区第七中学2023-2024学年高二上学期10月月考化学试题广东省佛山市顺德区罗定邦中学2023-2024学年高二上学期期中考试化学试题广东省深圳市罗湖外语学校2023-2024学年高二上学期期中考试化学试题(已下线)2011-2012天津南开中学高二第一学期期中考试理科化学试卷(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试2化学试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年山东寿光中学高二上10月月考化学试卷2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷2016-2017学年河北冀州中学高二上第一次月考化学试卷云南省姚安县第一中学2017-2018学年高二10月月考化学试题江西省南康中学2017-2018学年高二上学期第一次月考化学试题浙江省嘉兴市第一中学2017-2018学年高二上学期期中考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高二上学期11月考试化学试题(已下线)黄金30题系列 高二化学(选修4) 小题好拿分【提升版】【全国校级联考】浙江省金华市十校2017-2018学年高二下学期期末联考化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题浙江省宁波市北仑中学2018-2019学年高二上学期期初返校考试化学试题云南省曲靖市会泽县一中2018-2019学年高二上学期第一次半月考化学试题安徽省芜湖市顶峰美术学校2018-2019学年高二上学期第一次月考化学试题陕西省西安市远东第一中学2018-2019学年高二上学期10月月考化学试题吉林省白城市通榆县第一中学2019-2020学年高二上学期第一次月考化学试题山西省晋中市平遥县第二中学2019-2020学年高二10月月考化学试题福建省泉州第十六中学2019-2020学年高二10月份月考化学试题湖南省长沙市第一中学2019-2020学年高二上学期第一次月考化学试题四川省乐山市2019-2020学年高二上学期期末教学质量检测化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1(已下线)第01章 化学反应的热效应(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)吉林省辽源市田家炳高级中学校2020-2021学年高二上学期第一次月考化学试题陕西省汉中市洋县中学2020-2021学年高二上学期第一次月考化学试题江西省赣州市南康区南康中学2020-2021学年高二上学期第三次大考化学试题河北省石家庄市第二十三中学2020-2021学年高一第二学期5月月考化学试题吉林省长春市十一高中2020-2021学年高一下学期第三学程考试化学试题江西省九江一中2020-2021学年高二上学期月考化学试题江西省六校2021-2022学年高二上学期期末联考化学试题宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题河南省豫西顶级名校2021-2022学年高二下学期4月联考化学试题第二节 反应热的计算 第1课时 盖斯定律(已下线)第04讲 第一章《化学反应的热效应》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)1.2 反应热的计算-同步学习必备知识江西省金溪县第一中学2022-2023年度高二上学期第一次月考化学试题河南省通许县一中2022—2023年高二上学期第一次月考化学试题安徽省芜湖市无为襄安中学2022-2023高二上学期第一次月考化学试题陕西省安康市2022-2023学年高二上学期11月期中化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题浙江省金华市江南中学等两校2022-2023学年高二上学期12月阶段测试化学试题安徽省马鞍山市第二十二中学2022-2023学年高二上学期阶段检测化学试题内蒙古自治区包头市第九中学2022-2023学年高二上学期期末考试化学试题作业(三) 反应热的计算作业(三) 反应焓变的计算河南省开封市祥符高级中学2023-2024学年高二上学期第一次月考化学试题黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高二9月月考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期10月月考化学试题山西省朔州市怀仁市第九中学高中部2023-2024学年高二上学期11月期中化学试题云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题黑龙江省方正县高楞高级中学校2023-2024学年高二上学期期中化学试题(已下线)2010~2011学年辽宁省瓦房店市高级中学高一下学期期末考试(已下线)2011-2012学年湖北武汉部分重点中学高一下学期期末考试化学题(已下线)2013-2014黑龙江省哈六中学高一下学期期中考试化学试卷高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第一课时(盖斯定律)【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高一下学期期末考试化学试题福建2020届高三化学总复习专题训练——选修四化学反应原理测试海南省海口市海南中学2020届高三下学期第七次月考化学试题海南省海南中学2020届高三下学期第七次月考化学试题河北省石家庄市第二中学2021-2022学年高一下学期期中考试化学试题安徽省安庆二中2022-2023学年高一下学期5月月考化学试题湖南省常德市汉寿县第一中学2023-2024学年高三下学期开学化学试题河北省石家庄卓越中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
2 . 在298K、101kPa时,已知:



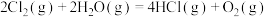

则 与
与 和
和 间的关系正确的是
间的关系正确的是




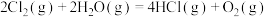

则
 与
与 和
和 间的关系正确的是
间的关系正确的是A.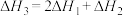 | B. |
C.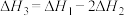 | D.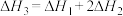 |
您最近一年使用:0次
2023-12-11更新
|
270次组卷
|
11卷引用:广东省普宁市第二中学2021-2022学年高二上学期期中考试化学试题
广东省普宁市第二中学2021-2022学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题广东省江门市鹤山市第一中学2022-2023学年高二上学期第二阶段考试化学试题广东省广州市第三中学、第四中学、培正中学2023-2024学年高二上学期期中考试化学试题宁夏吴忠市盐池高级中学2019-2020学年高二上学期期末检测化学试题天津市第二南开学校2022-2023学年度高二上学期期中质量调查化学试题贵州省黔西南布依族苗族自治州2022-2023学年高二上学期期末考试化学试题北京市第五十中学2023-2024学年高二上学期期中考试化学试题新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期第二次月考化学试题福建省龙岩市永定区城关中学2023-2024学年高二上学期期中考试化学试题陕西省延安市富县高级中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
3 . 已知下列反应:O2(g)+C(s) CO2(g) K1;2C(s)+O2(g)
CO2(g) K1;2C(s)+O2(g) 2CO(g) K2; 则反应2CO(g)+O2(g)
2CO(g) K2; 则反应2CO(g)+O2(g) 2CO2(g)的平衡常数为
2CO2(g)的平衡常数为
 CO2(g) K1;2C(s)+O2(g)
CO2(g) K1;2C(s)+O2(g) 2CO(g) K2; 则反应2CO(g)+O2(g)
2CO(g) K2; 则反应2CO(g)+O2(g) 2CO2(g)的平衡常数为
2CO2(g)的平衡常数为A.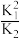 | B.2K1-K2 | C.K12×K2 | D.2K1+K2 |
您最近一年使用:0次
2023-10-05更新
|
298次组卷
|
17卷引用:广东省深圳市龙华中学2021-2022学年高二上学期第二次考试化学试题
广东省深圳市龙华中学2021-2022学年高二上学期第二次考试化学试题重庆市2021-2022学年高二上学期期中考试化学试题福建省龙岩市六县一中2021-2022学年高二上学期期中联考化学试题贵州省黔西南州2021~2022学年高二上学期期中考试化学试题福建省武平县第一中学2021-2022学年高二上学期期中考试化学试题辽宁省葫芦岛市协作校2021-2022学年高二上学期第二次考试化学试题浙江省金华市江南中学2021-2022学年高二上学期期中考试化学试题四川省邻水实验学校2021-2022学年高二上学期期中考试化学试题陕西省渭南市尚德中学2021-2022学年高二上学期第二次质量检测化学试题云南省昆明市第一中学2021-2022学年高二下学期期中考试化学试题福建省长汀县第一中学2022-2023学年高二上学期第一次月考化学试题云南省保山市高(完)中C、D类学校2022-2023学年高二上学期10月份联考化学试题四川省南充高级中学2023-2024学年高二上学期10月月考化学试题福建省永春华侨中学2022-2023学年高二上学期期中考试化学试题云南省昆明市第一中学2023-2024学年高二上学期期中化学试题陕西省延安市延川县中学2023-2024学年高二上学期第一次月考化学试题云南省文山州广南县第十中学校2023-2024学年高二上学期10月月考化学试题
4 . 下列热化学方程式书写正确的是( 的绝对值均正确)
的绝对值均正确)
 的绝对值均正确)
的绝对值均正确)A.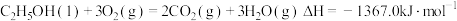 (燃烧热) (燃烧热) |
B.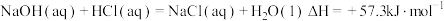 (中和热) (中和热) |
C.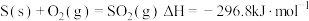 (反应热) (反应热) |
D. (反应热) (反应热) |
您最近一年使用:0次
2023-05-01更新
|
785次组卷
|
153卷引用:广东省执信中学番禺附属学校2021-2022学年高二上学期期中考试化学试题
广东省执信中学番禺附属学校2021-2022学年高二上学期期中考试化学试题(已下线)2011-2012学年广东省广州市六中高二上学期期中考试化学(理)试卷(已下线)2011-2012年广东东莞南城中学高二上学期期中考试化学试卷(已下线)2014-2015学年广东省肇庆第四中学高二上学期第一次月考理科化学卷2014-2015学年广东省广州地区人教版高二上期末化学理试卷广东省揭阳市惠来县第一中学2019-2020学年高二上学期第一次阶段考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)安徽省六安市舒城中学2020-2021学年高二上学期期末考试化学试题云南省文山州砚山县第三高级中学2020-2021学年高二1月月考化学试题新疆维吾尔自治区呼图壁县第一中学2020-2021学年高二下学期期初考试化学试题河南省宏力学校2020-2021学年高二上学期期末考试化学试题(已下线)专题1.1.2 热化学方程式的书写(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)甘肃省临夏县中学2021-2022学年高二上学期第一次月考化学(B卷)试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题四川省绵阳第一中学2021-2022学年高二上学期期中教学质量测试化学试题广东省广州市玉岩中学2022-2023学年高二上学期10月月考化学试题新疆巴楚县第一中学2021-2022学年高二上学期期中考试化学试题广东省揭阳市惠来县第一中学2022-2023学年高二上学期期中考试化学试题福建省南安市柳城中学2021-2022学年高二上学期期中考试化学试题(已下线)2010年浙江温州中学第二学期期中考试高二化学试卷(已下线)2011-2012年河南省郑州四十七中高二上学期第一次月考化学试卷(已下线)2011-2012年河南省许昌四校高二上学期第一次联考化学试题(已下线)2011-2012学年吉林省吉林一中高二上学期质量检测化学试卷(已下线)2011-2012年安徽红星中安工大附中高二下学期期中联考理科化学试卷(已下线)2011-2012学年浙江瑞安中学高二下学期期中考试化学试卷(已下线)2011-2012学年安徽省蚌埠市高二第二学期期中联考试化学试卷(已下线)2011-2012学年河南省永城实验高中高二上学期期中考试化学试卷(已下线)2012-2013学年内蒙古巴彦淖尔市一中高二9月月考化学试卷(已下线)2012-2013学年黑龙江省庆安三中高二上学期期中考试化学试卷(已下线)2012-2013学年江苏泰州二中高二上学期期中考试化学(选修)试卷(已下线)2013-2014学年江苏省泰州市姜堰区高二上学期期中考试化学试卷(已下线)2013-2014学年河南省漯河市高二上学期期中考试化学试卷(已下线)2014年高二化学人教版选修四 3燃烧热 能源练习卷(已下线)2013-2014学年江苏省无锡江阴市高二下学期期中考试化学试卷(已下线)2015届安徽省望江中学同步课时练(人教选修4)1.2 燃烧热能源试卷(已下线)2014-2015学年吉林省延边二中高二上学期期中理科化学卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷(已下线)2014-2015学年山西省山大附中高二上学期期中化学试卷2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷2015-2016学年黑龙江哈尔滨六中高二上期中测试化学试卷2015-2016学年河北省成安县第一中学高二12月月考化学试卷2015-2016学年山西省怀仁一中高二下第一次月考化学试卷2015-2016学年青海省西宁四中高二上学期期末化学试卷2015-2016学年江西省上高二中高二下4月月考化学试卷2016-2017学年云南省曲靖市沾益一中高二上第一次月考化学卷2016-2017学年四川省彭州中学高二上10月月考化学试卷2016-2017学年山东省济南市长清一中高二上第一次质检化学卷2016-2017学年湖北省蕲春县高二上学期期中化学试卷2016-2017学年安徽省马鞍山市第二中学高二上学期期末考试化学试卷山西省实验中学2017-2018学年高二上学期10月月考化学试题河北省定州市第二中学2017-2018学年高二上学期第一次月考化学试题湖南省嘉禾一中、临武一中2017-2018学年高二上学期期中联考化学试题江苏省启东中学2017-2018学年高二上学期期中考试化学(选修)试题湖北省华中师范大学第一附属中学2017-2018学年高二上学期期中考试化学试题湖南省津市一中2017-2018学年高二第一学期期中考试化学(理)试卷湖南省临武一中、嘉禾一中2017-2018学年高二12月联考化学试题宁夏吴忠中学2017-2018学年高二上学期期末考试化学试题宁夏吴忠市吴忠中学2017-2018学年第一学期高二化学期末考试试卷宁夏育才中学学益校区2017-2018学年高二下学开学考试化学试题【全国百强校】广西陆川县中学2017-2018学年高二5月月考化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题山西省汾阳市第二高级中学2018-2019学年高二上学期第二次半月考化学试题【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期第一次月考化学试题甘肃省白银市靖远县第四中学2018-2019学年高二上学期期中考试化学试题【市级联考】湖南省娄底市2018-2019学年高二上学期期中考试化学试题【区级联考】天津市武清区2018-2019学年高二上学期期中质量调查化学试题【全国百强校】河北省衡水市武邑中学2018-2019学年高二上学期期中考试化学试题福建省惠安惠南中学2018-2019学年高二上学期期中考试化学试题江西省铅山县第一中学2018-2019学年高二上学期期中考试化学试题(已下线)2018年12月20日 《每日一题》人教选修4-热化学方程式的书写与判断【校级联考】江苏省华罗庚中学、江都中学和仪征中学2018-2019学年高二上学期12月联考化学试题吉林省通化市第十四中学2018-2019学年高二上学期期末考试化学试题【全国百强校】福建省师范大学附属中学2018-2019学年高二上学期期末考试化学试题重庆市第三十中学2018-2019学年高二上学期第三次月考化学试题青海省海东市第二中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】河南省南阳市第一中学2018-2019学年高二下学期第四次月考化学试题河北安平中学2018-2019学年高二下学期期末考试化学试题新疆乌鲁木齐市二十三中学2018-2019学年高二10月月考化学试题山东省济南第一中学2019-2020学年高二10月阶段性检测化学试题江苏省苏州新草桥中学2019-2020学年高二10月月考化学试题山东省肥城市泰西中学2019-2020学年高二10月月考化学试题新疆乌鲁木齐市第四中学2019-2020学年高二上学期期中考试化学试题内蒙古呼和浩特开来中学2019-2020学年高二上学期期中考试化学试题新疆阿瓦提县第四中学2019-2020学年高二上学期期中考试化学试卷河北省张家口市2019-2020学年高二上学期10月阶段测试化学试题河北省石家庄市普通高中2019-2020学年高二10月月考化学(高考)试题甘肃省武山一中2019-2020学年高二第一学期期中考试化学试题步步为赢 高二化学寒假作业:作业一 化学反应中的能量变化甘肃省古浪县第二中学2019-2020学年高二上学期基础知识竞赛化学试题河北省唐山市遵化市第一中学2019-2020学年高二上学期第一次月考化学试题人教版高中化学选修4第一章《化学反应与能量》测试卷黑龙江省牡丹江市东部地区四校联考2019-2020学年高二上学期期末考试化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期中考试理科化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期9月月考化学试题辽宁省瓦房店市实验高级中学2019-2020学年高二上学期第三次月考化学试题河南省焦作市沁阳市第一中学2019-2020高二月考考试化学试题辽宁省葫芦岛市普通高中2019-2020高二上学期期末质量测试化学试题(已下线)1.1.1焓变 反应热(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题(已下线)第01章 化学反应与能量(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)河南省安阳市林州市第一中学2020-2021学年高二上学期开学考试(实验班)化学试题四川省成都市龙泉第二中学2020-2021学年高二上学期入学考试化学试题天津市和平区2018-2019高二期末考试化学试题(已下线)1.1.2+热化学方程式-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)宁夏银川市第二中学2020-2021学年高二上学期月考(一)化学试题河北省邢台市第七中学2019-2020学年高二上学期10月月考化学试题天津市静海区大邱庄中学2020-2021学年高二上学期第一次月考化学试题甘肃省庆阳市宁县第二中学2020-2021学年高二上学期第一次月考化学试题吉林省长春市第一五一中学2020-2021学年高二上学期第一次月考化学试题(希望班)吉林省辽源市田家炳高级中学校2020-2021学年高二上学期期中考试化学试题山东省泰安市新泰中学2019级高二上学期期中考试试题山东省新泰第一中学老校区(新泰中学)2020-2021学年高二上学期期中考试化学试题福建省泉州第十六中学2020-2021学年高二上学期期中考试化学(选考班)试题重庆市凤鸣山中学2020-2021学年高二上学期10月月考化学试题华中师范大学海南附属中学2019-2020学年高二上学期第三次月考化学试题江西省贵溪市实验中学2020-2021学年高一下学期第三次月考化学试题(已下线)专题18 化学反应与能量(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练海南省儋州川绵中学2020-2021学年高二上学期第二次月考化学试题新疆塔城市第三中学2022-2023学年高二上学期第一次月考化学试题云南省昆明市寻甸县第二中学2022-2023学年高二上学期10月月考 化学试卷四川省资阳中学2022-2023学年高二上学期期末考试化学试题(已下线)专题01 反应热、焓变与热化学方程式【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)2009年普通高等学校招生统一考试理综试题化学部分(重庆卷)(已下线)2011届山西省山西大学附属中学高三12月月考化学试卷(已下线)2012届四川省成都外国语学校高三上学期8月月考化学试卷(已下线)2012届甘肃省天水一中高三上学期第一阶段考试化学试卷(已下线)2012届湖南长沙望城区一中高三第四次调研考试化学试卷(已下线)2013学年黑龙江省友谊县红兴隆管理局第一高级中学高一6月月考化学试卷(已下线)2014高考名师推荐化学--预测162014-2015学年吉林省长春市十一中高一下期中化学试卷2016届湖南省衡阳八中高三第一次模拟理综化学试卷2015-2016学年辽宁沈阳二中高一6月月考化学试卷2015-2016学年辽宁省五校协作体高一下学期期中考试化学试卷2015-2016学年四川成都外国语学校高一下期末理科化学卷2015-2016学年辽宁省大连二十中高一6月月考化学试卷黑龙江省肇东市第一中学2016-2017学年高一下学期期中考试化学试题黑龙江省伊春市第二中学2016-2017学年高一下学期期末考试(理)化学试题河南省洛阳市2018届高三上学期期中考试化学试题湖南省岳阳市第一中学2018届高三12月月考化学试题高中化学人教版 选修四 第一章 化学反应与能量 第二节 燃烧热 能源陕西省黄陵中学2018届高三(重点班)上学期期中考试化学试题河北省唐山一中2017-2018学年高一下学期期中考试化学试题【全国百强校】黑龙江省双鸭山市第一中学2017-2018学年高一下学期期末考试化学试题陕西省黄陵中学2017-2018学年高一(重点班)下学期期末考试化学试题(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点吉林省蛟河市一中2018-2019学年高一下学期第三次测试化学试题云南省陆良县第八中学2018-2019学年高一下学期期末考试化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期期末化学试题黑龙江省牡丹江市第三高级中学2020届高三上学期第二次月考化学试题河南省周口中英文学校2020届高三上学期期中考试化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)新疆吾尔自治区哈密市第十五中学2019-2020学年高一下学期期末考试化学试题内蒙古通辽市奈曼旗实验中学2018-2019学年高一下学期期末考试化学试题
名校
解题方法
5 . 将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140.5 kJ∙mol−1
C(s,石墨)+ O2(g)=CO(g) ΔH=−110.5 kJ∙mol−1
O2(g)=CO(g) ΔH=−110.5 kJ∙mol−1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g)的ΔH是
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140.5 kJ∙mol−1
C(s,石墨)+
 O2(g)=CO(g) ΔH=−110.5 kJ∙mol−1
O2(g)=CO(g) ΔH=−110.5 kJ∙mol−1则反应TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g)的ΔH是
| A.+80.5 kJ∙mol−1 | B.+30.0 kJ∙mol−1 | C.−30.0 kJ∙mol−1 | D.−80.5 kJ∙mol−1 |
您最近一年使用:0次
2023-02-23更新
|
647次组卷
|
19卷引用:广东省惠州市2020-2021学年高二上学期期末考试化学试题
广东省惠州市2020-2021学年高二上学期期末考试化学试题广东省惠州市2020-2021学年高二上学期期末质量监测化学试题广东省梅州市大埔县田家炳实验中学2021-2022学年高二上学期第一次段考(月考)化学试题天津市第三中学2021-2022学年高二上学期10月阶段性检测化学试题山东省济宁市微山县第二中学2021-2022学年高二上学期第一学段考试化学试题海南省临高县新盈中学2021-2022学年高二上学期(1-4班)期中考试化学试题广东省阳江市高新区2022-2023学年高二上学期1月期末考试化学试题江苏省南通市海门市包场高级中学2020-2021学年高二上学期学情检测化学试题(选修)福建省南安市侨光中学2020-2021学年高二上学期第二次阶段考化学试题福建省连城县第一中学2022-2023学年高二上学期月考(一)化学试题福建省三明第一中学2022-2023学年高二上学期第一次月考化学试题新疆巴州第一中学2022-2023学年高二上学期10月月考化学试题广东省深圳市罗湖高级中学2022-2023学年高一下学期4月期中考试化学试题(已下线)专题02 盖斯定律、反应热的计算【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期第一次月考化学试题辽宁省重点高中沈阳市联合体2021-2022高一下学期期中考试化学试题湖北省黄冈市麻城第二中学2021-2022学年高一下学期4月月考化学试题内蒙古通辽市重点学校2022-2023学年高一下学期3月质量检测化学试题黑龙江省 牡丹江市第二高级中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
6 . 回答下列问题
(1)在25℃,101kpa下,1g甲醇( )燃烧生成
)燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________ 。
(2)已知几种化学键的键能数据如表所示:
请写出氨气与溴蒸气反应的热化学方程式:___________ 。
(3)已知:
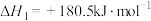

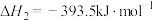
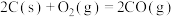
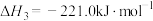
若某反应的平衡常数表达式为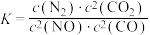 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
(4)根据图示信息写出热化学方程式:___________ 。
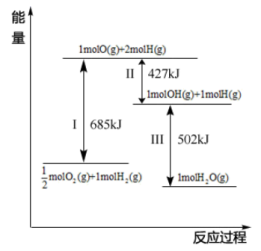
(5)已知:C(s)、CO(g)和 完全燃烧的热化学方程式分别为
完全燃烧的热化学方程式分别为

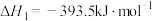


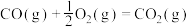
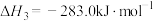
请你根据以上数据,写出C(s)与水蒸气反应生成CO和 的热化学方程式:
的热化学方程式:___________ 。
(1)在25℃,101kpa下,1g甲醇(
 )燃烧生成
)燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为(2)已知几种化学键的键能数据如表所示:
| 化学键 | N—H |  | Br—Br | H—Br |
键能/ | 391 | 946 | 194 | 366 |
(3)已知:

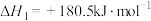

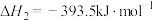
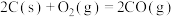
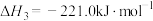
若某反应的平衡常数表达式为
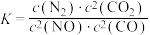 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)根据图示信息写出热化学方程式:

(5)已知:C(s)、CO(g)和
 完全燃烧的热化学方程式分别为
完全燃烧的热化学方程式分别为
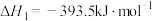


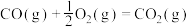
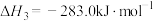
请你根据以上数据,写出C(s)与水蒸气反应生成CO和
 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题:
(1)某研究性学习小组利用Na2S2O3溶液和稀硫酸溶液的反应生成单质硫和二氧化硫,探究浓度和温度对化学反应速率的影响,进行了如下实验:
①写出该反应的离子方程式:_______ 。
②V1 =_______ 、T1 = _______ ;V2 = _______ 。
③实验A、B两个实验对比,可以研究的问题是:_______
(2)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
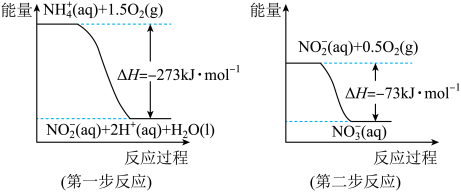
1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
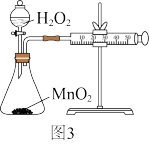
(3)有人用图3进行H2O2与MnO2反应的速率测定实验。
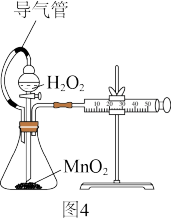
①有人认为可将装置改进为图4,你认为是否合理_______ (选填“合理”或“不合理”)。
②实验中,加入10ml 2mol/L的H2O2,反应10s时,收集到22.4mL氧气,则这10s内,用过氧化氢表示的反应速率是_______ mol/(L·s)。
(1)某研究性学习小组利用Na2S2O3溶液和稀硫酸溶液的反应生成单质硫和二氧化硫,探究浓度和温度对化学反应速率的影响,进行了如下实验:
| 实验序号 | 实验温度/K | 有关物质 | 浑浊所需时间/s | ||||
| 稀硫酸溶液 | Na2S2O3溶液 | H2O | |||||
| V/mL | c/mol·L–1 | V/mL | c/mol·L–1 | V/mL | |||
| A | 298 | 2 | 0.1 | 5 | 0.1 | 0 | t1 |
| B | T1 | 2 | 0.1 | 4 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.1 | V2 | 0.1 | 1 | t2 |
②V1 =
③实验A、B两个实验对比,可以研究的问题是:
(2)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(3)有人用图3进行H2O2与MnO2反应的速率测定实验。

①有人认为可将装置改进为图4,你认为是否合理

②实验中,加入10ml 2mol/L的H2O2,反应10s时,收集到22.4mL氧气,则这10s内,用过氧化氢表示的反应速率是
您最近一年使用:0次
解题方法
8 . Ⅰ.将气体A、B置于固定容积为4L的密闭容器中,发生如下反应:2A(g)+B(g) C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
(1)用生成物C表示20s内的平均反应速率为_________________ mol/(L·s)。
(2)反应前A的物质的量浓度是________________ mol/L。
(3)反应达平衡时,B的转化率为________________ 。
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
Ⅱ.氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:
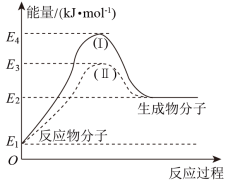
(5)通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1___________ (选填“>”“=”或“<”)0
(6)图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能___________ (选填“>”“=”或“<”)途径(Ⅰ)的活化能。
(7)已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+ O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3
则∆H2=___________ (用∆H1和∆H3的代数式表达)
 C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:(1)用生成物C表示20s内的平均反应速率为
(2)反应前A的物质的量浓度是
(3)反应达平衡时,B的转化率为
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
| 编号 | 改变的条件 | D的生成速率 |
| ① | 降低体系温度 | |
| ② | 恒容下补充A气体 | |
| ③ | 恒容下充入Ne(不参与体系反应) |
Ⅱ.氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:

(5)通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1
(6)图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能
(7)已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+
 O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3则∆H2=
您最近一年使用:0次
9 . ⅰ.“嫦娥”五号预计在海南文昌发射中心发射,火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)
ΔH=-543 kJ·mol-1
(1)写出气态肼和N2O4反应的热化学方程式:_________________ 。
ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(2)该反应的化学平衡常数表达式为K=__ 。
(3)该反应为____ 反应(填“吸热”或“放热”)。
(4)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为___ 。
(5)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K___ 1.0(填“大于”“小于”或“等于”)。
(6)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡___ 移动(填“向正反应方向”“向逆反应方向”或“不”)。
(7)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为___ (填“正反应方向”“逆反应方向”或“不移动”)。
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)
ΔH=-543 kJ·mol-1
(1)写出气态肼和N2O4反应的热化学方程式:
ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(2)该反应的化学平衡常数表达式为K=
(3)该反应为
(4)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为
(5)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K
(6)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡
(7)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为
您最近一年使用:0次
10 . NOX储存还原技术法(NSR)利用催化剂消除汽车尾气中的NOX,具有不需要额外添加还原剂、结构简单等优点,适用下轻型柴油机车和汽油机车。
(1)已知:N2(g)+O2(g)=2NO(g) ∆H1=180.5kJ∙mol-1
2CO(g)+O2(g)=2CO2(g) ∆H2=-566.0kJ∙mol-1
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g) ∆H3=_______ 。
(2)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO模拟NSR反应,反应过程中c(NO)随时间变化的曲线如下图所示。

①曲线a和b中,表示在该温度下使用NSR催化技术的是曲线_______ (填“a”或“b”)。
②曲线b中前10min内CO的平均反应进率v(CO)=_______ mol·L-1·min-1, 此温度下该反应的平衡常数K=_______ L/mol。
③ 在一恒温恒容的密闭容器中发生反应,下列说法不能说明该反应达到化学平衡状态的是_______ (填字母)。
A.体系的压强保持不变 B.混合气体的密度保持不变
C.2v(CO)正=v(N2)逆 D.CO2的浓度保持不变
④若保持其他条件不变,平衡后再向容器中充入CO和N2各0.8mol,则此时v(正)_______ v(逆)(填“>”“<”或“=”)。
⑤若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是点_______ (填“A、B、C、D或E”)。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。下图是不同催化剂Mn 和Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应的温度分别为_______ 。

(1)已知:N2(g)+O2(g)=2NO(g) ∆H1=180.5kJ∙mol-1
2CO(g)+O2(g)=2CO2(g) ∆H2=-566.0kJ∙mol-1
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g) ∆H3=
(2)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO模拟NSR反应,反应过程中c(NO)随时间变化的曲线如下图所示。

①曲线a和b中,表示在该温度下使用NSR催化技术的是曲线
②曲线b中前10min内CO的平均反应进率v(CO)=
③ 在一恒温恒容的密闭容器中发生反应,下列说法不能说明该反应达到化学平衡状态的是
A.体系的压强保持不变 B.混合气体的密度保持不变
C.2v(CO)正=v(N2)逆 D.CO2的浓度保持不变
④若保持其他条件不变,平衡后再向容器中充入CO和N2各0.8mol,则此时v(正)
⑤若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是点
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。下图是不同催化剂Mn 和Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应的温度分别为

您最近一年使用:0次



