1 . O2对人类有着重要的作用。请回答下列问题:
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ. 2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ. 2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ•mol-1
ⅲ. CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.4kJ•mol-1
则计算CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=_______ kJ•mol-1。
(2)合成硝酸工艺中涉及到反应:2NO(g)+O2(g)=2NO2(g)、2NO2(g) N2O4(g)。T℃时,在恒容密闭容器中以投料比
N2O4(g)。T℃时,在恒容密闭容器中以投料比 =1:1进行投料,容器内总压强p的变化如下表:
=1:1进行投料,容器内总压强p的变化如下表:
已知:a. 2NO2(g) N2O4(g)可认为迅速达到平衡状态。b.时间t=∞时,NO(g)完全反应。
N2O4(g)可认为迅速达到平衡状态。b.时间t=∞时,NO(g)完全反应。
①已知时间为t1min时,测得容器内O2分压p(O2)=10.6 kPa,则此时NO的分压p(NO)_______ kPa。
②T℃时,可逆反应2NO2(g) N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=_______ kPa -1(用平衡分压代替平衡浓度计算,分压=总压×体积分数,写出计算式即可),NO2的平衡转化率为_______ %(保留2位有效数字)。
③若将上述反应容器内温度升高至(T+50)℃,达到平衡时,容器内混合气体的平均相对分子质量减小,则2NO2(g) N2O4(g)ΔH
N2O4(g)ΔH_______ 0(填“>”或“<”)。
(3)人体内化学反应时刻需要O2参与,如广泛存在于肌肉中的肌红蛋白(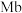 ),具有结合O2的能力,可表示为Mb(aq)+O2(g)
),具有结合O2的能力,可表示为Mb(aq)+O2(g) MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,37℃时,测得平衡常数K=2(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,37℃时,测得平衡常数K=2(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
①平衡时,平衡常数表达式K=_______ [用含α和p(O2)的代数式表示];37℃时,测得人正常呼吸时α的最大值为97.7%,则空气中氧气分压p(O2)=_______ kPa(保留3位有效数字)。
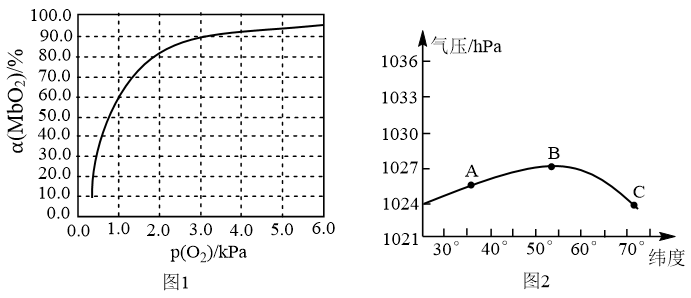
②某天不同纬度的大气压变化曲线如图2所示,某运动员处于A、B、C不同位置时,其体内MbO2的浓度最大位置为_______ (填“A”“B”或“C”)。
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ. 2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ. 2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ•mol-1
ⅲ. CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.4kJ•mol-1
则计算CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=(2)合成硝酸工艺中涉及到反应:2NO(g)+O2(g)=2NO2(g)、2NO2(g)
 N2O4(g)。T℃时,在恒容密闭容器中以投料比
N2O4(g)。T℃时,在恒容密闭容器中以投料比 =1:1进行投料,容器内总压强p的变化如下表:
=1:1进行投料,容器内总压强p的变化如下表:| t/min | 0 | 40 | 80 | 160 | 260 | 700 |  |
| p/kPa | 33.2 | 28.6 | 27.1 | 26.3 | 25.9 | 25.2 | 22.3 |
已知:a. 2NO2(g)
 N2O4(g)可认为迅速达到平衡状态。b.时间t=∞时,NO(g)完全反应。
N2O4(g)可认为迅速达到平衡状态。b.时间t=∞时,NO(g)完全反应。①已知时间为t1min时,测得容器内O2分压p(O2)=10.6 kPa,则此时NO的分压p(NO)
②T℃时,可逆反应2NO2(g)
 N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=③若将上述反应容器内温度升高至(T+50)℃,达到平衡时,容器内混合气体的平均相对分子质量减小,则2NO2(g)
 N2O4(g)ΔH
N2O4(g)ΔH(3)人体内化学反应时刻需要O2参与,如广泛存在于肌肉中的肌红蛋白(
 ),具有结合O2的能力,可表示为Mb(aq)+O2(g)
),具有结合O2的能力,可表示为Mb(aq)+O2(g) MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,37℃时,测得平衡常数K=2(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1,37℃时,测得平衡常数K=2(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
①平衡时,平衡常数表达式K=
②某天不同纬度的大气压变化曲线如图2所示,某运动员处于A、B、C不同位置时,其体内MbO2的浓度最大位置为
您最近一年使用:0次
2021-11-20更新
|
576次组卷
|
2卷引用:黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题
2 . SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
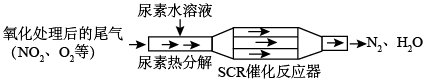
尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式___________ 。
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为___________ ;一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。a电极是电极的___________ 极(填“正”或“负”),a电极的电极反应式为___________ 。
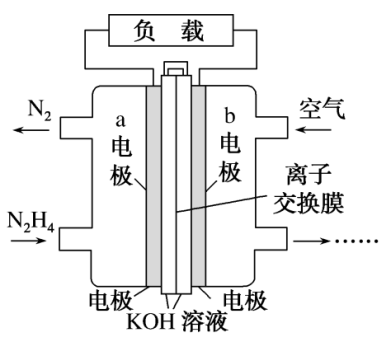
(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K=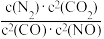 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___________ 。
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
计算在0~2min时段,化学反应速率v(NO2)=___________ mol∙L-1∙min-1。
(1)SCR(选择性催化还原)工作原理:

尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式
(2)肼(N2H4)可以用作燃料电池的原料。肼的结构式为

(3)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)△H3=-221.0kJ·mol-1
若某反应的平衡常数表达式为K=
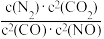 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)已知植物光合作用发生的反应如下:6CO2(g)+6H2O(l)⇌C6H12O6(s)+6O2(g)△H=+669.62kJ/mol,该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是
a.增大CO2的浓度b.取走一半C6H12O6c.加入催化剂d.适当升高温度
(5)N2O5的分解反应2N2O5(g)⇌4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=
您最近一年使用:0次
2021-11-19更新
|
105次组卷
|
2卷引用:黑龙江省龙东地区四校2021-2022学年高三上学期第一次联考化学试题
名校
3 . 研究表明I-可以作为水溶液中SO2歧化反应的催化剂:3SO2(g)+2H2O (l)=2H2SO4 (aq)+S(s) ΔH<0;该过程一般通过如下步骤来实现:①SO2(g)+4I-(aq)+4H+(aq)= S(s)+ 2I2(g) + 2H2O(l) ΔH>0;②I2(g)+2H2O(l)+SO2(g)=SO (aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是
(aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是
 (aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是
(aq)+4H+(aq)+2I-(aq) ΔH<0;已知反应①为慢反应,示意图中能体现上述反应过程中能量变化的是A.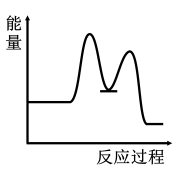 | B.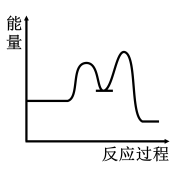 |
C.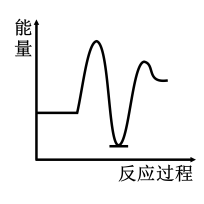 | D.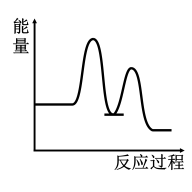 |
您最近一年使用:0次
2021-11-18更新
|
1089次组卷
|
14卷引用:黑龙江省肇东市第四中学2021-2022学年高三12月月考化学试题
黑龙江省肇东市第四中学2021-2022学年高三12月月考化学试题黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题(已下线)2021年1月浙江高考化学试题变式题21-25河北省邯郸市第一中学2021-2022学年上学期高三上学期1月调研化学试题黑龙江省哈尔滨市第三十二中学2021-2022学年高三上学期期末考试化学试题黑龙江省大庆市2023-2024学年高三上学期第一次模拟考试化学试题广东省广州市为明学校2023-2024学年高二上学期学情调研考化学试题广东省珠海市2021-2022学年高二上学期期末考试化学试题广东省三校联考2022-2023学年高二上学期期中考试化学试题湖北省部分省级示范高中(四校联考)2022-2023学年高二上学期期末测试化学试题湖南省宁乡市2022-2023学年高二上学期期末考试化学试题湖北省宜昌市部分省级示范高中校级联合体2022-2023学年高二下学期期中考试化学试题广东省广州市三校2023—2024学年高二上学期期中联考化学考试广东省佛山市顺德区第一中学2023-2024学年高二上学期11月期中考试化学试题
名校
4 . 按要求完成下列各题。
(1)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
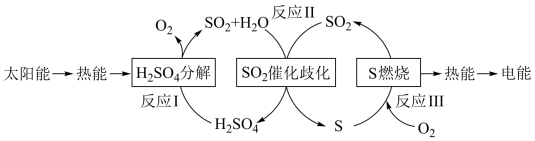
反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297kJ·mol-1
反应Ⅱ的热化学方程式:___ 。
(2)CH4超干重整CO2的催化转化如图1所示:
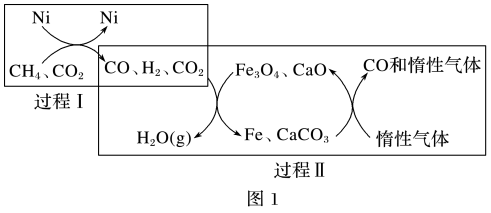
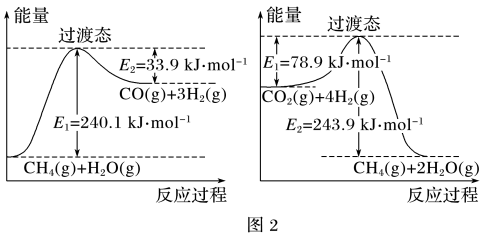
已知相关反应的能量变化如图2所示,过程Ⅰ的热化学方程式为___ 。
(3)关于上述过程Ⅱ的说法不正确的是___ (填字母)。
a.实现了含碳物质与含氢物质的分离 b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应 d.Fe3O4、CaO为催化剂,降低了反应的ΔH
(4)利用如图所示装置测定中和反应反应热的实验步骤如下:
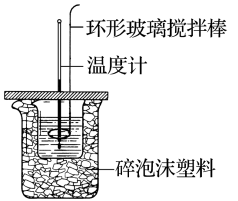
①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。回答下列问题:
Ⅰ.为什么所用NaOH溶液要稍过量?___ 。
Ⅱ.现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___ 。
Ⅲ.假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=___ (结果保留一位小数)。
(1)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297kJ·mol-1
反应Ⅱ的热化学方程式:
(2)CH4超干重整CO2的催化转化如图1所示:


已知相关反应的能量变化如图2所示,过程Ⅰ的热化学方程式为
(3)关于上述过程Ⅱ的说法不正确的是
a.实现了含碳物质与含氢物质的分离 b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应 d.Fe3O4、CaO为催化剂,降低了反应的ΔH
(4)利用如图所示装置测定中和反应反应热的实验步骤如下:

①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。回答下列问题:
Ⅰ.为什么所用NaOH溶液要稍过量?
Ⅱ.现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
Ⅲ.假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
| 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.2 |
| 2 | 20.2 | 20.6 | 24.4 |
| 3 | 20.5 | 20.7 | 23.7 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=
您最近一年使用:0次
名校
解题方法
5 . 盖斯定律是人们研究热化学的重要工具和方法。
(1)已知1molSi固体中有2molSi—Si键,1molO2中有1molO=O键,1molSiO2固体中有4molSi-O键。某些化学键键能(1mol化学键断裂需要吸收的能量)数据如下:
根据化学键数据写出Si(s)在O2中完全燃烧生成SiO2的热化学方式:___________ 。
(2)肼(N2H4)通常作为火箭的燃料。已知3.2g液态肼在O2(g)中完全燃烧,生成N2(g)和H2O(l),放出62.2kJ热量,写出上述反应的热化学方程式:______
(3)煤加工的重要手段是煤的气化,如用煤合成水煤气的原理为C(s)+H2O(g) CO(g)+H2(g) △H。
CO(g)+H2(g) △H。
已知: C(s)+O2(g)=CO2(g) △H=-393.35 kJ·mol-1

CO(g) + O2(g)=CO2(g) △H=-283.0 kJ·mol-1
O2(g)=CO2(g) △H=-283.0 kJ·mol-1
求:①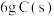 完全燃烧放出的热量为
完全燃烧放出的热量为___________ kJ。
②C(s)+ H2O(g)= CO(g) +H2(g) △H=___________ 。
(1)已知1molSi固体中有2molSi—Si键,1molO2中有1molO=O键,1molSiO2固体中有4molSi-O键。某些化学键键能(1mol化学键断裂需要吸收的能量)数据如下:
| 化学键 | Si—O | Si—Si | O=O |
| 键能(kJ·mol-1) | 460 | 176 | 498 |
根据化学键数据写出Si(s)在O2中完全燃烧生成SiO2的热化学方式:
(2)肼(N2H4)通常作为火箭的燃料。已知3.2g液态肼在O2(g)中完全燃烧,生成N2(g)和H2O(l),放出62.2kJ热量,写出上述反应的热化学方程式:
(3)煤加工的重要手段是煤的气化,如用煤合成水煤气的原理为C(s)+H2O(g)
 CO(g)+H2(g) △H。
CO(g)+H2(g) △H。已知: C(s)+O2(g)=CO2(g) △H=-393.35 kJ·mol-1

CO(g) +
 O2(g)=CO2(g) △H=-283.0 kJ·mol-1
O2(g)=CO2(g) △H=-283.0 kJ·mol-1求:①
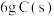 完全燃烧放出的热量为
完全燃烧放出的热量为②C(s)+ H2O(g)= CO(g) +H2(g) △H=
您最近一年使用:0次
解题方法
6 . 已知下列热化学方程式:
①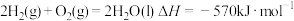
②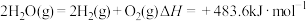
③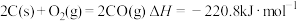
④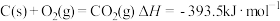
回答下列问题:
(1)上述反应中属于放热反应的是___________ (填写序号)。
(2) 的燃烧热为
的燃烧热为___________ 。
(3)燃烧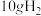 生成液态水,放出的热量为
生成液态水,放出的热量为___________ 。
(4) 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为___________ 。
(5)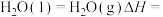
___________ 。
①
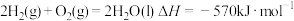
②
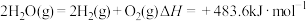
③
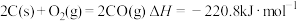
④
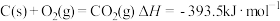
回答下列问题:
(1)上述反应中属于放热反应的是
(2)
 的燃烧热为
的燃烧热为(3)燃烧
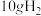 生成液态水,放出的热量为
生成液态水,放出的热量为(4)
 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(5)
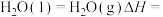
您最近一年使用:0次
2021-11-09更新
|
89次组卷
|
2卷引用:黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题
解题方法
7 . 回答下列问题:
(1)已知:
①P4(s、白磷)+5O2(g)=P4O10(s) ΔH 1=-2983.2 kJ/mol
②P(s、红磷)+ O2(g)=
O2(g)= P4O10(s) ΔH 2= -738.5 kJ/mol
P4O10(s) ΔH 2= -738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式___________ 。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________ ,表示其中和热的热化学方程式为___________ 。
(3)已知水的比热容为c=4.18J·(g·℃)-1,10g 硫黄在 O2中完全燃烧生成气态SO2,放出的热量能使500g H2O温度由18℃升至62.4℃,则硫黄的燃烧热为___________ ,热化学方程式为___________ 。
(1)已知:
①P4(s、白磷)+5O2(g)=P4O10(s) ΔH 1=-2983.2 kJ/mol
②P(s、红磷)+
 O2(g)=
O2(g)= P4O10(s) ΔH 2= -738.5 kJ/mol
P4O10(s) ΔH 2= -738.5 kJ/mol试写出白磷转化为红磷的热化学方程式
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为
(3)已知水的比热容为c=4.18J·(g·℃)-1,10g 硫黄在 O2中完全燃烧生成气态SO2,放出的热量能使500g H2O温度由18℃升至62.4℃,则硫黄的燃烧热为
您最近一年使用:0次
解题方法
8 . 回答下列问题:
(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为___ (填“吸热”或“放热”)反应。
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___ 。
(2)N2H4和H2O2混合可作火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量;2H2O2(l)=O2(g)+2H2O(l) ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g)=N2(g)+2H2O(l)的ΔH=___ kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为___ 。
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为___ 。
(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(2)N2H4和H2O2混合可作火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量;2H2O2(l)=O2(g)+2H2O(l) ΔH=-196.4kJ·mol-1。反应N2H4(l)+O2(g)=N2(g)+2H2O(l)的ΔH=
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为
您最近一年使用:0次
名校
解题方法
9 . 100g碳燃烧所得气体中,CO占 、CO2占
、CO2占 体积,且
体积,且
C(S) + O2(g) = CO (g) △H = -110.35kJ·mol-1
O2(g) = CO (g) △H = -110.35kJ·mol-1
CO (g) + O2(g) =CO2(g) △H = - 282.57kJ·mol-1
O2(g) =CO2(g) △H = - 282.57kJ·mol-1
C(S) + O2(g) = CO2 (g) △H = -392.92kJ·mol-1
与这些碳完全燃烧相比较,损失的热量是
 、CO2占
、CO2占 体积,且
体积,且C(S) +
 O2(g) = CO (g) △H = -110.35kJ·mol-1
O2(g) = CO (g) △H = -110.35kJ·mol-1CO (g) +
 O2(g) =CO2(g) △H = - 282.57kJ·mol-1
O2(g) =CO2(g) △H = - 282.57kJ·mol-1C(S) + O2(g) = CO2 (g) △H = -392.92kJ·mol-1
与这些碳完全燃烧相比较,损失的热量是
| A.392.92kJ | B.2489.44kJ | C.784.92kJ | D.3274.3kJ |
您最近一年使用:0次
2021-10-26更新
|
100次组卷
|
2卷引用:黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年上学期高二10月月考化学试题
9-10高二·山东·假期作业
名校
10 . 已知: ;
;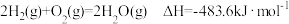 。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
 ;
;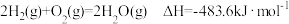 。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为| A.1∶1 | B.1∶2 | C.2∶3 | D.3∶2 |
您最近一年使用:0次
2021-10-26更新
|
958次组卷
|
37卷引用:黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题
黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题甘肃省民勤县第一中学2021-2022学年高二上学期第一次月考化学试题河南省新乡县高级中学2021-2022学年高二上学期第一次月考化学试题山东省淄博市高青县第一中学2021-2022学年高二10月月考化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高三上学期期中考试化学试题(已下线)2014-2015学年吉林延边二中高二9月阶段考试化学试卷2014-2015内蒙古满洲里市七中高二上学期第二次月考化学试卷2015-2016学年山西太原五中高二上第一周考理科化学试卷2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷2016-2017学年四川省成都开发区实验中学高二10月月考化学卷黑龙江省肇东市第一中学2016-2017学年高一下学期期中考试化学试题云南省临沧市第一中学2017-2018学年高二上学期第二次月考理综化学试题河北省邱县第一中学2017-2018学年高二上学期第一次月考化学试题河北省馆陶县第一中学2017-2018学年高二上学期第一次月考化学试题宁夏石嘴山市第三中学2017-2018学年高二下学期第一次月考化学试题【全国百强校】黑龙江省双鸭山市第一中学2017-2018学年高一下学期期末考试化学试题黑龙江省双鸭山市第一中学2018-2019学年高一下学期期末考试化学试题四川省广安市岳池县第一中学2019-2020学年高二上学期第一次月考化学试题浙江省湖州中学2019-2020学年高一下学期3月月考(普通班)化学试题辽源市第五中学2019-2020学年高一下学期第二次月考化学试题重庆市复旦中学2020-2021学度高二上学期第一次段考化学试题云南省昆明市官渡区第一中学2021-2022学年高二上学期期中考试化学试题湖北省黄冈市麻城第二中学2021-2022学年高一下学期4月月考化学试题云南省下关第一中学2023-2024学年高二上学期9月月考化学试题(已下线)2010年安丘中学高二暑期练习化学卷(三)(已下线)2011-2012学年甘肃省白银市平川中恒学校高二上学期期末考试化学(理)试卷2014-2015四川省雅安中学高二下学期开学考试化学试卷2015-2016学年辽宁省实验中学分校高一下期中化学试卷内蒙古杭锦后旗奋斗中学2017-2018学年高二上学期期末考试化学试题【全国校级联考】山西省汾阳市第二高级中学、文水县第二高级中学2016-2017学年高二上学期第一次联考化学试题广东省广州市中山大学附属中学2018-2019学年高二上学期期中考试化学试题江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题河北省临漳县第一中学2019-2020学年高二上学期期中考试化学试题安徽省芜湖市城南实验中学2019-2020学年高二上学期期中考试化学试题(已下线)【南昌新东方】江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题(已下线)第01章 化学反应的热效应(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)第1章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)



