名校
解题方法
1 . MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):

下列说法错误 的是

下列说法
| A.ΔH1(MgCO3)>ΔH1(CaCO3)>0 |
| B.ΔH2(MgCO3)=ΔH2(CaCO3)>0 |
| C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO) |
| D.ΔH1+ΔH2>ΔH3 |
您最近一年使用:0次
2023-11-23更新
|
156次组卷
|
2卷引用:河南省郑州市实验中学2023-2024学年高三上学期期中考试化学试题
2 . 水煤气可以在一定条件下发生反应:  ,现在向 10L恒容密闭容器中充入 CO(g)和
,现在向 10L恒容密闭容器中充入 CO(g)和  ,所得实验数据如表所示。
,所得实验数据如表所示。
下列说法正确的是
 ,现在向 10L恒容密闭容器中充入 CO(g)和
,现在向 10L恒容密闭容器中充入 CO(g)和  ,所得实验数据如表所示。
,所得实验数据如表所示。| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(CO) | n(H₂O) | n(H₂) | ||
| ① | 700 | 0.40 | 0.10 | 0.09 |
| ② | 800 | 0.10 | 0.40 | 0.08 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A.该反应的反应物的总能量大于生成物的总能量 |
B.实验①中,若某时刻测得  ,则此时混合气体中 ,则此时混合气体中  的体积分数为8% 的体积分数为8% |
C.实验①和③中,反应均达到平衡时,平衡常数之比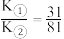 |
| D.实验④中,反应达到平衡时,CO的转化率为 60% |
您最近一年使用:0次
解题方法
3 . 甲烷催化氧化为合成气的主要反应有:
I、
Ⅱ、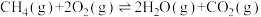
将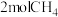 与
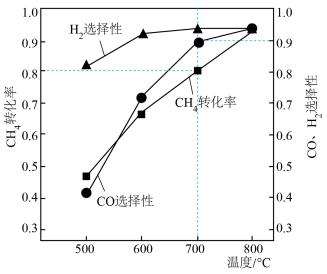
与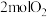 投入密闭容器中反应,不同温度下,相同时间内CH4转化率、H2选择性
投入密闭容器中反应,不同温度下,相同时间内CH4转化率、H2选择性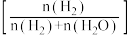 与CO的选择性
与CO的选择性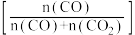 随温度的变化如图所示,下列说法正确的是
随温度的变化如图所示,下列说法正确的是
I、

Ⅱ、
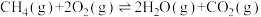
将
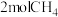 与
与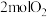 投入密闭容器中反应,不同温度下,相同时间内CH4转化率、H2选择性
投入密闭容器中反应,不同温度下,相同时间内CH4转化率、H2选择性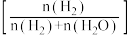 与CO的选择性
与CO的选择性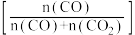 随温度的变化如图所示,下列说法正确的是
随温度的变化如图所示,下列说法正确的是
| A.由题可知,反应I为吸热反应 |
| B.在700℃时,容器中生成的CO2的物质的量为1.44mol |
C.在500℃、600℃、700℃时都可能发生 |
| D.该过程中,低温有利于合成气的生成 |
您最近一年使用:0次
2023-10-07更新
|
646次组卷
|
2卷引用:江苏省南通市海门区2023-2024学年高三上学期第一次调研考试化学试题
名校
解题方法
4 . 聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。回答下列问题:
I.苯乙烯的制备
(1)工业常采用乙苯脱氢的方法制备苯乙烯,其原理如下:
反应甲:C6H5-CH2CH3(g)⇌C6H5-CH=CH2(g)+H2(g) ΔH1
近期科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):
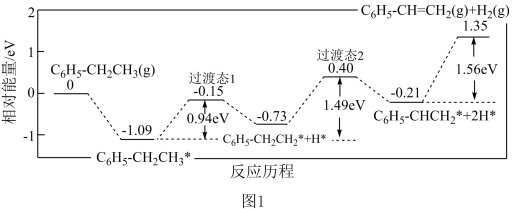
乙苯脱氢制苯乙烯反应的焓变ΔH1___________ 0(选填“大于”或“小于”或“等于”),该反应历程的决速步骤反应方程式为___________ 。
(2)乙苯脱氢是合成苯乙烯的关键步骤。某温度下,向2.0L恒容密闭容器中充入0.10molC6H5CH2CH3(g),测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
计算该温度下的平衡常数K=___________ (结果保留至小数点后两位)。
(3)在913K、100kPa下,以水蒸气作稀释气。Fe2O3作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
反应乙:C6H5C2H5(g)⇌C6H6(g)+CH2=CH2(g)
反应丙:C6H5C2H5(g)+H2(g)⇌C6H5CH3(g)+CH4(g)
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S随乙苯转化率的变化曲线如图2所示,其中曲线b代表的产物是___________ ,理由是___________ 。(S=转化为目的产物所消耗乙苯的量100%)

(4)实验测得,乙苯脱氢反应的速率方程为v正=k正p乙苯,v逆=k逆p苯乙烯p氢气(k正、k逆为速率
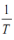 常数,只与温度有关),图3中③代表lgk逆随
常数,只与温度有关),图3中③代表lgk逆随 的变化关系,则能代表lgk正随
的变化关系,则能代表lgk正随 的变化关系的是
的变化关系的是___________ 。
II.苯乙烯的聚合
(5)苯乙烯聚合有多种方法,其中一种方法的关键步骤是某Cu(I)的配合物促进,CuCl是合成该Cu(I)的配合物的关键物质。在CuCl的晶胞中,Cl-的位置如图4所示。Cu+填充于Cl-构成的四面体空隙中,则Cu+的配位数为___________ ;若NA为阿伏加德罗常数的值,该晶体的密度为ρg·cm-3,则该晶胞中Cu+之间的距离为___________ nm(用含ρ、NA的代数式表示)。

I.苯乙烯的制备
(1)工业常采用乙苯脱氢的方法制备苯乙烯,其原理如下:
反应甲:C6H5-CH2CH3(g)⇌C6H5-CH=CH2(g)+H2(g) ΔH1
近期科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图1所示(吸附在催化剂表面的物质用*标注):

乙苯脱氢制苯乙烯反应的焓变ΔH1
(2)乙苯脱氢是合成苯乙烯的关键步骤。某温度下,向2.0L恒容密闭容器中充入0.10molC6H5CH2CH3(g),测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
(3)在913K、100kPa下,以水蒸气作稀释气。Fe2O3作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
反应乙:C6H5C2H5(g)⇌C6H6(g)+CH2=CH2(g)
反应丙:C6H5C2H5(g)+H2(g)⇌C6H5CH3(g)+CH4(g)
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S随乙苯转化率的变化曲线如图2所示,其中曲线b代表的产物是

(4)实验测得,乙苯脱氢反应的速率方程为v正=k正p乙苯,v逆=k逆p苯乙烯p氢气(k正、k逆为速率

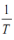 常数,只与温度有关),图3中③代表lgk逆随
常数,只与温度有关),图3中③代表lgk逆随 的变化关系,则能代表lgk正随
的变化关系,则能代表lgk正随 的变化关系的是
的变化关系的是
II.苯乙烯的聚合
(5)苯乙烯聚合有多种方法,其中一种方法的关键步骤是某Cu(I)的配合物促进,CuCl是合成该Cu(I)的配合物的关键物质。在CuCl的晶胞中,Cl-的位置如图4所示。Cu+填充于Cl-构成的四面体空隙中,则Cu+的配位数为

您最近一年使用:0次
2023-09-16更新
|
233次组卷
|
2卷引用:THUSSAT中学生标准学术能力2023-2024学年高三上学期9月诊断性测试理科综合化学试题
名校
解题方法
5 . 用H2O2、KI 和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI 在该反应中的作用:H2O2 + I = H2O+ IO ;H2O2 + IO = H2O+ O2↑+ I 。总反应的化学方程式是________ 。
(2)资料 2:H2O2 分解反应过程中能量变化如图所示,其中①有 KI 加入,②无 KI 加入。下列 判断正确的是___________ (填字母)。

a.加入KI 后改变了反应的路径
b.加入KI 后改变了总反应的能量变化
c.H2O2 + I = H2O + IO 是放热反应
(3)实验中发现,H2O2与 KI 溶液混合后,产生大量气泡,溶液颜色变黄。再加入 CCl4,振荡、静置,气泡明显减少。
资料 3:I2 也可催化H2O2的分解反应。
① 加CCl4 并振荡、静置后还可观察到________ ,说明有 I2 生成。
② 气泡明显减少的原因可能是:ⅰ.H2O2 浓度降低;ⅱ.________ 。以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入 KI 溶液,待溶液变黄后,分成两等份于A、B 两试管中。A 试管加入 CCl4,B 试管不加CCl4,分别振荡、静置。观察到的现象是________ 。
(4)资料 4: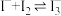 K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向 20 mL 一定浓度的H2O2溶液中加入10 mL 0.10 mol·L−1 KI 溶液,达平衡后,相关微粒浓度如下:
① a =___________ 。
② 该平衡体系中除了含有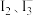 和
和 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是___________ 。
(1)资料1:KI 在该反应中的作用:H2O2 + I = H2O+ IO ;H2O2 + IO = H2O+ O2↑+ I 。总反应的化学方程式是
(2)资料 2:H2O2 分解反应过程中能量变化如图所示,其中①有 KI 加入,②无 KI 加入。下列 判断正确的是

a.加入KI 后改变了反应的路径
b.加入KI 后改变了总反应的能量变化
c.H2O2 + I = H2O + IO 是放热反应
(3)实验中发现,H2O2与 KI 溶液混合后,产生大量气泡,溶液颜色变黄。再加入 CCl4,振荡、静置,气泡明显减少。
资料 3:I2 也可催化H2O2的分解反应。
① 加CCl4 并振荡、静置后还可观察到
② 气泡明显减少的原因可能是:ⅰ.H2O2 浓度降低;ⅱ.
(4)资料 4:
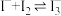 K= 640。
K= 640。为了探究体系中含碘微粒的存在形式,进行实验:向 20 mL 一定浓度的H2O2溶液中加入10 mL 0.10 mol·L−1 KI 溶液,达平衡后,相关微粒浓度如下:
| 微粒 |  |  |  |
| 浓度(mol·L−1) | 2.5×10−3 | a | 4.0×10−3 |
② 该平衡体系中除了含有
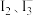 和
和 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是
您最近一年使用:0次
名校
解题方法
6 . N2O是《联合国气候变化框架公约》所列六种温室气体之一。CO和N2O在Fe+作用下转化为N2和CO2,反应的能量变化及反应历程如图所示,两步基元反应为:① N2O+Fe +=N2+FeO+ K1,②CO+FeO+=CO2+Fe+ K2。下列说法不正确的是
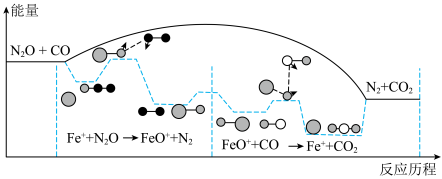

| A.该反应ΔH<0 |
| B.两步反应中,决定总反应速率的是反应① |
| C.升高温度,可提高 N2O 的平衡转化率 |
| D.Fe+增大了活化分子百分数,加快了化学反应速率,但不改变反应的ΔH |
您最近一年使用:0次
2023-07-24更新
|
854次组卷
|
5卷引用:浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题
浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)选择题11-14河南省宜阳县第一高级中学2023-2024学年高二上学期9月开学考试化学试题
名校
解题方法
7 . 已知1,3-丁二烯与HBr加成的能量-反应进程图如图所示(图中 、
、 、
、
表示各步正向反应的焓变 )。下列说法正确的是
 、
、 、
、
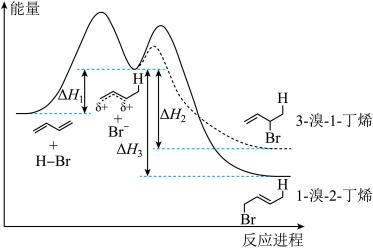
| A.反应时间越长,1,3-丁二烯与HBr反应得到3-溴-1-丁烯的比例越大 |
B.0℃、短时间t min内, 的1,3-丁二烯与HBr完全反应得到两种产物的比例为7:3(设反应前后体积不变),则生成1-溴-2-丁烯的平均速率为 的1,3-丁二烯与HBr完全反应得到两种产物的比例为7:3(设反应前后体积不变),则生成1-溴-2-丁烯的平均速率为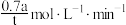 |
C.1,3-丁二烯与HBr反应,生成3-溴-1-丁烯的反应热为 、生成1-溴-2-丁烯的反应热为 、生成1-溴-2-丁烯的反应热为 |
D. 与烯烃结合的一步为决速步, 与烯烃结合的一步为决速步, 进攻时活化能小的方向得到3-溴-1-丁烯 进攻时活化能小的方向得到3-溴-1-丁烯 |
您最近一年使用:0次
2023-07-16更新
|
1758次组卷
|
4卷引用:浙江省杭州市2023届高三上学期11月份教学质量检测化学试题
解题方法
8 . 工业上,以 为原料,通过不同反应生产更高价值的
为原料,通过不同反应生产更高价值的 。
。
I. 直接分解生产
直接分解生产 :
:
反应①:
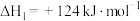
反应②: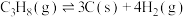

请回答:
(1)恒温下,往恒容(10L)反应釜中通入4mol (g)(仅考虑发生上述反应)。某时刻
(g)(仅考虑发生上述反应)。某时刻 转化率为20%,
转化率为20%, 选择性为40%,则该时刻反应①的浓度商
选择性为40%,则该时刻反应①的浓度商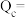
_______ 。
(2)下列说法正确的是_______。
(3)研究表明,在固体催化剂N存在下,反应①分三步进行,生成 步骤的活化能远大于生成
步骤的活化能远大于生成 步骤的活化能,且开始一段时间内
步骤的活化能,且开始一段时间内 与
与 的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图
的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图_______ 。

II. 辅助
辅助 生产
生产 :
:
反应③:
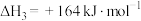
恒温恒压下, 和
和 按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:
按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:

(4)关于反应过程,下列说法正确的是_______。
(5)对该反应器催化剂表面上CO的生成速率和 的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和
的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和 的消耗速率不相等的可能原因
的消耗速率不相等的可能原因_______ 。

 为原料,通过不同反应生产更高价值的
为原料,通过不同反应生产更高价值的 。
。I.
 直接分解生产
直接分解生产 :
:反应①:

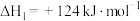
反应②:
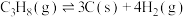

请回答:
(1)恒温下,往恒容(10L)反应釜中通入4mol
 (g)(仅考虑发生上述反应)。某时刻
(g)(仅考虑发生上述反应)。某时刻 转化率为20%,
转化率为20%, 选择性为40%,则该时刻反应①的浓度商
选择性为40%,则该时刻反应①的浓度商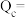
(2)下列说法正确的是_______。
| A.反应①能自发进行的条件是低温 |
| B.温度升高,反应②的平衡常数增大 |
| C.压强增大,活化分子百分数增多,导致反应①速率加快 |
| D.可通过C(s)的物质的量不再变化判断反应②达到平衡状态 |
 步骤的活化能远大于生成
步骤的活化能远大于生成 步骤的活化能,且开始一段时间内
步骤的活化能,且开始一段时间内 与
与 的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图
的生成速率几乎相同(不考虑反应②)。画出步骤2和步骤3生成产物的反应过程能量示意图
II.
 辅助
辅助 生产
生产 :
:反应③:

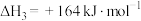
恒温恒压下,
 和
和 按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:
按物质的量之比1:1以一定流速通入装有某复合催化剂的反应器中,反应过程如图所示:
(4)关于反应过程,下列说法正确的是_______。
A.M可循环利用, 不可循环利用 不可循环利用 |
| B.过程1作用力a是氢键,过程2涉及极性键的形成和断裂 |
| C.温度升高,过程1和过程2的反应速率均加快,总反应速率一定加快 |
D.其他条件不变,更换不同催化剂,同样生产1mol  (g)所需能量不一定相同 (g)所需能量不一定相同 |
 的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和
的消耗速率进行测定,所得实验结果如图2,请结合具体反应说明CO的生成速率和 的消耗速率不相等的可能原因
的消耗速率不相等的可能原因
您最近一年使用:0次
9 . XH和 反应生成X或XO的能量-历程变化如图。在恒温恒容的密闭容器中加入一定量的XH和
反应生成X或XO的能量-历程变化如图。在恒温恒容的密闭容器中加入一定量的XH和 ,t1 min时测得
,t1 min时测得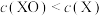 ,下列有关说法不正确的是
,下列有关说法不正确的是

 反应生成X或XO的能量-历程变化如图。在恒温恒容的密闭容器中加入一定量的XH和
反应生成X或XO的能量-历程变化如图。在恒温恒容的密闭容器中加入一定量的XH和 ,t1 min时测得
,t1 min时测得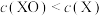 ,下列有关说法不正确的是
,下列有关说法不正确的是
| A.t1 min时容器内的压强比初始状态更大 |
B.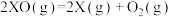 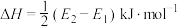 |
C.只改变反应温度,t1 min时可能出现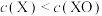 |
D.相同条件下,在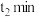 ( (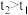 )时测定,可能出现 )时测定,可能出现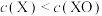 |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
10 . 气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k c(N2O)
c(N2O) [c(I2)]0.5(k为速率常数),下列表述正确的是 。
[c(I2)]0.5(k为速率常数),下列表述正确的是 。
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体:2CO(g)+2NO(g) N2(g)+2CO2(g)△H1。
N2(g)+2CO2(g)△H1。
①已知:反应N2(g)+O2(g) 2NO(g) △H2=+180.0kJ
2NO(g) △H2=+180.0kJ mol﹣1,若CO的燃烧热△H为﹣283.5kJ/mol,则△H1=
mol﹣1,若CO的燃烧热△H为﹣283.5kJ/mol,则△H1=___________ 。
②若在恒容的密闭容器中,充入2molCO和1molNO,下列选项中不能说明该反应已经达到平衡状态的是___________ 。
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.2v(N2)正=v(CO)逆
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以La0.8A0.2BCoO3+x(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:I.NO(g)+□→NO(a)
Ⅱ.2NO(a)→2N(a)+O2(g)
Ⅲ.2N(a)→N2(g)+2□
Ⅳ.2NO(a)→N2(g)+2O(a)
V.2O(a)→O2(g)+2□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是_______ 。
(3)①在不同催化剂甲、乙作用下,NO的脱氮率在相同时间内随温度的变化如图所示,工业生产中选用甲,理由是___________ 。

②在催化剂甲作用下,反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。

该化学反应的速率主要由反应___________ 决定(填“I”“Ⅱ”或“Ⅲ”,下同),提高反应温度,逆反应速率增加最大的是反应___________ 。
(4)反应
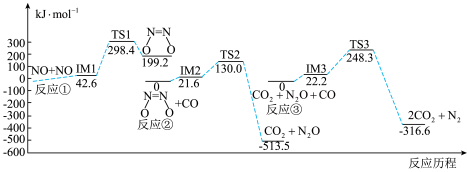
 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如下图所示(TS表示过渡态、IM表示中间产物),三个基元反应中,属于放热反应的是
可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如下图所示(TS表示过渡态、IM表示中间产物),三个基元反应中,属于放热反应的是___________ (填标号①、②或③),决速步是图中___________ (填标号①、②或③)。
(1)N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k
 c(N2O)
c(N2O) [c(I2)]0.5(k为速率常数),下列表述正确的是 。
[c(I2)]0.5(k为速率常数),下列表述正确的是 。| A.N2O分解反应中,k值与是否含碘蒸气有关 |
| B.第三步对总反应速率起决定作用 |
| C.第二步活化能比第三步小 |
| D.IO为反应的催化剂 |
 N2(g)+2CO2(g)△H1。
N2(g)+2CO2(g)△H1。①已知:反应N2(g)+O2(g)
 2NO(g) △H2=+180.0kJ
2NO(g) △H2=+180.0kJ mol﹣1,若CO的燃烧热△H为﹣283.5kJ/mol,则△H1=
mol﹣1,若CO的燃烧热△H为﹣283.5kJ/mol,则△H1=②若在恒容的密闭容器中,充入2molCO和1molNO,下列选项中不能说明该反应已经达到平衡状态的是
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.2v(N2)正=v(CO)逆
③研究表明氮氧化物的脱除率除了与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以La0.8A0.2BCoO3+x(A、B均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:I.NO(g)+□→NO(a)
Ⅱ.2NO(a)→2N(a)+O2(g)
Ⅲ.2N(a)→N2(g)+2□
Ⅳ.2NO(a)→N2(g)+2O(a)
V.2O(a)→O2(g)+2□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是
(3)①在不同催化剂甲、乙作用下,NO的脱氮率在相同时间内随温度的变化如图所示,工业生产中选用甲,理由是

②在催化剂甲作用下,反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。

该化学反应的速率主要由反应
(4)反应

 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如下图所示(TS表示过渡态、IM表示中间产物),三个基元反应中,属于放热反应的是
可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如下图所示(TS表示过渡态、IM表示中间产物),三个基元反应中,属于放热反应的是
您最近一年使用:0次



