解题方法
1 . 下列实验方案达不到相应实验目的的是
| 选项 | 实验方案 | 实验目的 |
| A | 分别测定稀NaOH溶液和稀氨水与稀盐酸发生中和反应的反应热 | 确定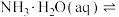 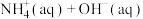 的 的 |
| B | 将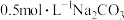 溶液逐渐升温,用pH传感器测量溶液的pH 溶液逐渐升温,用pH传感器测量溶液的pH | 探究温度对 水解平衡的影响 水解平衡的影响 |
| C | 常温下,向两支盛有5mL  溶液的试管中分别加入5mL 溶液的试管中分别加入5mL 硫酸、5mL 硫酸、5mL 硫酸 硫酸 | 探究浓度对反应速率的影响 |
| D | 将5mL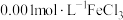 溶液和5mL 溶液和5mL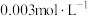 KSCN溶液混合后,再加入KCl固体 KSCN溶液混合后,再加入KCl固体 | 探究浓度对化学平衡: 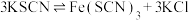 的影响 的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-22更新
|
63次组卷
|
4卷引用:河南省焦作市2023-2024学年高二上学期1月期末化学试题
名校
解题方法
2 . 不同的化学反应具有不同的反应热,人们可以通过多种方法获得反应热的数据,通常用实验进行测定,也可以进行理论推算。
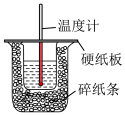
(1)在科学研究中,科学家常用量热计来测量反应热。我校某化学兴趣小组的同学欲测定中和热。用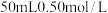 盐酸与
盐酸与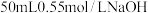 溶液在如图所示的简化装置中进行中和反应。则:
溶液在如图所示的简化装置中进行中和反应。则:
①从实验装置上看,图中尚缺少的一种仪器是______ 。
②大烧杯上如不盖硬纸板,求得的中和热数值_________ (填“偏大”“偏小”或“无影响”)。
③如果用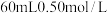 盐酸与
盐酸与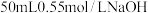 溶液进行反应,与上述实验相比,所求中和热
溶液进行反应,与上述实验相比,所求中和热_____ (填“相等”或“不相等”)。
(2) 与
与 在
在 催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用
催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用 作催化剂时该反应的过程示意图如图所示:
作催化剂时该反应的过程示意图如图所示:
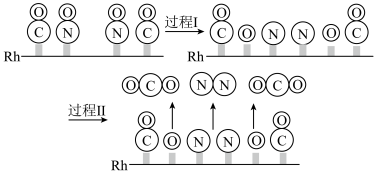
①过程Ⅰ为________ (填“吸热”或“放热”)过程。
②已知过程Ⅰ的焓变为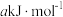 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为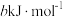 ,则该反应的热化学方程式为
,则该反应的热化学方程式为_______ 。
(3)已知: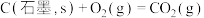
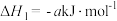
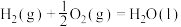
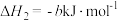
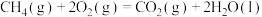
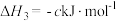
计算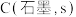 与
与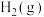 反应生成
反应生成 的
的 为
为______  (用含
(用含 的式子表示)。
的式子表示)。
(4)标准状况下, 在
在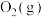 中完全燃烧生成
中完全燃烧生成 和
和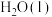 ,放出
,放出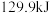 热量,请写出表示
热量,请写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:_______ 。

(1)在科学研究中,科学家常用量热计来测量反应热。我校某化学兴趣小组的同学欲测定中和热。用
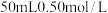 盐酸与
盐酸与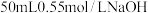 溶液在如图所示的简化装置中进行中和反应。则:
溶液在如图所示的简化装置中进行中和反应。则:①从实验装置上看,图中尚缺少的一种仪器是
②大烧杯上如不盖硬纸板,求得的中和热数值
③如果用
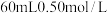 盐酸与
盐酸与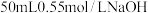 溶液进行反应,与上述实验相比,所求中和热
溶液进行反应,与上述实验相比,所求中和热(2)
 与
与 在
在 催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用
催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用 作催化剂时该反应的过程示意图如图所示:
作催化剂时该反应的过程示意图如图所示:
①过程Ⅰ为
②已知过程Ⅰ的焓变为
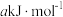 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为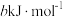 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(3)已知:
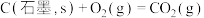
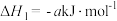
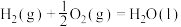
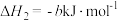
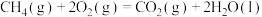
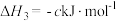
计算
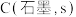 与
与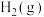 反应生成
反应生成 的
的 为
为 (用含
(用含 的式子表示)。
的式子表示)。(4)标准状况下,
 在
在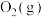 中完全燃烧生成
中完全燃烧生成 和
和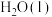 ,放出
,放出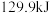 热量,请写出表示
热量,请写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:
您最近一年使用:0次
3 . 在载人航天器中,可以利用 和
和 的反应,将航天员呼出的
的反应,将航天员呼出的 转化为
转化为 等,发生的反应为
等,发生的反应为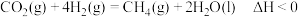 ,下列说法正确的是
,下列说法正确的是
 和
和 的反应,将航天员呼出的
的反应,将航天员呼出的 转化为
转化为 等,发生的反应为
等,发生的反应为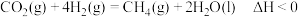 ,下列说法正确的是
,下列说法正确的是| A.该反应的反应物键能总和大于生成物键能总和 |
B.加入合适的催化剂, 的值将减小 的值将减小 |
C.每断裂 键,同时形成 键,同时形成 键 键 |
D.对于反应 与 与 的值相同 的值相同 |
您最近一年使用:0次
2024-02-13更新
|
158次组卷
|
3卷引用:贵州省黔东南州2023-2024学年高二上学期 期末化学试题
名校
4 . 一定温度下,在恒容密闭容器中充入乙烯和环丙烷,发生反应:

下列叙述错误的是

下列叙述错误的是
| A.其他条件不变,增大乙烯浓度,能提高正反应速率 |
| B.当压强不变时,反应达到平衡状态 |
C.其他条件不变,增大光照强度, 会增大 会增大 |
| D.平衡后加入催化剂,平衡不移动 |
您最近一年使用:0次
2024-02-08更新
|
96次组卷
|
2卷引用:河南省南阳市六校2023-2024学年高二上学期1月期末联考化学试题
5 . 合成甲醇的绿色新途径是利用含有 的工业废气为碳源,涉及的主要反应如下:
的工业废气为碳源,涉及的主要反应如下:
I.

Ⅱ.
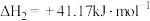
Ⅲ.___________
(1)已知 ,写出反应Ⅲ的热化学方程式:
,写出反应Ⅲ的热化学方程式:___________ ; 、
、 与
与 分别为反应I、Ⅱ、Ⅲ的平衡常数,其关系为
分别为反应I、Ⅱ、Ⅲ的平衡常数,其关系为
___________ 。
(2)在恒温恒容下反应物投料比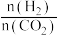 对
对 平衡转化率
平衡转化率 的影响如图A所示,相同时间内甲醇产率
的影响如图A所示,相同时间内甲醇产率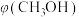 随反应温度的变化如图B所示。
随反应温度的变化如图B所示。
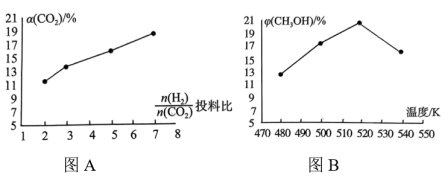
图A中随着投料比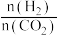 的增大,
的增大, 增大的原因是
增大的原因是___________ 。根据图B分析甲醇产率呈如图所示变化的原因是___________ 。
(3)研发低温下优良的催化剂是目前二氧化碳加氢合成甲醇研究对象之一,通过相关实验获得两种催化剂X、Y对反应I的催化效能曲线如图所示,已知Arrhenius经验公式为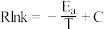 (
( 为速率常数,
为速率常数, 为活化能,R和C为常数)。
为活化能,R和C为常数)。
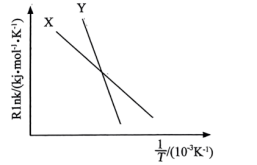
其中催化效能较高的是___________ (填“X”或“Y”)。
(4)将 与
与 按投料比
按投料比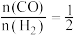 充入密闭容器中,在温度为
充入密闭容器中,在温度为 、压强为
、压强为 时只发生反应Ⅲ,测得平衡时混合气体中
时只发生反应Ⅲ,测得平衡时混合气体中 的物质的量分数为50%,则
的物质的量分数为50%,则 的转化率为
的转化率为___________ ;压强平衡常数
___________ (用平衡分压代替平衡浓度,平衡分压=总压×体积分数,用含 的代数式表示)。
的代数式表示)。
 的工业废气为碳源,涉及的主要反应如下:
的工业废气为碳源,涉及的主要反应如下:I.


Ⅱ.

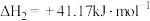
Ⅲ.___________

(1)已知
 ,写出反应Ⅲ的热化学方程式:
,写出反应Ⅲ的热化学方程式: 、
、 与
与 分别为反应I、Ⅱ、Ⅲ的平衡常数,其关系为
分别为反应I、Ⅱ、Ⅲ的平衡常数,其关系为
(2)在恒温恒容下反应物投料比
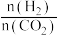 对
对 平衡转化率
平衡转化率 的影响如图A所示,相同时间内甲醇产率
的影响如图A所示,相同时间内甲醇产率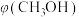 随反应温度的变化如图B所示。
随反应温度的变化如图B所示。
图A中随着投料比
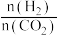 的增大,
的增大, 增大的原因是
增大的原因是(3)研发低温下优良的催化剂是目前二氧化碳加氢合成甲醇研究对象之一,通过相关实验获得两种催化剂X、Y对反应I的催化效能曲线如图所示,已知Arrhenius经验公式为
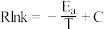 (
( 为速率常数,
为速率常数, 为活化能,R和C为常数)。
为活化能,R和C为常数)。
其中催化效能较高的是
(4)将
 与
与 按投料比
按投料比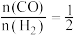 充入密闭容器中,在温度为
充入密闭容器中,在温度为 、压强为
、压强为 时只发生反应Ⅲ,测得平衡时混合气体中
时只发生反应Ⅲ,测得平衡时混合气体中 的物质的量分数为50%,则
的物质的量分数为50%,则 的转化率为
的转化率为
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-02-02更新
|
160次组卷
|
2卷引用:山东省济南市2023-2024学年高二上学期1月期末化学试题
名校
解题方法
6 . 磷及其化合物应用广泛,磷元素有白磷、红磷、黑磷等单质。
(1)一定条件下,红磷在氯气中燃烧的产物有两种( 和
和 ),反应过程中的能量变化关系如图所示。回答下列问题:
),反应过程中的能量变化关系如图所示。回答下列问题:
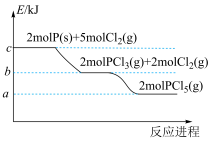
写出固态红磷在一定量的 中完全燃烧生成气态物质(
中完全燃烧生成气态物质( )的热化学方程式:
)的热化学方程式:____________________________ 。( 用图中字母表示)
用图中字母表示)
(2)白磷( )在
)在 中燃烧有如下转化关系。
中燃烧有如下转化关系。
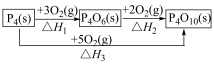
其中
_____________ (用含 和
和 的代数式表示)。
的代数式表示)。
(3)已知: (s,白磷)
(s,白磷) (s,黑磷)
(s,黑磷)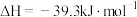 ;
;
 (s,白磷)
(s,白磷) (s,红磷)
(s,红磷)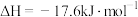 ;
;
由此推知,其中最稳定的磷单质是__________ (填“白磷”、“黑磷”或“红磷”)。
(1)一定条件下,红磷在氯气中燃烧的产物有两种(
 和
和 ),反应过程中的能量变化关系如图所示。回答下列问题:
),反应过程中的能量变化关系如图所示。回答下列问题:
写出固态红磷在一定量的
 中完全燃烧生成气态物质(
中完全燃烧生成气态物质( )的热化学方程式:
)的热化学方程式: 用图中字母表示)
用图中字母表示)(2)白磷(
 )在
)在 中燃烧有如下转化关系。
中燃烧有如下转化关系。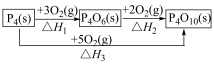
其中

 和
和 的代数式表示)。
的代数式表示)。(3)已知:
 (s,白磷)
(s,白磷) (s,黑磷)
(s,黑磷)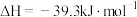 ;
; (s,白磷)
(s,白磷) (s,红磷)
(s,红磷)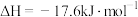 ;
;由此推知,其中最稳定的磷单质是
您最近一年使用:0次
名校
解题方法
7 . 在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下
反应I:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)
反应II:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
(1)已知:C2H4(g)+3O2(g)=2CO2(g)+2H2Og) 1=﹣1323.2kJ/mol
1=﹣1323.2kJ/mol
H2(g) O2(g)=H2O(g)
O2(g)=H2O(g)  2=﹣241.8kJ/mol
2=﹣241.8kJ/mol
请计算反应I的 =
=___________ 。
(2)在体积为1L的恒容密闭容器中,起始n(CO2)=1mol,发生反应II制取甲醇,如图表示反应II在起始投料比【投料比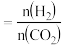 】分别为a、b时,CO2的平衡转化率随温度变化的关系
】分别为a、b时,CO2的平衡转化率随温度变化的关系
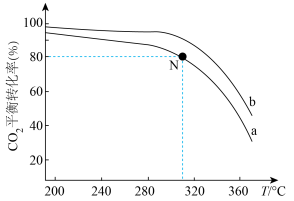
①投料比:a___________ b。(填“>”、“<”或“=”)
②310℃时,已知投料比a=4,求N点平衡常数K=___________ 。(保留两位有效数字)
③当投料比等于3时,关于反应II的说法正确的___________ 。
A.达到平衡后CO2和H2的平衡转化率相等
B.当v正(CO2)=3v逆(H2),该反应达到平衡状态
C.若反应改在恒压条件下进行,则放出的热量比恒容条件下少
D.当达到平衡后,再次充入1molCO2、3molH2,CO2的平衡转化率减小
反应I:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)
反应II:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
(1)已知:C2H4(g)+3O2(g)=2CO2(g)+2H2Og)
 1=﹣1323.2kJ/mol
1=﹣1323.2kJ/molH2(g)
 O2(g)=H2O(g)
O2(g)=H2O(g)  2=﹣241.8kJ/mol
2=﹣241.8kJ/mol请计算反应I的
 =
=(2)在体积为1L的恒容密闭容器中,起始n(CO2)=1mol,发生反应II制取甲醇,如图表示反应II在起始投料比【投料比
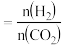 】分别为a、b时,CO2的平衡转化率随温度变化的关系
】分别为a、b时,CO2的平衡转化率随温度变化的关系
①投料比:a
②310℃时,已知投料比a=4,求N点平衡常数K=
③当投料比等于3时,关于反应II的说法正确的
A.达到平衡后CO2和H2的平衡转化率相等
B.当v正(CO2)=3v逆(H2),该反应达到平衡状态
C.若反应改在恒压条件下进行,则放出的热量比恒容条件下少
D.当达到平衡后,再次充入1molCO2、3molH2,CO2的平衡转化率减小
您最近一年使用:0次
解题方法
8 . 氢能源是最具应用前景的能源之一,甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法,其涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ: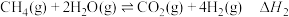
反应Ⅲ:
回答下列问题:
(1)
___________  ,反应Ⅱ能在
,反应Ⅱ能在___________ (填“高温”或“低温”)的条件下自发进行。
(2)某温度下,按照投料比 加入密闭容器中发生反应Ⅰ,平衡时
加入密闭容器中发生反应Ⅰ,平衡时 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为___________ (填分数);实际生产中反应物投料比小于反应的化学计量数之比,目的是___________ 。
(3)在常压、600℃条件下,向体系中加入适量生石灰后可提高 的产率。应用化学平衡移动原理解释原因
的产率。应用化学平衡移动原理解释原因___________ 。
(4)在T℃、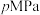 条件下,向恒温恒容密闭容器中充入
条件下,向恒温恒容密闭容器中充入 水蒸气和
水蒸气和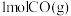 ,发生反应Ⅲ,达平衡时,
,发生反应Ⅲ,达平衡时, 的转化率为
的转化率为 。平衡时,
。平衡时, 的平衡分压为
的平衡分压为___________  ,此温度下,该反应的平衡常数
,此温度下,该反应的平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
(5)调整CO和 初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:___________ 。
反应Ⅰ:

反应Ⅱ:
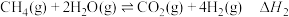
反应Ⅲ:

回答下列问题:
(1)

 ,反应Ⅱ能在
,反应Ⅱ能在(2)某温度下,按照投料比
 加入密闭容器中发生反应Ⅰ,平衡时
加入密闭容器中发生反应Ⅰ,平衡时 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为(3)在常压、600℃条件下,向体系中加入适量生石灰后可提高
 的产率。应用化学平衡移动原理解释原因
的产率。应用化学平衡移动原理解释原因(4)在T℃、
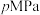 条件下,向恒温恒容密闭容器中充入
条件下,向恒温恒容密闭容器中充入 水蒸气和
水蒸气和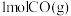 ,发生反应Ⅲ,达平衡时,
,发生反应Ⅲ,达平衡时, 的转化率为
的转化率为 。平衡时,
。平衡时, 的平衡分压为
的平衡分压为 ,此温度下,该反应的平衡常数
,此温度下,该反应的平衡常数
 物质的量分数)。
物质的量分数)。(5)调整CO和
 初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
您最近一年使用:0次
解题方法
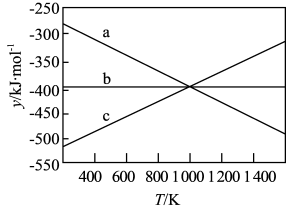
9 . 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答: 和
和 的反应体系中:
的反应体系中:
反应1: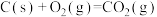
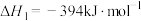
反应2: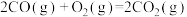
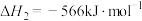
①反应3: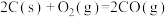
 =
=___________  。
。
②设 ,反应1、2和3的
,反应1、2和3的 随温度的变化关系如上图所示。图中对应于反应2的线条是
随温度的变化关系如上图所示。图中对应于反应2的线条是___________ 。
③一定压强下,随着温度的升高,气体中 与
与 的物质的量之比
的物质的量之比___________ (选填“增大”“减小”“不变”“无法判断”)。
(2)水煤气反应: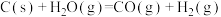
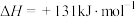 。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是
。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是___________ 。
(3)一氧化碳变换反应: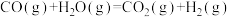
 。
。
①一定温度下,向恒容密闭容器中通入1.0mol 和1.0mol
和1.0mol ,压强为2kPa.反应达到平衡后测得
,压强为2kPa.反应达到平衡后测得 的物质的量为0.75mol,则反应的压强平衡常数为
的物质的量为0.75mol,则反应的压强平衡常数为___________ 。
②维持与题①相同的温度和总压,提高水蒸气的比例,使 的平衡转化率提高到90%,则原料气中水蒸气和
的平衡转化率提高到90%,则原料气中水蒸气和 的物质的量之比为
的物质的量之比为___________ 。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是___________ 。
A.反应温度越高越好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,能量-反应过程如图所示。该催化反应反应机理: ;步骤Ⅱ:
;步骤Ⅱ:___________ 。
 和
和 的反应体系中:
的反应体系中:反应1:
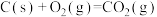
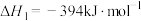
反应2:
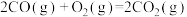
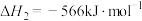
①反应3:
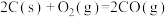
 =
= 。
。②设
 ,反应1、2和3的
,反应1、2和3的 随温度的变化关系如上图所示。图中对应于反应2的线条是
随温度的变化关系如上图所示。图中对应于反应2的线条是③一定压强下,随着温度的升高,气体中
 与
与 的物质的量之比
的物质的量之比(2)水煤气反应:
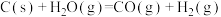
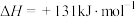 。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是
。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是(3)一氧化碳变换反应:
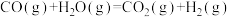
 。
。①一定温度下,向恒容密闭容器中通入1.0mol
 和1.0mol
和1.0mol ,压强为2kPa.反应达到平衡后测得
,压强为2kPa.反应达到平衡后测得 的物质的量为0.75mol,则反应的压强平衡常数为
的物质的量为0.75mol,则反应的压强平衡常数为②维持与题①相同的温度和总压,提高水蒸气的比例,使
 的平衡转化率提高到90%,则原料气中水蒸气和
的平衡转化率提高到90%,则原料气中水蒸气和 的物质的量之比为
的物质的量之比为③生产过程中,为了提高变换反应的速率,下列措施中合适的是
A.反应温度越高越好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,能量-反应过程如图所示。该催化反应反应机理:
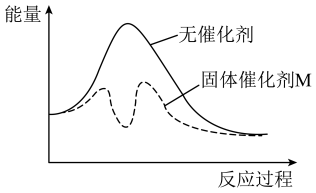
 ;步骤Ⅱ:
;步骤Ⅱ:
您最近一年使用:0次
名校
10 . 载人航天工程对科学研究及太空资源开发具有重要意义,载人航天器必须给航天员提供基本的生存条件,其中涉及氧气再生、二氧化碳清除、水处理以及食物供给等。
(1)氢氧燃料电池是短寿命载人航天器电源的一个合适的选择。下图是一种碱性氢氧燃料电池结构示意图。
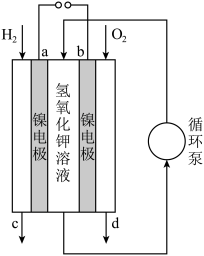
①电池的正极是___________ (填“a”或“b”),该电极上发生的电极反应是___________ 。
②电池工作时产生的水会以水蒸气的形式被反应物气体带出,在出口加装冷凝器可以将水回收。冷凝器应装在出口___________ (填“c”或“d”)处。
③电池工作时,电解质溶液会因稀释及吸收 而变质,此时电解质溶液的
而变质,此时电解质溶液的 将
将___________ (填“升高”或“降低”)。通过循环泵可及时浓缩或更换变质的溶液,维特电池的正常工作。
(2)我国自行研制的“神舟”飞船使用了镍镉蓄电池组,其充放电时发生的反应为: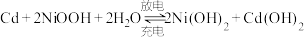 ,其电池装置如图所示,阴离子交换膜两侧均注入
,其电池装置如图所示,阴离子交换膜两侧均注入 溶液。
溶液。
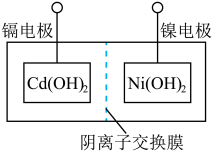
①下列对于该镍镉电池的分析中,正确的是___________ 。
A.图示中的电池应先充电后,再使用
B.充电时, 从镍电极区迁移进入镉电极区
从镍电极区迁移进入镉电极区
C.放电时,镍电极为电池的负极,镉电极为电池的正极
D.充电或放电一段时间后,两电极区溶液中 的物质的量均未改变
的物质的量均未改变
②镍镉电池在充电时,镉电极上发生的电极反应为___________ ;当 和
和 耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体
耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体___________ (填化学式);镍电极上则会发生反应___________ (填电极反应式)而产生 。
。
(3)载人航天器中氧气的再生是一个重要环节。利用萨巴蒂尔反应可将人呼出的二氧化碳转化为甲烷和水,配合太阳能电解水可以实现氧气的再生(大体流程如下图)。
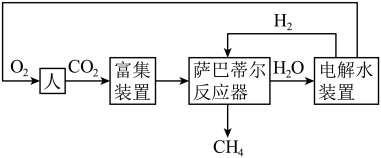
已知:

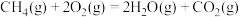
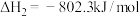
萨巴蒂尔反应: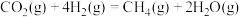

①萨巴蒂尔反应的焓变
___________ 。
②电解水装置中 产生于
产生于___________ (填“正”、“负”、“阴”或“阳”)极。
③通过巴萨尔反应器和电解水装置能否实现H2与 的完全再生?
的完全再生?___________ (填“能”或“否”)
(1)氢氧燃料电池是短寿命载人航天器电源的一个合适的选择。下图是一种碱性氢氧燃料电池结构示意图。

①电池的正极是
②电池工作时产生的水会以水蒸气的形式被反应物气体带出,在出口加装冷凝器可以将水回收。冷凝器应装在出口
③电池工作时,电解质溶液会因稀释及吸收
 而变质,此时电解质溶液的
而变质,此时电解质溶液的 将
将(2)我国自行研制的“神舟”飞船使用了镍镉蓄电池组,其充放电时发生的反应为:
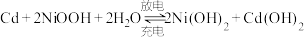 ,其电池装置如图所示,阴离子交换膜两侧均注入
,其电池装置如图所示,阴离子交换膜两侧均注入 溶液。
溶液。
①下列对于该镍镉电池的分析中,正确的是
A.图示中的电池应先充电后,再使用
B.充电时,
 从镍电极区迁移进入镉电极区
从镍电极区迁移进入镉电极区C.放电时,镍电极为电池的负极,镉电极为电池的正极
D.充电或放电一段时间后,两电极区溶液中
 的物质的量均未改变
的物质的量均未改变②镍镉电池在充电时,镉电极上发生的电极反应为
 和
和 耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体
耗尽后仍继续充电,则会在电极发生副反应而造成安全隐患,称为电池过充电。此时镉电极上将生成气体 。
。(3)载人航天器中氧气的再生是一个重要环节。利用萨巴蒂尔反应可将人呼出的二氧化碳转化为甲烷和水,配合太阳能电解水可以实现氧气的再生(大体流程如下图)。

已知:


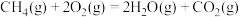
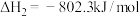
萨巴蒂尔反应:
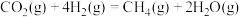

①萨巴蒂尔反应的焓变

②电解水装置中
 产生于
产生于③通过巴萨尔反应器和电解水装置能否实现H2与
 的完全再生?
的完全再生?
您最近一年使用:0次



